3.3 盐类的水解 课件(14张PPT)
文档属性
| 名称 | 3.3 盐类的水解 课件(14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 344.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 13:04:59 | ||
图片预览





文档简介
(共14张PPT)
盐类的水解(二)
高中化学
学习任务与目标
1.通过本节课的学习了解盐类水解的影响因素, 能运用平衡移
动原理分析盐类水解平衡的移动, 并能调控水解平衡的方向。
2.过探究实验以及对实验现象的讨论, 发展宏微结合分析问题
的能力, 发展“ 变化观念与平衡思想” 的学科素养;
3. 能够通过所学知识分析日常生活中相似的现象, 发展理论联
系实际的能力以及综合分析能力。
内因 化学反应的本质特点
外因{ 浓度 增加浓度, 平衡向减少浓度方向移动
“盐类的水解平衡” 是化学平衡的 一种
高中化学
温故知新
影响化学平衡的因素有哪些?
温度 升高温度, 平衡向吸热方向移动
压强 有气体参与的反应才考虑
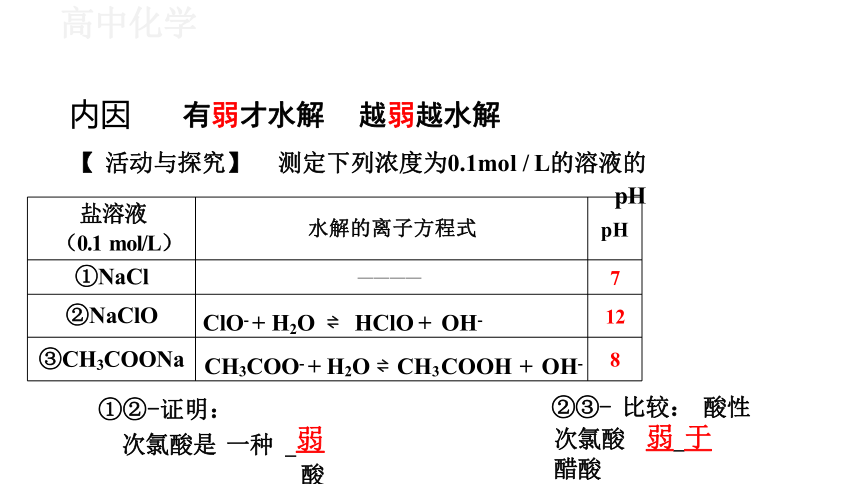
盐溶液 (0.1 mol/L) 水解的离子方程式
pH
①NaCl ————
7
②NaClO ClO- + H2O HClO + OH-
12
③CH3COONa CH3COO- + H2O CH3COOH + OH-
8
内因 有弱才水解 越弱越水解
【 活动与探究】 测定下列浓度为0.1mol / L的溶液的pH
①②-证明:
次氯酸是 一种 弱 酸
②③- 比较: 酸性 次氯酸 弱 于 醋酸
高中化学
高中化学
练习:
相同物质的量浓度的NaX 、NaY 、NaZ三种溶液的pH分别
为7 、 8 、 9, 则相同物质的量浓度的 HX 、HY 、HZ的酸性 强弱顺序为 。
HX > HY > HZ
高中化学
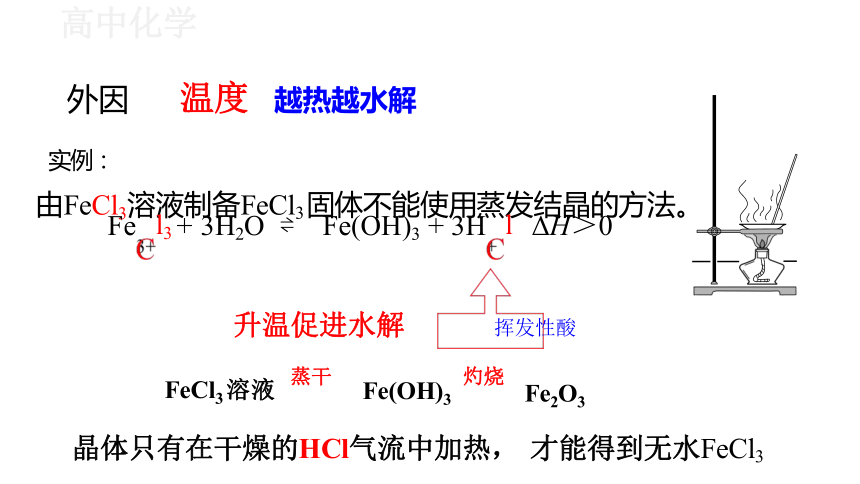
外因 温度 越热越水解
由FeCl3溶液制备FeCl3 固体不能使用蒸发结晶的方法。 Fe l3 + 3H2O Fe(OH)3 + 3H l ΔH>0
升温促进水解 挥发性酸
FeCl3 溶液 蒸干 Fe(OH)3 灼烧 Fe2O3
晶体只有在干燥的HCl气流中加热, 才能得到无水FeCl3
实例:
应用:
FeCl3 可用作净水剂。
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH>0
升温促进水解
还有哪些因素可以调控水解平衡正向移动?
高中化学
pH 50 mL 0.1 mol/L FeCl3 溶液 1.8 5 mL 0.1 mol/L FeCl3 溶液 加水稀释到50 mL 2.2
高中化学
外因 浓度 越稀越水解
Fe3+ + 3H2O Fe(OH)3 + 3H+
2.8
应用:
实验室如何保存 FeCl2溶液?
Fe2+ + 2H2O Fe(OH)2 + 2H+
加 少量 稀盐酸 和 Fe粉
Fe + 2Fe3+ = 3Fe2+
高中化学
外因 外加
酸 抑制水解呈酸性的盐的水解
Fe2+ + 2H2O Fe(OH)2 + 2H+
+
2OH-
抑制水解呈酸性的盐的水解
应用:
实验室如何保存 FeCl2溶液?
调节pH, 可实现选择性沉淀金属离子。
促进水解呈酸性的盐的水解
根据平衡移动的原理具体分析
高中化学
外加
酸
碱
外因
2H O
=
2
高中化学
应用:
工业上如何从混有 Fe2+ 、Fe3+ 的溶液中提纯 Cu2+?
离子种类 Fe2+ Fe3+
Cu2+
沉淀 pH 范围 (25℃) 7.6~9.6 1.9~3.7
4.7~6.7
Fe(OH)3 Fe(OH)2
4.7 6.7 7.6
3.7
Cu(OH)2
Cu2+
9.6
1.9
高中化学
【生活应用】
为什么用肥皂洗衣服时
用温水比冷水洗得干净一些?
肥皂主要成分:
硬脂酸钠(C17H35COONa); 硬脂酸 是 一种 一 元弱酸
C17H35COO- + H2O = C17H35COOH + OH- ΔH>0
高中化学
盐类水解的影响因素
1. 内因 盐本身的性质: 越弱越水解
2. 外因 ( 1) 温度 升温促进水解 越热越水解
(2) 浓度 稀释促进水解 越稀越水解
(3)外加酸碱 根据平衡移动的原理具体分析
感谢同学们的收看, 祝同学们学习进步!
高中化学
盐类的水解(二)
高中化学
学习任务与目标
1.通过本节课的学习了解盐类水解的影响因素, 能运用平衡移
动原理分析盐类水解平衡的移动, 并能调控水解平衡的方向。
2.过探究实验以及对实验现象的讨论, 发展宏微结合分析问题
的能力, 发展“ 变化观念与平衡思想” 的学科素养;
3. 能够通过所学知识分析日常生活中相似的现象, 发展理论联
系实际的能力以及综合分析能力。
内因 化学反应的本质特点
外因{ 浓度 增加浓度, 平衡向减少浓度方向移动
“盐类的水解平衡” 是化学平衡的 一种
高中化学
温故知新
影响化学平衡的因素有哪些?
温度 升高温度, 平衡向吸热方向移动
压强 有气体参与的反应才考虑
盐溶液 (0.1 mol/L) 水解的离子方程式
pH
①NaCl ————
7
②NaClO ClO- + H2O HClO + OH-
12
③CH3COONa CH3COO- + H2O CH3COOH + OH-
8
内因 有弱才水解 越弱越水解
【 活动与探究】 测定下列浓度为0.1mol / L的溶液的pH
①②-证明:
次氯酸是 一种 弱 酸
②③- 比较: 酸性 次氯酸 弱 于 醋酸
高中化学
高中化学
练习:
相同物质的量浓度的NaX 、NaY 、NaZ三种溶液的pH分别
为7 、 8 、 9, 则相同物质的量浓度的 HX 、HY 、HZ的酸性 强弱顺序为 。
HX > HY > HZ
高中化学
外因 温度 越热越水解
由FeCl3溶液制备FeCl3 固体不能使用蒸发结晶的方法。 Fe l3 + 3H2O Fe(OH)3 + 3H l ΔH>0
升温促进水解 挥发性酸
FeCl3 溶液 蒸干 Fe(OH)3 灼烧 Fe2O3
晶体只有在干燥的HCl气流中加热, 才能得到无水FeCl3
实例:
应用:
FeCl3 可用作净水剂。
Fe3+ + 3H2O Fe(OH)3 + 3H+ ΔH>0
升温促进水解
还有哪些因素可以调控水解平衡正向移动?
高中化学
pH 50 mL 0.1 mol/L FeCl3 溶液 1.8 5 mL 0.1 mol/L FeCl3 溶液 加水稀释到50 mL 2.2
高中化学
外因 浓度 越稀越水解
Fe3+ + 3H2O Fe(OH)3 + 3H+
2.8
应用:
实验室如何保存 FeCl2溶液?
Fe2+ + 2H2O Fe(OH)2 + 2H+
加 少量 稀盐酸 和 Fe粉
Fe + 2Fe3+ = 3Fe2+
高中化学
外因 外加
酸 抑制水解呈酸性的盐的水解
Fe2+ + 2H2O Fe(OH)2 + 2H+
+
2OH-
抑制水解呈酸性的盐的水解
应用:
实验室如何保存 FeCl2溶液?
调节pH, 可实现选择性沉淀金属离子。
促进水解呈酸性的盐的水解
根据平衡移动的原理具体分析
高中化学
外加
酸
碱
外因
2H O
=
2
高中化学
应用:
工业上如何从混有 Fe2+ 、Fe3+ 的溶液中提纯 Cu2+?
离子种类 Fe2+ Fe3+
Cu2+
沉淀 pH 范围 (25℃) 7.6~9.6 1.9~3.7
4.7~6.7
Fe(OH)3 Fe(OH)2
4.7 6.7 7.6
3.7
Cu(OH)2
Cu2+
9.6
1.9
高中化学
【生活应用】
为什么用肥皂洗衣服时
用温水比冷水洗得干净一些?
肥皂主要成分:
硬脂酸钠(C17H35COONa); 硬脂酸 是 一种 一 元弱酸
C17H35COO- + H2O = C17H35COOH + OH- ΔH>0
高中化学
盐类水解的影响因素
1. 内因 盐本身的性质: 越弱越水解
2. 外因 ( 1) 温度 升温促进水解 越热越水解
(2) 浓度 稀释促进水解 越稀越水解
(3)外加酸碱 根据平衡移动的原理具体分析
感谢同学们的收看, 祝同学们学习进步!
高中化学
