3.3 盐类的水解 课件(21张PPT)
文档属性
| 名称 | 3.3 盐类的水解 课件(21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 134.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 13:05:59 | ||
图片预览







文档简介
(共21张PPT)
盐类的水解(三)
高中化学
学习目标
(1 ) 通过从单 一 溶液到混合溶液中微粒浓度大小的比较,
培养分析问题和解决问题的能力, 发展宏微结合的素养。
(2 ) 通过分析水解平衡与水的电离平衡的相互作用, 建立
三大守恒的思想, 并能够运用守恒思想解释溶液中离子的浓度 大小关系及溶液的酸碱性。
(3 ) 通过对混合溶液的微粒浓度关系分析, 学会综合考虑
复杂体系中的微粒之间量的关系, 区分酸与碱反应时恰好中和 和溶液呈中性的不同。
25℃时,Ka(CH3COOH)=1.7×10-5mol/L
CH3COONa + H2O CH3COOH + NaOH
25℃时, 0.1mol/L CH3COONa(aq) , 水解程度0.0075%
水解平衡
物质变化: 产生CH3COOH 和 NaOH
微粒变化: 产生CH3COOH 、 OH- 增多
思考: 微粒间量的关系如何?
知识角度:
知 识 回 顾
高中化学
高中化学
溶液中离子浓度大小比较
例1: 0.1mol/L CH3COONa溶液中各种离子浓度大小比较
资料信息:25℃时 ,0.1mol/L CH3COONa(aq) , 水解程度0.0075%
c(CH3COO-) c(CH3COOH)
c(CH3COO-) 接近于0.1mol/L
CH3COO- +H2O CH3COOH +OH-
CH3COOH约
7.5×10-6mol/L
c(Na+)> c(CH3COO-)
c(OH-)> c(H+)
高中化学
溶液中离子浓度大小比较
例1: 0.1mol/L CH3COONa溶液中各种离子浓度大小比较
实验数据:25℃时 ,0.1mol/L CH3COONa(aq) ,pH约为8.9
CH3COO- + H2O 、CH3COOH +OH-
一 H+ +OH-
c(H+)约1×10-8.9mol/L
> c(OH-)> c(H+)
c(Na+)> c(CH3COO-)
c(CH3COO-) 接近0.1mol/L
c(OH-)约
1×10-5.1mol/L
微量 微粒
主要 微粒
H2O
高中化学
溶液中离子浓度大小比较
例1: 0.1mol/L CH3COONa溶液中各种离子浓度大小比较
c(Na+)> c(CH3COO-) > c(OH-)> c(H+)
思考: 溶液中的c(CH3COOH) 和 c(H+)关系如何?
c(OH-)> c(CH3COOH) > c(H+)
主:①CH3COO- + H2O、 CH3COOH +OH-
次: ②H2O 、H+ +OH-
c(H+)约1×10-8.9mol/L
c(OH-)约
1×10-5.1mol/L
CH3COOH约
7.5×10-6mol/L
高中化学
方 法 归 纳
0.1mol/L CH3COONa溶液中各种离子浓度大小比较:
确定存在平衡和平衡间的主次关系
完成微粒浓度大小比较
c(Na+)> c(CH3COO-)> c(OH-) > c(H+)
>c(CH3COOH)
分清常量微粒和微量微粒
Na+ 、CH3COO- > CH3COOH 、OH- 、H+
高中化学
CH3COONa溶液中微粒关系分析
存在微粒: 除水分子外
CH3COO- CH3COOH Na+ H+ OH-
n(Na+)+n(H+) =n(CH3COO-)+n(OH-)
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
n(正电荷) =n(负电荷)
电荷守恒:
n(Na+) =n(CH3COO-)+n(CH3COOH)
c(Na+) =c(CH3COOH)+c(CH3COO-)
CH3COONa溶液中微粒关系分析
CH3COONa固体中:n(Na+) =n(CH3COO-)
CH3COO-和CH3COOH
物料守恒:
高中化学
水解后
1
1
1
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
c(Na+) =c(CH3COOH)+c(CH3COO-)
c(H+)+c(CH3COOH) =c(OH-)
H+水 OH-水
高中化学
CH3COONa溶液中微粒关系分析
电荷守恒:
物料守恒: 质子守恒:
H O
2
高中化学
【自主训练】 分析0.1mol/L NH4Cl溶液中的微粒关系
(1 ) 各种离子浓度大小比较:
c(Cl-) > c(NH4+) > c(H+) >c(OH-)
(2 ) 三个 守恒关系:
c(NH4+) + c(H+) = c(Cl-) + c(OH-)
c(NH4+) + c(NH3 ·H2O) = c(Cl-)
c(H+) = c(OH-) + c(NH3 ·H2O)
忽略NH3 ·H2O的分解
高中化学
例2. 0.1mol/L Na2CO3 溶液中微粒关系分析
(1 ) 各种离子浓度大小比较:
CO32- + H2O 、 、 HCO3- + H2O 、 H2O 、
HCO3- + OH-
H2CO3 + OH-
H+ +OH-
c(Na+) > c(CO32-) >c(OH-) >c(HCO3-)
> 2c(CO32-)
水解程度 相差极大
> c(H+)
c(Na+) + c(H+) = c(HCO3-) + 2c(CO32-)+ c(OH-)
c(Na+) = 2[c(HCO3-) + c(CO32-)+ c(H2CO3)]
2 1
忽略: 碳酸的分解
c(OH-) = c(H+) + c(HCO3-) + 2c(H2CO3)
高中化学
例2. Na2CO3 溶液中微粒关系分析
(2 ) 三个 守恒关系:
电荷守恒:
物料守恒:
质子守恒:
高中化学
混合后溶液中的离子浓度比较
例3.将同物质的量的醋酸与醋酸钠加入 一杯水
中, 最终所得溶液呈酸性, 则混合液中:
(1 ) 各种离子浓度大小比较:
CH3COO- >1
Na+ = 1
CH3COOH <1 c(H+) > c(OH-)
1CH3COO-
1Na+
1CH3COOH
c(H+) = c(OH-)
c(CH3COO-) > c(Na+)> c(CH3COOH) > c(H+) > c(OH-)
混合时
混合后
高中化学
混合后溶液中的离子浓度比较
例3. 同物质的量的醋酸与 醋酸钠混合, 所得溶液
呈酸性, 则混合液中: 1 1
(2 ) 三个 守恒关系:
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
2 c(Na+) = c(CH3COOH)+c(CH3COO-)
1 2
2c(H+)+c(CH3COOH) =2c(OH-) +c(CH3COO-)
例4.将浓度均为0.2 mol/L醋酸与NaOH溶液等体积
1L 1L
混合, 溶液呈 碱 性, 混合后溶液中离子浓度的大小
关系为: c(Na+)>c(CH3COO-) > c(OH-) > c(H+) 。
所得溶液: 0. 1 mol/L CH COONa
高中化学
混合后溶液中的离子浓度比较
恰好完全中和
3
高中化学
混合后溶液中的离子浓度比较
例5. 将0.2 mol/L醋酸与0.1 mol/LNaOH溶液等体积
混合, 所得溶液呈酸性, 混合后溶液中离子浓度的大
小关系为: c(CH3COO-) >c(。Na+) > c(H+) > c(OH-)
c(CH3COOH)
CH3COONa和CH3COOH
0.05 mol/L 0.05 mol/L
混合后的溶液:
1L 1L
高中化学
混合后溶液中的离子浓度比较
思路 :
怎么混合?
依所得溶液 的成分分析
混合成什么样?
高中化学
课 后 训 练
1. 25 ℃ 时, pH=3的醋酸与pH=11NaOH等体积
混合, 混合后溶液呈 酸 性, 溶液中离子浓度的关系
c(CH3COOH)>
为: c(CH3COO-)>。c(Na+) > c(H+) > c(OH-)
Na+ 、OH-
c (OH-) = 1×10-3mol/L
1 L
多
H+ 、CH3COO- 、CH3COOH
c (H+) = 1×10-3mol/L
1 L
CH3COONa少 CH3COOH多
+
高中化学
课 后 训 练
2. 25 ℃时, 若醋酸溶液与NaOH溶液等体积混
合, 若混合后溶液成中性, 则混合前:
c(醋酸) > c(烧碱) , c(H+)酸 < c(OH-)碱
谢谢同学们的收看!
祝同学们学业进步!
高中化学
盐类的水解(三)
高中化学
学习目标
(1 ) 通过从单 一 溶液到混合溶液中微粒浓度大小的比较,
培养分析问题和解决问题的能力, 发展宏微结合的素养。
(2 ) 通过分析水解平衡与水的电离平衡的相互作用, 建立
三大守恒的思想, 并能够运用守恒思想解释溶液中离子的浓度 大小关系及溶液的酸碱性。
(3 ) 通过对混合溶液的微粒浓度关系分析, 学会综合考虑
复杂体系中的微粒之间量的关系, 区分酸与碱反应时恰好中和 和溶液呈中性的不同。
25℃时,Ka(CH3COOH)=1.7×10-5mol/L
CH3COONa + H2O CH3COOH + NaOH
25℃时, 0.1mol/L CH3COONa(aq) , 水解程度0.0075%
水解平衡
物质变化: 产生CH3COOH 和 NaOH
微粒变化: 产生CH3COOH 、 OH- 增多
思考: 微粒间量的关系如何?
知识角度:
知 识 回 顾
高中化学
高中化学
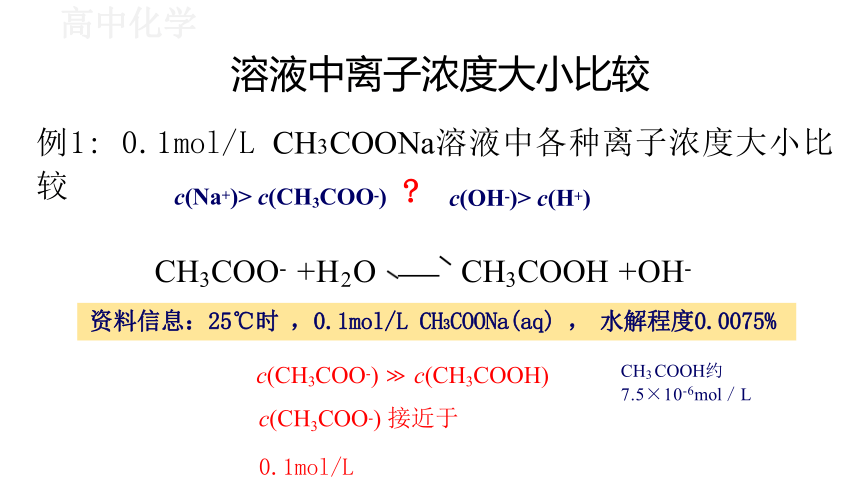
溶液中离子浓度大小比较
例1: 0.1mol/L CH3COONa溶液中各种离子浓度大小比较
资料信息:25℃时 ,0.1mol/L CH3COONa(aq) , 水解程度0.0075%
c(CH3COO-) c(CH3COOH)
c(CH3COO-) 接近于0.1mol/L
CH3COO- +H2O CH3COOH +OH-
CH3COOH约
7.5×10-6mol/L
c(Na+)> c(CH3COO-)
c(OH-)> c(H+)
高中化学
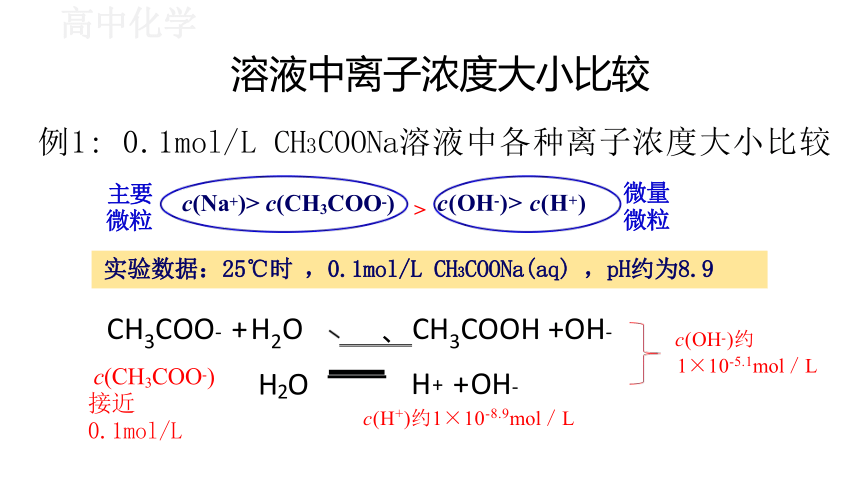
溶液中离子浓度大小比较
例1: 0.1mol/L CH3COONa溶液中各种离子浓度大小比较
实验数据:25℃时 ,0.1mol/L CH3COONa(aq) ,pH约为8.9
CH3COO- + H2O 、CH3COOH +OH-
一 H+ +OH-
c(H+)约1×10-8.9mol/L
> c(OH-)> c(H+)
c(Na+)> c(CH3COO-)
c(CH3COO-) 接近0.1mol/L
c(OH-)约
1×10-5.1mol/L
微量 微粒
主要 微粒
H2O
高中化学
溶液中离子浓度大小比较
例1: 0.1mol/L CH3COONa溶液中各种离子浓度大小比较
c(Na+)> c(CH3COO-) > c(OH-)> c(H+)
思考: 溶液中的c(CH3COOH) 和 c(H+)关系如何?
c(OH-)> c(CH3COOH) > c(H+)
主:①CH3COO- + H2O、 CH3COOH +OH-
次: ②H2O 、H+ +OH-
c(H+)约1×10-8.9mol/L
c(OH-)约
1×10-5.1mol/L
CH3COOH约
7.5×10-6mol/L
高中化学
方 法 归 纳
0.1mol/L CH3COONa溶液中各种离子浓度大小比较:
确定存在平衡和平衡间的主次关系
完成微粒浓度大小比较
c(Na+)> c(CH3COO-)> c(OH-) > c(H+)
>c(CH3COOH)
分清常量微粒和微量微粒
Na+ 、CH3COO- > CH3COOH 、OH- 、H+
高中化学
CH3COONa溶液中微粒关系分析
存在微粒: 除水分子外
CH3COO- CH3COOH Na+ H+ OH-
n(Na+)+n(H+) =n(CH3COO-)+n(OH-)
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
n(正电荷) =n(负电荷)
电荷守恒:
n(Na+) =n(CH3COO-)+n(CH3COOH)
c(Na+) =c(CH3COOH)+c(CH3COO-)
CH3COONa溶液中微粒关系分析
CH3COONa固体中:n(Na+) =n(CH3COO-)
CH3COO-和CH3COOH
物料守恒:
高中化学
水解后
1
1
1
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
c(Na+) =c(CH3COOH)+c(CH3COO-)
c(H+)+c(CH3COOH) =c(OH-)
H+水 OH-水
高中化学
CH3COONa溶液中微粒关系分析
电荷守恒:
物料守恒: 质子守恒:
H O
2
高中化学
【自主训练】 分析0.1mol/L NH4Cl溶液中的微粒关系
(1 ) 各种离子浓度大小比较:
c(Cl-) > c(NH4+) > c(H+) >c(OH-)
(2 ) 三个 守恒关系:
c(NH4+) + c(H+) = c(Cl-) + c(OH-)
c(NH4+) + c(NH3 ·H2O) = c(Cl-)
c(H+) = c(OH-) + c(NH3 ·H2O)
忽略NH3 ·H2O的分解
高中化学
例2. 0.1mol/L Na2CO3 溶液中微粒关系分析
(1 ) 各种离子浓度大小比较:
CO32- + H2O 、 、 HCO3- + H2O 、 H2O 、
HCO3- + OH-
H2CO3 + OH-
H+ +OH-
c(Na+) > c(CO32-) >c(OH-) >c(HCO3-)
> 2c(CO32-)
水解程度 相差极大
> c(H+)
c(Na+) + c(H+) = c(HCO3-) + 2c(CO32-)+ c(OH-)
c(Na+) = 2[c(HCO3-) + c(CO32-)+ c(H2CO3)]
2 1
忽略: 碳酸的分解
c(OH-) = c(H+) + c(HCO3-) + 2c(H2CO3)
高中化学
例2. Na2CO3 溶液中微粒关系分析
(2 ) 三个 守恒关系:
电荷守恒:
物料守恒:
质子守恒:
高中化学
混合后溶液中的离子浓度比较
例3.将同物质的量的醋酸与醋酸钠加入 一杯水
中, 最终所得溶液呈酸性, 则混合液中:
(1 ) 各种离子浓度大小比较:
CH3COO- >1
Na+ = 1
CH3COOH <1 c(H+) > c(OH-)
1CH3COO-
1Na+
1CH3COOH
c(H+) = c(OH-)
c(CH3COO-) > c(Na+)> c(CH3COOH) > c(H+) > c(OH-)
混合时
混合后
高中化学
混合后溶液中的离子浓度比较
例3. 同物质的量的醋酸与 醋酸钠混合, 所得溶液
呈酸性, 则混合液中: 1 1
(2 ) 三个 守恒关系:
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
2 c(Na+) = c(CH3COOH)+c(CH3COO-)
1 2
2c(H+)+c(CH3COOH) =2c(OH-) +c(CH3COO-)
例4.将浓度均为0.2 mol/L醋酸与NaOH溶液等体积
1L 1L
混合, 溶液呈 碱 性, 混合后溶液中离子浓度的大小
关系为: c(Na+)>c(CH3COO-) > c(OH-) > c(H+) 。
所得溶液: 0. 1 mol/L CH COONa
高中化学
混合后溶液中的离子浓度比较
恰好完全中和
3
高中化学
混合后溶液中的离子浓度比较
例5. 将0.2 mol/L醋酸与0.1 mol/LNaOH溶液等体积
混合, 所得溶液呈酸性, 混合后溶液中离子浓度的大
小关系为: c(CH3COO-) >c(。Na+) > c(H+) > c(OH-)
c(CH3COOH)
CH3COONa和CH3COOH
0.05 mol/L 0.05 mol/L
混合后的溶液:
1L 1L
高中化学
混合后溶液中的离子浓度比较
思路 :
怎么混合?
依所得溶液 的成分分析
混合成什么样?
高中化学
课 后 训 练
1. 25 ℃ 时, pH=3的醋酸与pH=11NaOH等体积
混合, 混合后溶液呈 酸 性, 溶液中离子浓度的关系
c(CH3COOH)>
为: c(CH3COO-)>。c(Na+) > c(H+) > c(OH-)
Na+ 、OH-
c (OH-) = 1×10-3mol/L
1 L
多
H+ 、CH3COO- 、CH3COOH
c (H+) = 1×10-3mol/L
1 L
CH3COONa少 CH3COOH多
+
高中化学
课 后 训 练
2. 25 ℃时, 若醋酸溶液与NaOH溶液等体积混
合, 若混合后溶液成中性, 则混合前:
c(醋酸) > c(烧碱) , c(H+)酸 < c(OH-)碱
谢谢同学们的收看!
祝同学们学业进步!
高中化学
