3.3 盐类的水解 课件(共16张PPT)
文档属性
| 名称 | 3.3 盐类的水解 课件(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 13:07:00 | ||
图片预览





文档简介
(共16张PPT)
盐类的水解(一)
高中化学
学习目标
1 化学学科知识
3.通过比较分析常见盐溶液的pH及对应弱电解质电离平衡常数, 掌握盐类水解的规律。
4.通过盐类水解平衡的分析,学会盐类水解反应方程式书写。
1. 通过常见盐溶液酸碱性测定,了解盐的类别与水解之间的关系。
2.通过分析溶液中微粒的行为,认识盐类水解的本质。
高中化学
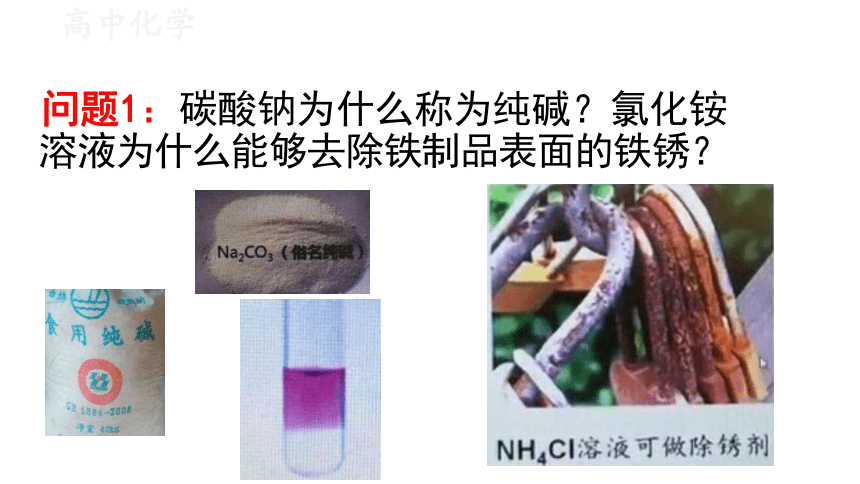
问题1:碳酸钠为什么称为纯碱?氯化铵 溶液为什么能够去除铁制品表面的铁锈?
高中化学
一、 实验研究——测定常见盐溶液的酸碱性
问题2:常见盐溶液的酸碱性如何呢?
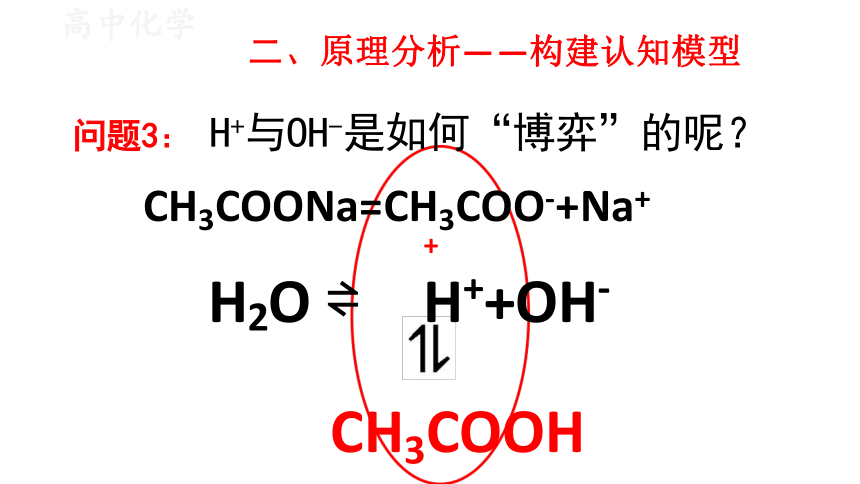
问题3: H+与OH-是如何“博弈”的呢?
CH3COONa=CH3COO-+Na+
+
H2O H++OH-
CH3COOH
二、原理分析— —构建认知模型
高中化学
高中化学
三、应用认知模型——测定0.1mol/L常见盐溶液的pH
问题4:同浓度常见盐溶液的pH有差异吗 ?
高中化学
高中化学
问题5:温度对水解有影响吗?
以氢氧化铁胶体制备和 蒸发氯化铁溶液为例
结论:水解反应是吸热反应
3.NH4Cl 溶液呈酸性的原因
NH4Cl 溶 液 中 的 电 离 ( 写 出 电 离 方 程
式):H2O H +OH , NH4Cl===Cl +N
NH 与水电离的 OH-结合生成了难电离的 NH3 ·H2O
,
水的电离平衡移动方向是电离的方向 ,溶液中有关离
子浓度的变化是 c(NH ) 减小 ,c(OH-) 减小 ,
c(H+) 增大 ,c(H+)>c(OH-),NH4Cl 溶液呈 酸性 。 化学方程式是 NH4Cl+H2O NH3 ·H2O+HCl ,
离子方程式是 NH +H2O —NH3 ·H2O+H 。
+
4
+
4
+
4
+
-
-
+
4
+
H2O — OH- + H+
1
NH3 · H2O
NH4 +与水电离的OH-结合形成弱电解质
NH3 · H2O ,使c(OH-)减小,使水的电离平 衡正向移动,c(H+)>c(OH-)
四、平衡表征——水解反应方程式书写
NH4CI-=NH+4+ ct
高中化学
认知模型
1 . 有下列五种盐溶液:①NaClO 、②(NH4)2SO4、③Na2CO3 、④AlCl3 、⑤KNO3。
回答下列问题:
(1)不能破坏水的电离平衡的是⑤ , 溶液呈酸性的是 ②④ , pH>7 的是①③ 。
(2)根据盐类水解的实质(弱离子+H2O)及水解反应的特点(可逆反应、程度微弱) ,写出下
列盐类水解的离子方程式:
①NaClO: ClO-+H2O— HClO+OH- ;
②(NH4)2SO4: NH4++H2O NH3 · H2O+H+ ;
③Na2CO3: CO32-+H2O — HCO3-+OH-、HCO3-+H2O H2CO3+OH- ;
盐类水解离子方程式的书写
④AlCl3: Al3++3H2O — A l(OH)3+3H+ 。
高中化学
五、平衡常数——水解反应的限度
问题6:一般水解反应进行的程度很大吗?
NH4++H2O NH3 · H2O + H+
初始浓度 0.1 0 10-7
平衡浓度 0.1 -10-5.5 ≈0.1 1 0-5.5 10-5.5
c(NH3 · H2O) ·c( H+)c(OH-) Kw
Kh= = = 6.25×10-10
c(NH4+) c(OH-) Kb
归纳总结
1. 盐类水解的实质
在溶液中盐电离出来的离子(弱碱的阳离子或弱酸的阴离子)结合水电离出的OH- 或H+ 生成弱电解质, 破坏了水的电离平衡,促进了水的电离,使溶液显示不同的酸性、碱性或中性。
弱碱阳离子:NH 、Al3+、Fe3+、Cu2+等。
弱酸根离子: CO -、HCO 、 AlO 、 SO -、 S2-、HS-、 ClO-、
3
2
2
-
3
-
3
2
4
+
2. 盐类水解的规律
常见的 “弱”离子
3. 盐类水解的特点
有弱才水解,无弱不水解,
谁弱谁水解,谁强显谁性,
都弱都水解,弱弱具体定。
CH3COO- 、F-等。 微弱、 吸热、
可逆。
1 . 下列关于酸性溶液的叙述中正确的是 ( A )
A .可能是盐的水溶液
B .一定是酸的水溶液
C .溶液中 c(H+)D .不含有 OH- 的溶液
2 . 下列说法正确的是 ( D )
A.盐溶液都是中性的
B .盐溶液的酸碱性与盐的类型无关
C .NaHCO3 溶液显酸性
D .Na2CO3 溶液显碱性,是因为溶液中 c(OH-)>c(H+)
高中化学
定义: 在水溶液中盐电离出来的离子与水所 电离的H+或OH-结合生成弱电解质的反应。
高中化学
感谢同学们收看!
高中化学
盐类的水解(一)
高中化学
学习目标
1 化学学科知识
3.通过比较分析常见盐溶液的pH及对应弱电解质电离平衡常数, 掌握盐类水解的规律。
4.通过盐类水解平衡的分析,学会盐类水解反应方程式书写。
1. 通过常见盐溶液酸碱性测定,了解盐的类别与水解之间的关系。
2.通过分析溶液中微粒的行为,认识盐类水解的本质。
高中化学
问题1:碳酸钠为什么称为纯碱?氯化铵 溶液为什么能够去除铁制品表面的铁锈?
高中化学
一、 实验研究——测定常见盐溶液的酸碱性
问题2:常见盐溶液的酸碱性如何呢?
问题3: H+与OH-是如何“博弈”的呢?
CH3COONa=CH3COO-+Na+
+
H2O H++OH-
CH3COOH
二、原理分析— —构建认知模型
高中化学
高中化学
三、应用认知模型——测定0.1mol/L常见盐溶液的pH
问题4:同浓度常见盐溶液的pH有差异吗 ?
高中化学
高中化学
问题5:温度对水解有影响吗?
以氢氧化铁胶体制备和 蒸发氯化铁溶液为例
结论:水解反应是吸热反应
3.NH4Cl 溶液呈酸性的原因
NH4Cl 溶 液 中 的 电 离 ( 写 出 电 离 方 程
式):H2O H +OH , NH4Cl===Cl +N
NH 与水电离的 OH-结合生成了难电离的 NH3 ·H2O
,
水的电离平衡移动方向是电离的方向 ,溶液中有关离
子浓度的变化是 c(NH ) 减小 ,c(OH-) 减小 ,
c(H+) 增大 ,c(H+)>c(OH-),NH4Cl 溶液呈 酸性 。 化学方程式是 NH4Cl+H2O NH3 ·H2O+HCl ,
离子方程式是 NH +H2O —NH3 ·H2O+H 。
+
4
+
4
+
4
+
-
-
+
4
+
H2O — OH- + H+
1
NH3 · H2O
NH4 +与水电离的OH-结合形成弱电解质
NH3 · H2O ,使c(OH-)减小,使水的电离平 衡正向移动,c(H+)>c(OH-)
四、平衡表征——水解反应方程式书写
NH4CI-=NH+4+ ct
高中化学
认知模型
1 . 有下列五种盐溶液:①NaClO 、②(NH4)2SO4、③Na2CO3 、④AlCl3 、⑤KNO3。
回答下列问题:
(1)不能破坏水的电离平衡的是⑤ , 溶液呈酸性的是 ②④ , pH>7 的是①③ 。
(2)根据盐类水解的实质(弱离子+H2O)及水解反应的特点(可逆反应、程度微弱) ,写出下
列盐类水解的离子方程式:
①NaClO: ClO-+H2O— HClO+OH- ;
②(NH4)2SO4: NH4++H2O NH3 · H2O+H+ ;
③Na2CO3: CO32-+H2O — HCO3-+OH-、HCO3-+H2O H2CO3+OH- ;
盐类水解离子方程式的书写
④AlCl3: Al3++3H2O — A l(OH)3+3H+ 。
高中化学
五、平衡常数——水解反应的限度
问题6:一般水解反应进行的程度很大吗?
NH4++H2O NH3 · H2O + H+
初始浓度 0.1 0 10-7
平衡浓度 0.1 -10-5.5 ≈0.1 1 0-5.5 10-5.5
c(NH3 · H2O) ·c( H+)c(OH-) Kw
Kh= = = 6.25×10-10
c(NH4+) c(OH-) Kb
归纳总结
1. 盐类水解的实质
在溶液中盐电离出来的离子(弱碱的阳离子或弱酸的阴离子)结合水电离出的OH- 或H+ 生成弱电解质, 破坏了水的电离平衡,促进了水的电离,使溶液显示不同的酸性、碱性或中性。
弱碱阳离子:NH 、Al3+、Fe3+、Cu2+等。
弱酸根离子: CO -、HCO 、 AlO 、 SO -、 S2-、HS-、 ClO-、
3
2
2
-
3
-
3
2
4
+
2. 盐类水解的规律
常见的 “弱”离子
3. 盐类水解的特点
有弱才水解,无弱不水解,
谁弱谁水解,谁强显谁性,
都弱都水解,弱弱具体定。
CH3COO- 、F-等。 微弱、 吸热、
可逆。
1 . 下列关于酸性溶液的叙述中正确的是 ( A )
A .可能是盐的水溶液
B .一定是酸的水溶液
C .溶液中 c(H+)
2 . 下列说法正确的是 ( D )
A.盐溶液都是中性的
B .盐溶液的酸碱性与盐的类型无关
C .NaHCO3 溶液显酸性
D .Na2CO3 溶液显碱性,是因为溶液中 c(OH-)>c(H+)
高中化学
定义: 在水溶液中盐电离出来的离子与水所 电离的H+或OH-结合生成弱电解质的反应。
高中化学
感谢同学们收看!
高中化学
