3.3 盐类的水解习题课课件(共16张PPT)
文档属性
| 名称 | 3.3 盐类的水解习题课课件(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 160.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 13:07:46 | ||
图片预览




文档简介
(共16张PPT)
盐类的水解习题课
高中化学
学习目标
1.通过对典型例题的研究,进一步加深对盐类水解过程的理解, 初步建立水溶液中离子间相互作用与平衡的基本思路。
2.能从电离、水解、离子反应、化学平衡的角度分析溶液的酸 碱性。
3.通过分析和解决生产、生活中有关电解质溶液的实际问题,发 展 “宏观辨识与微观探析 ”的化学学科核心素养,提升系统思 维能力。
1. 针对碳酸钠溶液 , 进行如下三组实验:
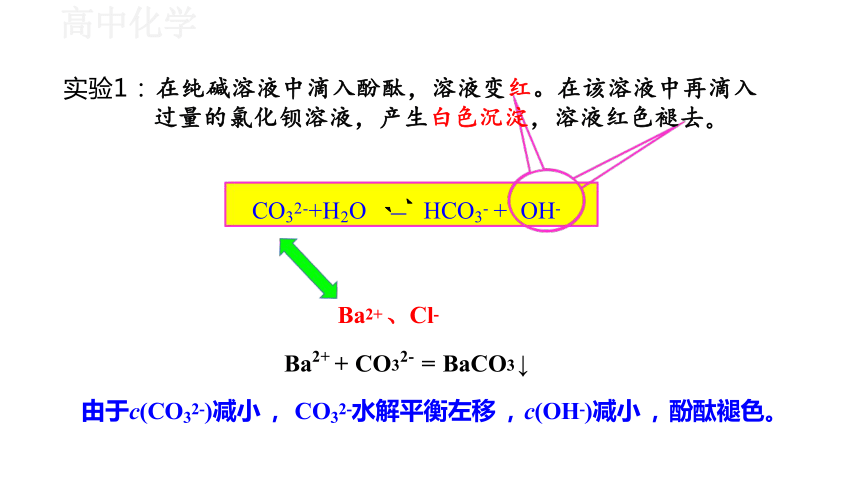
实验1: 在纯碱溶液中滴入酚酞,溶液变红。在该溶液中 再滴入过量的氯化钡溶液,产生白色沉淀,溶液红色褪去。
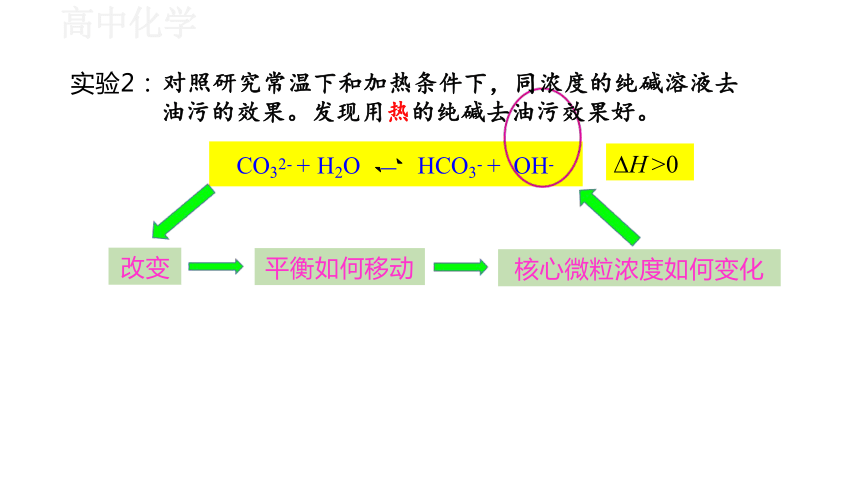
实验2: 对照研究常温下和加热条件下,同浓度的纯碱 溶液去油污的效果。发现用热的纯碱去油污效果好。
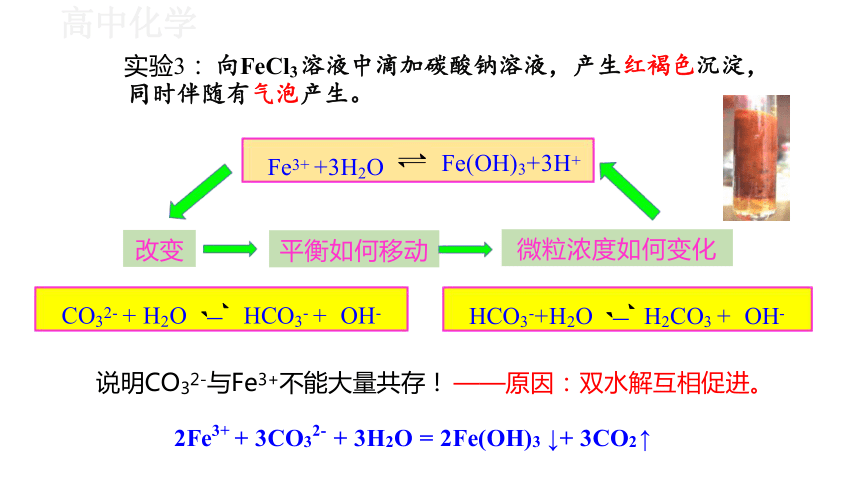
实验3: 向FeCl3 溶液中滴加碳酸钠溶液,产生红褐色沉淀, 同时伴随有气泡产生。
对以上三个实验的现象给出合理的解释(结合化学用语和简要文字说明) 。
高中化学
题组一 盐类水解原理的理解
Ba2+ 、Cl-
Ba2+ + CO32- = BaCO3 ↓
由于c(CO32-)减小 , CO32-水解平衡左移 , c(OH-)减小 , 酚酞褪色。
高中化学
实验1: 在纯碱溶液中滴入酚酞,溶液变红。在该溶液中再滴入 过量的氯化钡溶液,产生白色沉淀,溶液红色褪去。
CO32-+H2O HCO3- + OH-
实验2: 对照研究常温下和加热条件下,同浓度的纯碱溶液去
油污的效果。发现用热的纯碱去油污效果好。
核心微粒浓度如何变化
CO32- + H2O HCO3- + OH- H >0
平衡如何移动
高中化学
改变
高中化学
实验3: 向FeCl3 溶液中滴加碳酸钠溶液,产生红褐色沉淀, 同时伴随有气泡产生。
说明CO32-与Fe3+不能大量共存! ——原因: 双水解互相促进。
2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3 ↓+ 3CO2 ↑
CO32- + H2O HCO3- + OH-
HCO3-+H2O H2CO3 + OH-
微粒浓度如何变化
平衡如何移动
Fe(OH)3+3H+
改变
Fe3+ +3H2O
高中化学
题组二 盐类水解对水电离的影响
2. 常温下 , 某溶液中由水电离出来的c(H+)=1×10-5 mol/L , 该溶液中的
溶质可能是 ( )
A. HCl B. NH3 ·H2O
C. CH 3COONa D. CuSO4
H+
OH-
H+
H+
OH-
与Cu2+结 合生成了 Cu(OH)2
1×10-5 1×10-9
pH=5 CuSO4
1×10-5 1×10-9
pH=5 HCl
1×10-7 1×10-7
纯水
H+ + OH- 温度25℃ 单位:mol/L
H+
OH-
高中化学
OH-
H2O
高中化学
题组一 盐类水解对水电离的影响
2. 常温下 , 某溶液中由水电离出来的c(H+)=1×10-5mol/L , 该溶液中的溶
质可能是 ( D )
A. HCl B. NH3 ·H2O
C. CH 3COONa D. CuSO4
H2O 、 H+ + OH-
3. 室温下 , 在pH=5的某溶液中 , 由水电离的c(H+)可能为 (AD )
A. 1.0×10-5 mol ·L-1 B. 1.0×10-6 mol ·L-1
C. 1.0×10-7 mol ·L-1 D. 1.0×10-9 mol ·L-1
高中化学
高中化学
题组三 水解与电离的比较
4. 25℃ , CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,
pH为4.7 , 下列说法错误的是 ( B )
A. CH3COOH的电离作用大于CH3COONa的水解作用
B. CH3COONa的水解作用大于CH3COOH的电离作用 C. CH3COOH的存在抑制了CH3COONa的水解
D. CH3COONa的存在抑制了CH3COOH的电离
CH3COOH H+ + CH3COO-
CH3COO- +H2O OH- + CH3COOH
电离
水解
外界因素
研究对象
<
<
高中化学
CH3COOH与CH3COONa等物质的量混合配制成的稀溶液 , pH约为4.7
CH3COOH H+ + CH3COO- 电离
CH3COO- +H2O OH- + CH3COOH 水解
研究发现:
(1)在20.0 mL上述溶液中加入0.5 mL(约10滴) 0.1 mol L-1 HCl 溶液后,再测量其pH ,约为4.7。
(2)在20.0 mL上述溶液中加入0.5 mL(约10滴) 0.1 mol L-1 NaOH 溶液后,再测量其pH ,约为4.7 。
缓冲溶液是由弱酸及其盐、 弱碱及其盐组成的混合溶液 , 能在一 定程度上抵消、 减轻酸或碱对溶液酸碱度的影响 ,从而保持溶液的
pH相对稳定。
高中化学
5. 室温下 , 0.1 mol/L NaHCO3溶液的pH接近8.4 。
你能从电离和水解的角度给出合理的解释吗?
HCO3- H+ + CO32- 电离
HCO3- +H2O OH- + H2CO3 水解
H2O
H+ + OH-
抑制
促进
室温下,酸式盐溶液酸碱性的判断 在水中的行为 对水的电离影响
溶液酸碱性
NaHSO4 NaHSO4= Na+ + H+ + SO42- 抑制
pH<7
NaHCO3 NaHCO3= Na+ +HCO3- HCO3- H+ + CO32- HCO3- +H2O OH- + H2CO3 抑制 < 促进
pH>7
NaHSO3 NaHSO3= Na++HSO3- HSO3- H+ + SO32- HSO3- +H2O OH- + H2 SO3 抑制 > 促进
pH<7
高中化学
课堂小结
溶质(HA/BOH)
微粒间的相互作用 平衡移动原理
H2O H+ + OH-
HA H+ + A-
NaA = Na++A -
(后) 微粒种类及数目
(前) 微粒种类及数目
高中化学
溶剂(H2O)
溶质(盐)
感谢同学们收看!
高中化学
盐类的水解习题课
高中化学
学习目标
1.通过对典型例题的研究,进一步加深对盐类水解过程的理解, 初步建立水溶液中离子间相互作用与平衡的基本思路。
2.能从电离、水解、离子反应、化学平衡的角度分析溶液的酸 碱性。
3.通过分析和解决生产、生活中有关电解质溶液的实际问题,发 展 “宏观辨识与微观探析 ”的化学学科核心素养,提升系统思 维能力。
1. 针对碳酸钠溶液 , 进行如下三组实验:
实验1: 在纯碱溶液中滴入酚酞,溶液变红。在该溶液中 再滴入过量的氯化钡溶液,产生白色沉淀,溶液红色褪去。
实验2: 对照研究常温下和加热条件下,同浓度的纯碱 溶液去油污的效果。发现用热的纯碱去油污效果好。
实验3: 向FeCl3 溶液中滴加碳酸钠溶液,产生红褐色沉淀, 同时伴随有气泡产生。
对以上三个实验的现象给出合理的解释(结合化学用语和简要文字说明) 。
高中化学
题组一 盐类水解原理的理解
Ba2+ 、Cl-
Ba2+ + CO32- = BaCO3 ↓
由于c(CO32-)减小 , CO32-水解平衡左移 , c(OH-)减小 , 酚酞褪色。
高中化学
实验1: 在纯碱溶液中滴入酚酞,溶液变红。在该溶液中再滴入 过量的氯化钡溶液,产生白色沉淀,溶液红色褪去。
CO32-+H2O HCO3- + OH-
实验2: 对照研究常温下和加热条件下,同浓度的纯碱溶液去
油污的效果。发现用热的纯碱去油污效果好。
核心微粒浓度如何变化
CO32- + H2O HCO3- + OH- H >0
平衡如何移动
高中化学
改变
高中化学
实验3: 向FeCl3 溶液中滴加碳酸钠溶液,产生红褐色沉淀, 同时伴随有气泡产生。
说明CO32-与Fe3+不能大量共存! ——原因: 双水解互相促进。
2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3 ↓+ 3CO2 ↑
CO32- + H2O HCO3- + OH-
HCO3-+H2O H2CO3 + OH-
微粒浓度如何变化
平衡如何移动
Fe(OH)3+3H+
改变
Fe3+ +3H2O
高中化学
题组二 盐类水解对水电离的影响
2. 常温下 , 某溶液中由水电离出来的c(H+)=1×10-5 mol/L , 该溶液中的
溶质可能是 ( )
A. HCl B. NH3 ·H2O
C. CH 3COONa D. CuSO4
H+
OH-
H+
H+
OH-
与Cu2+结 合生成了 Cu(OH)2
1×10-5 1×10-9
pH=5 CuSO4
1×10-5 1×10-9
pH=5 HCl
1×10-7 1×10-7
纯水
H+ + OH- 温度25℃ 单位:mol/L
H+
OH-
高中化学
OH-
H2O
高中化学
题组一 盐类水解对水电离的影响
2. 常温下 , 某溶液中由水电离出来的c(H+)=1×10-5mol/L , 该溶液中的溶
质可能是 ( D )
A. HCl B. NH3 ·H2O
C. CH 3COONa D. CuSO4
H2O 、 H+ + OH-
3. 室温下 , 在pH=5的某溶液中 , 由水电离的c(H+)可能为 (AD )
A. 1.0×10-5 mol ·L-1 B. 1.0×10-6 mol ·L-1
C. 1.0×10-7 mol ·L-1 D. 1.0×10-9 mol ·L-1
高中化学
高中化学
题组三 水解与电离的比较
4. 25℃ , CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,
pH为4.7 , 下列说法错误的是 ( B )
A. CH3COOH的电离作用大于CH3COONa的水解作用
B. CH3COONa的水解作用大于CH3COOH的电离作用 C. CH3COOH的存在抑制了CH3COONa的水解
D. CH3COONa的存在抑制了CH3COOH的电离
CH3COOH H+ + CH3COO-
CH3COO- +H2O OH- + CH3COOH
电离
水解
外界因素
研究对象
<
<
高中化学
CH3COOH与CH3COONa等物质的量混合配制成的稀溶液 , pH约为4.7
CH3COOH H+ + CH3COO- 电离
CH3COO- +H2O OH- + CH3COOH 水解
研究发现:
(1)在20.0 mL上述溶液中加入0.5 mL(约10滴) 0.1 mol L-1 HCl 溶液后,再测量其pH ,约为4.7。
(2)在20.0 mL上述溶液中加入0.5 mL(约10滴) 0.1 mol L-1 NaOH 溶液后,再测量其pH ,约为4.7 。
缓冲溶液是由弱酸及其盐、 弱碱及其盐组成的混合溶液 , 能在一 定程度上抵消、 减轻酸或碱对溶液酸碱度的影响 ,从而保持溶液的
pH相对稳定。
高中化学
5. 室温下 , 0.1 mol/L NaHCO3溶液的pH接近8.4 。
你能从电离和水解的角度给出合理的解释吗?
HCO3- H+ + CO32- 电离
HCO3- +H2O OH- + H2CO3 水解
H2O
H+ + OH-
抑制
促进
室温下,酸式盐溶液酸碱性的判断 在水中的行为 对水的电离影响
溶液酸碱性
NaHSO4 NaHSO4= Na+ + H+ + SO42- 抑制
pH<7
NaHCO3 NaHCO3= Na+ +HCO3- HCO3- H+ + CO32- HCO3- +H2O OH- + H2CO3 抑制 < 促进
pH>7
NaHSO3 NaHSO3= Na++HSO3- HSO3- H+ + SO32- HSO3- +H2O OH- + H2 SO3 抑制 > 促进
pH<7
高中化学
课堂小结
溶质(HA/BOH)
微粒间的相互作用 平衡移动原理
H2O H+ + OH-
HA H+ + A-
NaA = Na++A -
(后) 微粒种类及数目
(前) 微粒种类及数目
高中化学
溶剂(H2O)
溶质(盐)
感谢同学们收看!
高中化学
