4.1 原电池 课件(共15张PPT)
文档属性
| 名称 | 4.1 原电池 课件(共15张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 633.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 13:09:01 | ||
图片预览



文档简介
(共15张PPT)
第1节 原电池
高中化学
高中化学
学习目标与任务
1.通过铜锌原电池的模型认知活动, 能够正确认识原电池
的工作原理, 能够正确书写电极反应式, 综合提升化学 用语的规范表达能力;
2.通过原电池中盐桥原理的分析, 形成宏观现象和微观原
理相结合的认知角度;
3.通过了解生产生活中原电池原理的应用, 能够理解化学
学科的有用性, 提升社会责任感。
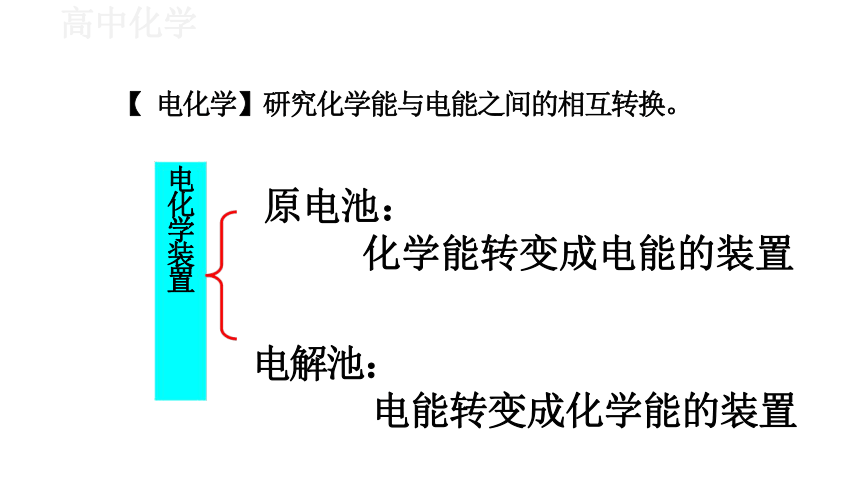
原电池:
化学能转变成电能的装置
电解池:
电能转变成化学能的装置
高中化学
【 电化学】研究化学能与电能之间的相互转换。
电化学装置
高中化学
知识回顾
一、原电池原理
1.定义: 将化学能转变为电能的装置。
2.反应本质: 氧化还原反应
3.原电池正负电极的判断方法
电子流出, 发生失电子的氧化反应
电子流入, 发生得电子的还原反应
负极:
正极:
一、原电池原理
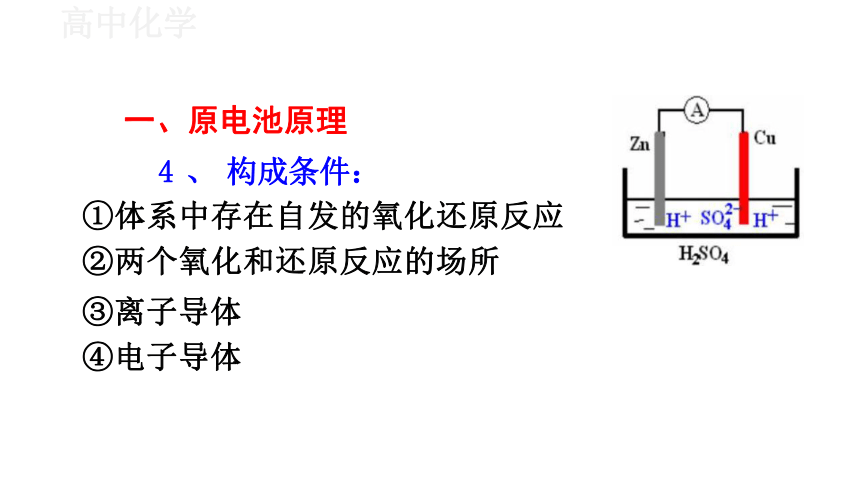
4 、 构成条件:
①体系中存在自发的氧化还原反应
②两个氧化和还原反应的场所
③离子导体
④电子导体
高中化学
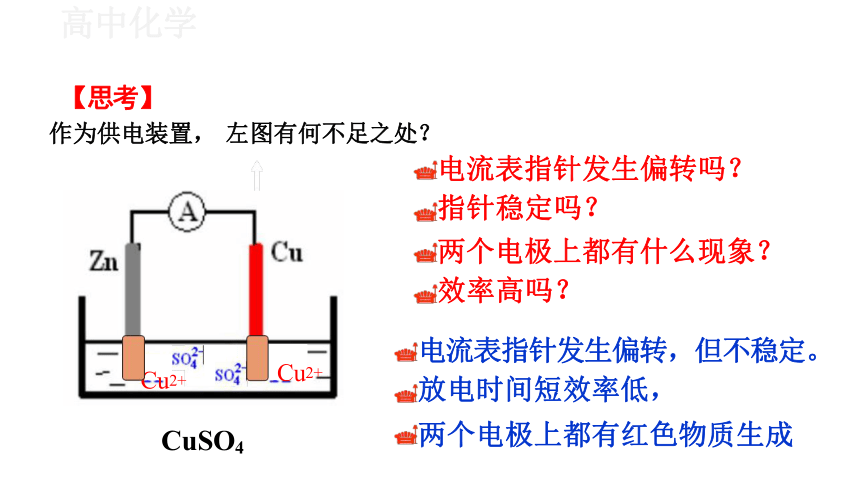
电流表指针发生偏转吗?
指针稳定吗?
两个电极上都有什么现象?
效率高吗?
电流表指针发生偏转,但不稳定。
放电时间短效率低,
两个电极上都有红色物质生成
高中化学
【思考】
作为供电装置, 左图有何不足之处?
CuSO4
Cu2+
Cu2+
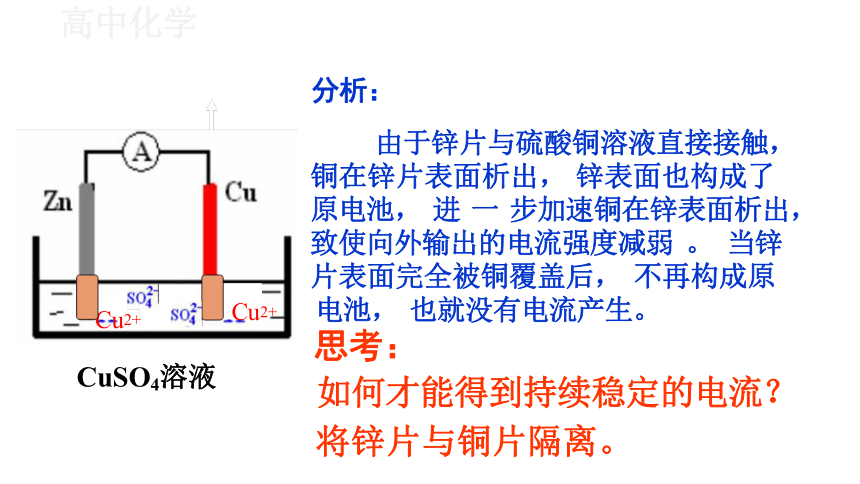
分析:
由于锌片与硫酸铜溶液直接接触, 铜在锌片表面析出, 锌表面也构成了 原电池, 进 一 步加速铜在锌表面析出, 致使向外输出的电流强度减弱 。 当锌 片表面完全被铜覆盖后, 不再构成原
电池, 也就没有电流产生。
思考:
如何才能得到持续稳定的电流?
将锌片与铜片隔离。
高中化学
CuSO4溶液
Cu2+
Cu2+
上述装置构成原电池了吗? 为什么? 怎样才能构成原电池呢?
高中化学
硫酸铜溶液
硫酸锌溶液
硫酸铜溶液
高中化学
设计如下图(P71图4-1)所示的原电池装置,
此装置优点: 能稳 定长时间放电
你能解释它的工作原理吗?
盐桥中通常装有含琼胶的KCl饱和溶液
高中化学
二、盐桥的作用
盐桥: 饱和 KCl溶液(以琼胶制作成冻胶)
①分开氧化和还原两个半反应
②离子导体
高中化学
三、原电池的设计:
Zn(s) + CuSO4 (aq) = ZnSO4(aq) + Cu(s)
Zn - 2e- = Zn2+ Cu2+ +2e- = Cu
电源负极(Zn)
→ 电源正极( ) —→
( Cu\C\Ag)
组成原电池
形成闭合
回路
分析半反应
确定电极材料 —→
CuSO4
高中化学
Zn(s) + Cu SO4 (aq) = ZnSO4 (aq) + Cu(s)
高中化学
请根据氧化还原反应 Cu + 2Fe3+ = Cu2+ + 2Fe2+
设计成原电池。你有哪些可行方案
负极: Cu Cu – 2e- = Cu2+
正极: 比Cu不活泼的金属或石墨
2Fe3+ + 2e- = 2Fe2+
电解质溶液: Fe2(SO4 )3 、FeCl3 等
若是采用烧杯和盐桥装置图, 采用的电解质溶液又是什么?
试画出原电池的装置简图。
高中化学
四 、 原电池的主要应用:
1. 利用原电池原理设计新型化学电池;
2. 改变化学反应速率, 如实验室用粗锌与硫酸
反应制取氢气;
3.进行金属活动性强弱比较;
4. 电化学保护法, 即将金属作为原电池的正极
而受到保护 。 如在铁器表面镀锌。
5.解释某些化学现象
谢谢同学们的收看! 祝同学们学业进步!
高中化学
第1节 原电池
高中化学
高中化学
学习目标与任务
1.通过铜锌原电池的模型认知活动, 能够正确认识原电池
的工作原理, 能够正确书写电极反应式, 综合提升化学 用语的规范表达能力;
2.通过原电池中盐桥原理的分析, 形成宏观现象和微观原
理相结合的认知角度;
3.通过了解生产生活中原电池原理的应用, 能够理解化学
学科的有用性, 提升社会责任感。
原电池:
化学能转变成电能的装置
电解池:
电能转变成化学能的装置
高中化学
【 电化学】研究化学能与电能之间的相互转换。
电化学装置
高中化学
知识回顾
一、原电池原理
1.定义: 将化学能转变为电能的装置。
2.反应本质: 氧化还原反应
3.原电池正负电极的判断方法
电子流出, 发生失电子的氧化反应
电子流入, 发生得电子的还原反应
负极:
正极:
一、原电池原理
4 、 构成条件:
①体系中存在自发的氧化还原反应
②两个氧化和还原反应的场所
③离子导体
④电子导体
高中化学
电流表指针发生偏转吗?
指针稳定吗?
两个电极上都有什么现象?
效率高吗?
电流表指针发生偏转,但不稳定。
放电时间短效率低,
两个电极上都有红色物质生成
高中化学
【思考】
作为供电装置, 左图有何不足之处?
CuSO4
Cu2+
Cu2+
分析:
由于锌片与硫酸铜溶液直接接触, 铜在锌片表面析出, 锌表面也构成了 原电池, 进 一 步加速铜在锌表面析出, 致使向外输出的电流强度减弱 。 当锌 片表面完全被铜覆盖后, 不再构成原
电池, 也就没有电流产生。
思考:
如何才能得到持续稳定的电流?
将锌片与铜片隔离。
高中化学
CuSO4溶液
Cu2+
Cu2+
上述装置构成原电池了吗? 为什么? 怎样才能构成原电池呢?
高中化学
硫酸铜溶液
硫酸锌溶液
硫酸铜溶液
高中化学
设计如下图(P71图4-1)所示的原电池装置,
此装置优点: 能稳 定长时间放电
你能解释它的工作原理吗?
盐桥中通常装有含琼胶的KCl饱和溶液
高中化学
二、盐桥的作用
盐桥: 饱和 KCl溶液(以琼胶制作成冻胶)
①分开氧化和还原两个半反应
②离子导体
高中化学
三、原电池的设计:
Zn(s) + CuSO4 (aq) = ZnSO4(aq) + Cu(s)
Zn - 2e- = Zn2+ Cu2+ +2e- = Cu
电源负极(Zn)
→ 电源正极( ) —→
( Cu\C\Ag)
组成原电池
形成闭合
回路
分析半反应
确定电极材料 —→
CuSO4
高中化学
Zn(s) + Cu SO4 (aq) = ZnSO4 (aq) + Cu(s)
高中化学
请根据氧化还原反应 Cu + 2Fe3+ = Cu2+ + 2Fe2+
设计成原电池。你有哪些可行方案
负极: Cu Cu – 2e- = Cu2+
正极: 比Cu不活泼的金属或石墨
2Fe3+ + 2e- = 2Fe2+
电解质溶液: Fe2(SO4 )3 、FeCl3 等
若是采用烧杯和盐桥装置图, 采用的电解质溶液又是什么?
试画出原电池的装置简图。
高中化学
四 、 原电池的主要应用:
1. 利用原电池原理设计新型化学电池;
2. 改变化学反应速率, 如实验室用粗锌与硫酸
反应制取氢气;
3.进行金属活动性强弱比较;
4. 电化学保护法, 即将金属作为原电池的正极
而受到保护 。 如在铁器表面镀锌。
5.解释某些化学现象
谢谢同学们的收看! 祝同学们学业进步!
高中化学
