3.1 弱电解质的电离 课件(共20张PPT)
文档属性
| 名称 | 3.1 弱电解质的电离 课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 561.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 13:10:01 | ||
图片预览







文档简介
(共20张PPT)
弱电解质的电离
高中化学
学习目标
(1 ) 通过实验和数据分析, 建立强弱电解质的概
念, 理解弱电解质在水溶液中的电离平衡;
(2 ) 应用化学平衡模型, 分析影响电离平衡的因
素 , 建立微粒观和变化观, 并能解决实际问题;
(3 ) 了解电离平衡常数的含义和应用。
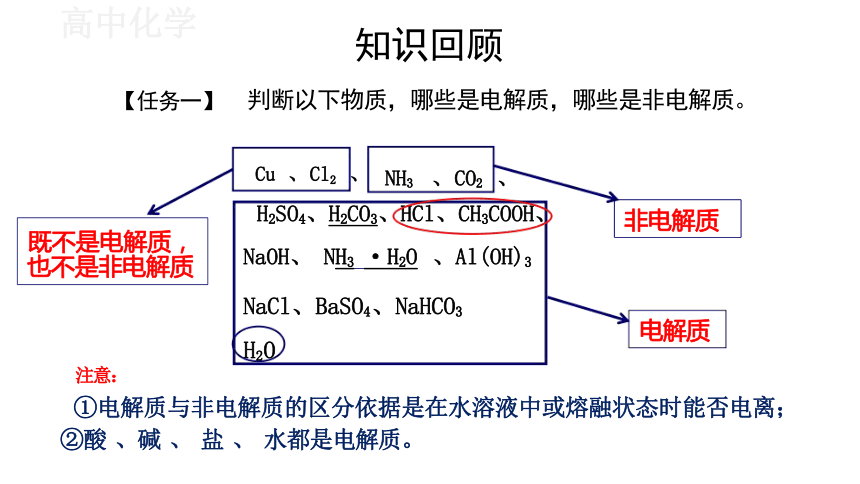
NH3 、CO2 、
电解质
知识回顾
判断以下物质,哪些是电解质,哪些是非电解质。
①电解质与非电解质的区分依据是在水溶液中或熔融状态时能否电离;
②酸 、碱 、 盐 、 水都是电解质。
H2SO4、H2CO3、HCl、CH3COOH、
NaOH、 NH3 ·H2O 、Al(OH)3
高中化学
【任务一】
NaCl、BaSO4、NaHCO3
H2O
Cu 、Cl2 、
既不是电解质, 也不是非电解质
非电解质
注意:
高中化学 实验探究
【任务二】设计实验探究HCl和CH3COOH在水溶液中的电离能力
结论:HCl在稀溶液中全部电离 ,CH3COOH在水溶液中只有部分电离。
产生气泡较快
pH =1
产生气泡较慢
pH≈3
强电解质
弱电解质
NaCl 、BaSO4 、NaHCO3
CH3COOH 、H2CO3 、HF 、HClO 、H2S
NH3 ·H2O 、Fe(OH)2 、 Fe(OH)3 、 H2O
强弱电解质的区分依据: 在水溶液中是否完全电离;
H2SO4 、HCl 、 HNO3
NaOH 、 Ba(OH)2 、 KOH 强电解质
高中化学
一 、 强弱电解质
强弱电解质与溶解度大小无关。
弱电解质
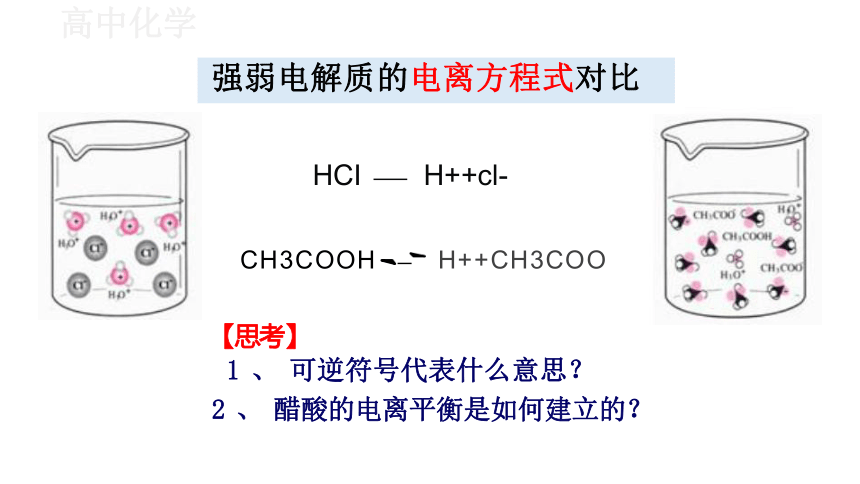
CH3COOH H++CH3COO
【思考】
1 、 可逆符号代表什么意思?
2 、 醋酸的电离平衡是如何建立的?
强弱电解质的电离方程式对比
HCI H++cl-
高中化学
高中化学
电离
CH3COOH CH3COO - + H+
弱电解质电离平衡状态建立示意图
υ(电离)= υ(结合)
υ(电离)
υ(结合)
速率
时间
结合
高中化学
二 、 弱电解质的电离平衡
1 、 定义:
一 定条件下 的 弱电解质的溶液中,
当弱电解质分子电离成离子的速率和
离子重新结合成分子的速率相等时 , 溶液中各分子 、 离子的浓度 保持不变
实质
的状态 。 标志
前提
高中化学
2
等--- υ正 =υ逆
动--- 动态平衡 υ≠0
定--- 平衡体系中各分子 、 离子的浓度 一 定
变--- 条件改变时, 平衡将发生移动
弱电解质在 一 定温度下达到电离平衡时, 所电离出 的各种离子的浓度的幂的积与溶液中未电离的分子的浓 度之比为 一 常数。
CH3COO-+H+
Ka= c( O )
-
H)
O
COO
CH3C
H
·c
高中化学
3 、 电离平衡常数
CH3COOH
⑴定义
NH3 ·H2O NH4++OH-
Kb= c ·· )
—
)
H
O
O
H2
c(
NH
H4+
c(
(N
CH3COOH CH3COO - + H+
Ka= c( O )
—
H)
O
COO
CH3C
H
·c
高中化学
3 、 电离平衡常数
⑵表达式
高中化学
⑶电离平衡常数的意义
①电离常数的大小与温度有关;
②电离常数的大小能说明电离程度的大小;
例:25 ℃时, 氢氰酸(HCN) 、 醋酸 、 氢氟酸的电离常数分别为
Ka(HCN)=6.2×10- 10mol/L
Ka(CH3COOH)=1.7×10-5mol/L
Ka(HF)=6.8×10-4mol/L
酸性:HF>CH3COOH>HCN
c(H+) ·c(CH3COO-)
c(CH3COOH)
=
高中化学
酸性强弱的实验验证
酸性: CH3COOH> H2CO3 > H3BO3
25 ℃时,
H3PO4 、 H++H2PO4-
H2PO4- H+ + HPO42- HPO42- H+ + PO43-
Ka1=7. 1×10-3
Ka2=6.2×10-8 Ka3=4.5×10-13
③多元弱酸分步电离,且各级电离平衡常数相差很大。
⑶电离平衡常数的意义
高中化学
高中化学
高中化学
二 、 弱电解质的电离平衡
4 、 影响电离平衡的因素
CH3COOH CH3COO - + H+ H>0
温度、
压强、 浓度
醋酸电离程度 n(H+) c(H+)
c(H+) c(CH3COOH)
微热 增大 增大 增大
增大
高中化学
4 、 影响电离平衡的因素
① 温度
0.1 mol/L醋酸溶液
CH3COOH CH3COO - + H+ H>0
不考虑溶质和溶剂的挥发
n(电离)
n(总)
α(醋酸)=
醋酸电离程度 n(H+) c(H+)
c(H+) c(CH3COOH)
加水 增大 增大 减小
增大
加少量冰醋酸 减小 增大 增大
减小
高中化学
4 、 影响电离平衡的因素
= n(C OH)
H3CO
n(H+)
CH3COOH CH3COO - + H+ H>0
=
)
)
aq
H+
V(
n(
= c(C COO-)
H3
Ka
0.1 mol/L醋酸溶液
②浓度
醋酸电离程度 n(H+) c(H+)
c(H+) c(CH3COOH)
加几滴浓 NaOH溶液 增大 减小 减小
减小
加少量固体 CH3COONa 减小 减小 减小
减小
通入少量 HCl(g) 减小 增大 增大
增大
③引入离子:
0.1 mol/L醋酸溶液
CH3COOH CH3COO - + H+ H>0
高中化学
4 、 影响电离平衡的因素
= n(C OH)
H3CO
n(H+)
= c(CH OO-)
3C
Ka
谢谢同学们的收看!
祝同学们学业进步!
高中化学
弱电解质的电离
高中化学
学习目标
(1 ) 通过实验和数据分析, 建立强弱电解质的概
念, 理解弱电解质在水溶液中的电离平衡;
(2 ) 应用化学平衡模型, 分析影响电离平衡的因
素 , 建立微粒观和变化观, 并能解决实际问题;
(3 ) 了解电离平衡常数的含义和应用。
NH3 、CO2 、
电解质
知识回顾
判断以下物质,哪些是电解质,哪些是非电解质。
①电解质与非电解质的区分依据是在水溶液中或熔融状态时能否电离;
②酸 、碱 、 盐 、 水都是电解质。
H2SO4、H2CO3、HCl、CH3COOH、
NaOH、 NH3 ·H2O 、Al(OH)3
高中化学
【任务一】
NaCl、BaSO4、NaHCO3
H2O
Cu 、Cl2 、
既不是电解质, 也不是非电解质
非电解质
注意:
高中化学 实验探究
【任务二】设计实验探究HCl和CH3COOH在水溶液中的电离能力
结论:HCl在稀溶液中全部电离 ,CH3COOH在水溶液中只有部分电离。
产生气泡较快
pH =1
产生气泡较慢
pH≈3
强电解质
弱电解质
NaCl 、BaSO4 、NaHCO3
CH3COOH 、H2CO3 、HF 、HClO 、H2S
NH3 ·H2O 、Fe(OH)2 、 Fe(OH)3 、 H2O
强弱电解质的区分依据: 在水溶液中是否完全电离;
H2SO4 、HCl 、 HNO3
NaOH 、 Ba(OH)2 、 KOH 强电解质
高中化学
一 、 强弱电解质
强弱电解质与溶解度大小无关。
弱电解质
CH3COOH H++CH3COO
【思考】
1 、 可逆符号代表什么意思?
2 、 醋酸的电离平衡是如何建立的?
强弱电解质的电离方程式对比
HCI H++cl-
高中化学
高中化学
电离
CH3COOH CH3COO - + H+
弱电解质电离平衡状态建立示意图
υ(电离)= υ(结合)
υ(电离)
υ(结合)
速率
时间
结合
高中化学
二 、 弱电解质的电离平衡
1 、 定义:
一 定条件下 的 弱电解质的溶液中,
当弱电解质分子电离成离子的速率和
离子重新结合成分子的速率相等时 , 溶液中各分子 、 离子的浓度 保持不变
实质
的状态 。 标志
前提
高中化学
2
等--- υ正 =υ逆
动--- 动态平衡 υ≠0
定--- 平衡体系中各分子 、 离子的浓度 一 定
变--- 条件改变时, 平衡将发生移动
弱电解质在 一 定温度下达到电离平衡时, 所电离出 的各种离子的浓度的幂的积与溶液中未电离的分子的浓 度之比为 一 常数。
CH3COO-+H+
Ka= c( O )
-
H)
O
COO
CH3C
H
·c
高中化学
3 、 电离平衡常数
CH3COOH
⑴定义
NH3 ·H2O NH4++OH-
Kb= c ·· )
—
)
H
O
O
H2
c(
NH
H4+
c(
(N
CH3COOH CH3COO - + H+
Ka= c( O )
—
H)
O
COO
CH3C
H
·c
高中化学
3 、 电离平衡常数
⑵表达式
高中化学
⑶电离平衡常数的意义
①电离常数的大小与温度有关;
②电离常数的大小能说明电离程度的大小;
例:25 ℃时, 氢氰酸(HCN) 、 醋酸 、 氢氟酸的电离常数分别为
Ka(HCN)=6.2×10- 10mol/L
Ka(CH3COOH)=1.7×10-5mol/L
Ka(HF)=6.8×10-4mol/L
酸性:HF>CH3COOH>HCN
c(H+) ·c(CH3COO-)
c(CH3COOH)
=
高中化学
酸性强弱的实验验证
酸性: CH3COOH> H2CO3 > H3BO3
25 ℃时,
H3PO4 、 H++H2PO4-
H2PO4- H+ + HPO42- HPO42- H+ + PO43-
Ka1=7. 1×10-3
Ka2=6.2×10-8 Ka3=4.5×10-13
③多元弱酸分步电离,且各级电离平衡常数相差很大。
⑶电离平衡常数的意义
高中化学
高中化学
高中化学
二 、 弱电解质的电离平衡
4 、 影响电离平衡的因素
CH3COOH CH3COO - + H+ H>0
温度、
压强、 浓度
醋酸电离程度 n(H+) c(H+)
c(H+) c(CH3COOH)
微热 增大 增大 增大
增大
高中化学
4 、 影响电离平衡的因素
① 温度
0.1 mol/L醋酸溶液
CH3COOH CH3COO - + H+ H>0
不考虑溶质和溶剂的挥发
n(电离)
n(总)
α(醋酸)=
醋酸电离程度 n(H+) c(H+)
c(H+) c(CH3COOH)
加水 增大 增大 减小
增大
加少量冰醋酸 减小 增大 增大
减小
高中化学
4 、 影响电离平衡的因素
= n(C OH)
H3CO
n(H+)
CH3COOH CH3COO - + H+ H>0
=
)
)
aq
H+
V(
n(
= c(C COO-)
H3
Ka
0.1 mol/L醋酸溶液
②浓度
醋酸电离程度 n(H+) c(H+)
c(H+) c(CH3COOH)
加几滴浓 NaOH溶液 增大 减小 减小
减小
加少量固体 CH3COONa 减小 减小 减小
减小
通入少量 HCl(g) 减小 增大 增大
增大
③引入离子:
0.1 mol/L醋酸溶液
CH3COOH CH3COO - + H+ H>0
高中化学
4 、 影响电离平衡的因素
= n(C OH)
H3CO
n(H+)
= c(CH OO-)
3C
Ka
谢谢同学们的收看!
祝同学们学业进步!
高中化学
