水溶液中的离子平衡习题课课件(共17张PPT)
文档属性
| 名称 | 水溶液中的离子平衡习题课课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 10:16:25 | ||
图片预览



文档简介
(共17张PPT)
水溶液中的离子平衡习题课
高中化学
学习目标
1. 通过典型例题学习, 能从电离 、 水解 、 离子反应 、 化学平衡 的角度分析溶液中微粒变化及其宏观现象, 进 一 步加深对水 溶液中平衡的理解, 系统构建水溶液中离子间相互作用与平 衡的基本思路。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决生产 、 生 活中有关电解质溶液的实际问题, 形成微粒观 、 平衡观和守 恒观。
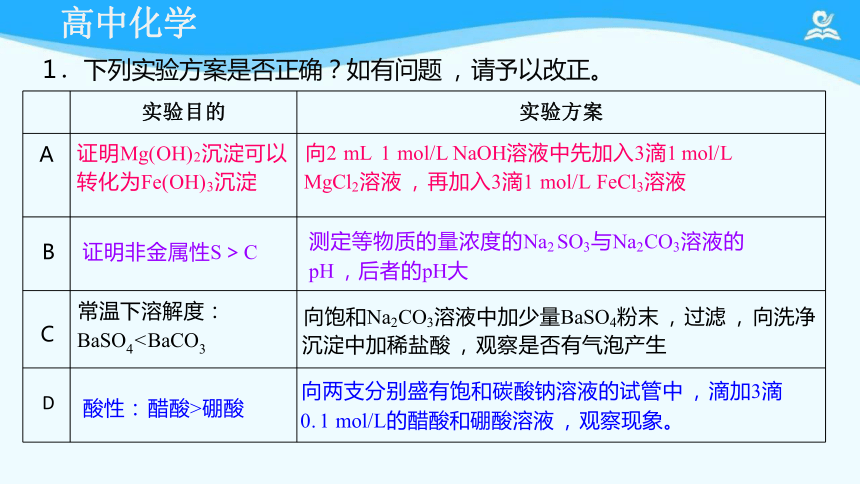
实验目的
实验方案
A 证明Mg(OH)2沉淀可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
B 证明非金属性S>C
测定等物质的量浓度的Na2 SO3与Na2CO3溶液的
pH ,后者的pH大
C 常温下溶解度: BaSO4向饱和Na2CO3溶液中加少量BaSO4粉末 , 过滤 , 向洗净
沉淀中加稀盐酸 , 观察是否有气泡产生
D 酸性: 醋酸>硼酸
向两支分别盛有饱和碳酸钠溶液的试管中 , 滴加3滴
0. 1 mol/L的醋酸和硼酸溶液 , 观察现象。
高中化学
1 .下列实验方案是否正确?如有问题 , 请予以改正。
高中化学
实验目的
实验方案
A 证明Mg(OH)2沉淀可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
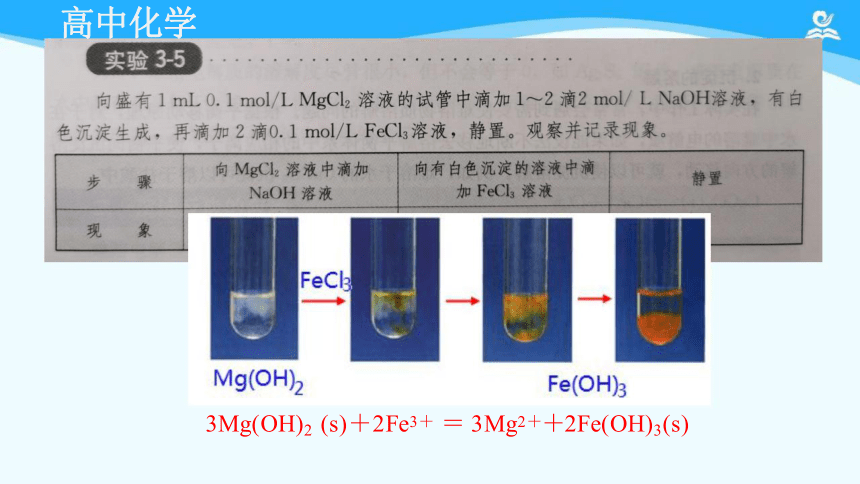
沉淀转化实验:
一定要注意试剂的添加顺序
3Mg(OH)2 (s)+2Fe3+ = 3Mg2++2Fe(OH)3(s)
高中化学
实验目的
实验方案
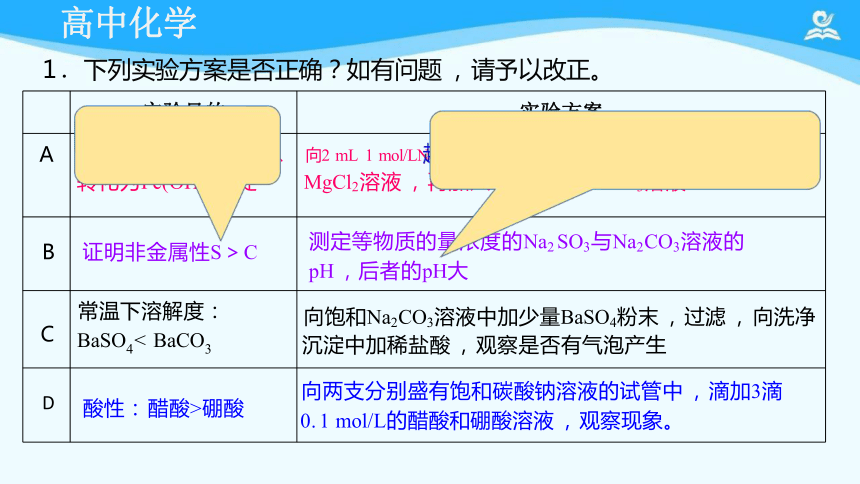
A 证明最M H含)2 可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/LN O弱H ,先 :3 CmOo3l/<LH2 SO3
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
B 证明非金属性S>C
测定等物质的量浓度的Na2 SO3与Na2CO3溶液的
pH ,后者的pH大
C 常温下溶解度: BaSO4< BaCO3
向饱和Na2CO3溶液中加少量BaSO4粉末 , 过滤 , 向洗净
沉淀中加稀盐酸 , 观察是否有气泡产生
D 酸性: 醋酸>硼酸
向两支分别盛有饱和碳酸钠溶液的试管中 , 滴加3滴
0. 1 mol/L的醋酸和硼酸溶液 , 观察现象。
高中化学
1 .下列实验方案是否正确?如有问题 , 请予以改正。
高中化学
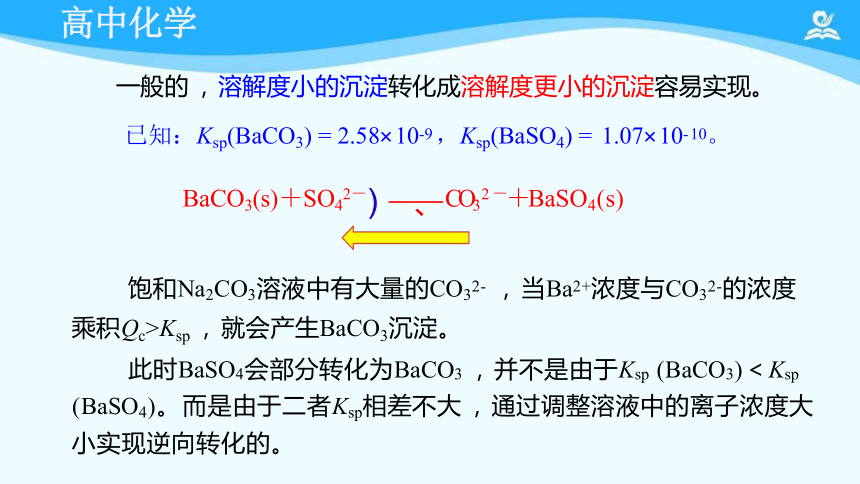
一般的 , 溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
已知:Ksp(BaCO3) = 2.58× 10-9 ,Ksp(BaSO4) = 1.07× 10- 10。
BaCO3(s)+SO42-) 、 CO32 -+BaSO4(s)
饱和Na2CO3溶液中有大量的CO32- , 当Ba2+浓度与CO32-的浓度
乘积Qc>Ksp , 就会产生BaCO3沉淀。
此时BaSO4会部分转化为BaCO3 , 并不是由于Ksp (BaCO3)<Ksp
(BaSO4)。 而是由于二者Ksp相差不大 , 通过调整溶液中的离子浓度大 小实现逆向转化的。
高中化学
已知:Ksp(BaCO3) = 2.58× 10-9 ,Ksp(BaSO4) = 1.07× 10- 10。
BaSO4(s) +CO32 - BaCO3(s)+SO42 - K =
BaSO4(s) Ba2++SO42 -
Ba2++CO32 - BaCO3(s)
= =
)
)
3
4
BaCO
BaSO
(
(
sp
sp
K
K
)
)
O32-
O42-
C
S
(
(
c
c
CO32-在溶液中的最大浓度约为2 mol/L , 故在溶液中c(SO42- )≤0.08 mol/L
时 ,都能转化。 但随着反应的进行 ,硫酸根离子很快就达到了这个浓度 , 转化就 达到了平衡。 所以溶解度相差的倍数越大 , 逆向转化越难。
K1= Ksp(BaSO4)
K2=
≈
K =
高中化学
BaCO3(s)+SO42 - 、 、 CO32-+BaSO4(s)
在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为:
将适量饱和Na2CO3溶液加入BaSO4沉淀中 , 充分搅拌 , 静置、 弃
去上层清液 , 如此操作 ,反复多次(直到BaSO4全部转化为BaCO3 )。
实验目的
实验方案
A 证明Mg(OH)2沉淀可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
B 证明非金属性S>C
测定等物质的量浓度的Na2 SO3与Na2CO3溶液的
C 常温下溶解度: BaSO4向饱和Na2CO3溶液中加少量BaSO4粉末 , 过滤 , 向洗净
沉淀中加稀盐酸 , 观察是否有气泡产生
D 酸性: 醋酸>硼酸
向两支分别盛有饱和碳酸钠溶液的试管中 , 滴加3滴
0. 1 mol/L 的醋酸和硼酸溶液 , 观察现象。
高中化学
1 .下列实验方案是否正确?如有问题 , 请予以改正。
pH ,后者的pH大 大量的 CO32- ,少量的 H+。
高中化学
高中化学
2. 某消毒液的主要成分为NaClO , 还含有一定量的NaOH , 下列用来解
释事实的方程式中不合理的是(饱和NaClO溶液的pH约为11) ( )
Cl2 +2OH- = Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:
ClO-+ H2O HClO+ OH -
C. 该消毒液与洁厕灵混用 , 产生Cl2:
2H++ Cl-+ ClO- = Cl2 ↑+ H2O
矛盾!
盐酸与醋酸比较
① 醋酸是弱酸 , 白醋浓度很低。
② 盐酸既引入了H+ , 增强了溶液 的酸性、 ClO-的氧化性; 又引入 了Cl- , 增强了Cl-的还原性。
D. 该消毒液加白醋生成HClO , 可增强漂白作用:
CH COOH+ ClO- = HClO+ CH COO—
A. 该消毒液可用NaOH溶液吸收Cl2制备:
3 3
高中化学
3 .废水中氨态氮以NH3 ·H2O、NH3和NH4+的形式存在 , 废水脱氮已成为主要污染
物减排和水体富营养化防治的研究热点。
Ⅰ . 沉淀法
向废水中投入MgCl2和Na2HPO4 , 生成MgNH4PO4 · 6H2O沉淀 , 可将氨态氮
NH3 ·H2O +Mg2+ + HPO42 -
NH4+ 和OH-
(2)废水中的NH3 ·H2O转化为MgNH4PO4 · 6H2O的离子方程式是 。
含量降至10 mg ·L 1以下。
( 1)NH3的电子式: 。
MgNH4PO4 · 6H2O↓
H N H
H
+5H2O
高中化学
(3) 16 ℃时 , 向废水中加入MgCl2和Na2HPO4 , 使镁、 氮、磷物质的量之比为 1 ︰ 1 ︰ 1 , 沉淀过程中的pH对剩余氨态氮浓度的影响如图。 欲使剩余氨态氮 浓度低于10 mg ·L 1 ,pH的适宜范围是 ;
pH偏大或者偏小均不利于MgNH4PO4 · 6H2O的生成 ,原因是 。
NH3 ·H2O +Mg2+ + HPO42-+5H2O MgNH4PO4 · 6H2O↓
pH偏大 , Mg2+易与OH 结合生成Mg(OH)2,
NH3 H2O的电离被抑制 , 使NH4+和Mg2+浓度降低。
pH偏小 ,不利于HPO42 电离 , PO43 浓度偏低。
pH =8~ 10
高中化学
3 .废水中氨态氮以NH3 ·H2O、NH3和NH4+的形式存在 , 废水脱氮已成为主要污染
物减排和水体富营养化防治的研究热点。
Ⅱ . 微波 氧化法
(4)仅对废水进行微波加热 ,pH对氨态氮脱出的影响如下表。
表中数据表明:pH增大有利于废水中化学平衡 (用化学用语表示)的移动。
溶液pH 6~7 8~9 10~11
11~12
剩余氨态氮浓度(mg ·L-1) 156 100 40
14
NH4+ + OH NH3 H2O
NH3 + H2O
高中化学
Ⅱ . 微波 氧化法
(5)微波协同CuO和H2O2 除去氨态氮
①其他条件相同 , 取相同体积的同一废水样品 , 微波10 min ,剩余氨态氮浓度
与一定浓度H2O2溶液添加量的关系如下图。 据图推测CuO在氨态氮脱除中可 能起催化作用 ,理由是 。
②微波协同CuO有利于H2O2 除去氨态氮。 该条件下 , H2O2将NH3氧化为N2的化
相同的H2O2溶液添加量 , 相同时间内, 与不加CuO相比 ,加入CuO , 氨态氮 浓度降低的多 ,反应速率快。
3H2O2+ 2NH3 N2+6H2O
学方程式是 。
感谢同学们收看!
高中化学
水溶液中的离子平衡习题课
高中化学
学习目标
1. 通过典型例题学习, 能从电离 、 水解 、 离子反应 、 化学平衡 的角度分析溶液中微粒变化及其宏观现象, 进 一 步加深对水 溶液中平衡的理解, 系统构建水溶液中离子间相互作用与平 衡的基本思路。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决生产 、 生 活中有关电解质溶液的实际问题, 形成微粒观 、 平衡观和守 恒观。
实验目的
实验方案
A 证明Mg(OH)2沉淀可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
B 证明非金属性S>C
测定等物质的量浓度的Na2 SO3与Na2CO3溶液的
pH ,后者的pH大
C 常温下溶解度: BaSO4
沉淀中加稀盐酸 , 观察是否有气泡产生
D 酸性: 醋酸>硼酸
向两支分别盛有饱和碳酸钠溶液的试管中 , 滴加3滴
0. 1 mol/L的醋酸和硼酸溶液 , 观察现象。
高中化学
1 .下列实验方案是否正确?如有问题 , 请予以改正。
高中化学
实验目的
实验方案
A 证明Mg(OH)2沉淀可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
沉淀转化实验:
一定要注意试剂的添加顺序
3Mg(OH)2 (s)+2Fe3+ = 3Mg2++2Fe(OH)3(s)
高中化学
实验目的
实验方案
A 证明最M H含)2 可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/LN O弱H ,先 :3 CmOo3l/<LH2 SO3
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
B 证明非金属性S>C
测定等物质的量浓度的Na2 SO3与Na2CO3溶液的
pH ,后者的pH大
C 常温下溶解度: BaSO4< BaCO3
向饱和Na2CO3溶液中加少量BaSO4粉末 , 过滤 , 向洗净
沉淀中加稀盐酸 , 观察是否有气泡产生
D 酸性: 醋酸>硼酸
向两支分别盛有饱和碳酸钠溶液的试管中 , 滴加3滴
0. 1 mol/L的醋酸和硼酸溶液 , 观察现象。
高中化学
1 .下列实验方案是否正确?如有问题 , 请予以改正。
高中化学
一般的 , 溶解度小的沉淀转化成溶解度更小的沉淀容易实现。
已知:Ksp(BaCO3) = 2.58× 10-9 ,Ksp(BaSO4) = 1.07× 10- 10。
BaCO3(s)+SO42-) 、 CO32 -+BaSO4(s)
饱和Na2CO3溶液中有大量的CO32- , 当Ba2+浓度与CO32-的浓度
乘积Qc>Ksp , 就会产生BaCO3沉淀。
此时BaSO4会部分转化为BaCO3 , 并不是由于Ksp (BaCO3)<Ksp
(BaSO4)。 而是由于二者Ksp相差不大 , 通过调整溶液中的离子浓度大 小实现逆向转化的。
高中化学
已知:Ksp(BaCO3) = 2.58× 10-9 ,Ksp(BaSO4) = 1.07× 10- 10。
BaSO4(s) +CO32 - BaCO3(s)+SO42 - K =
BaSO4(s) Ba2++SO42 -
Ba2++CO32 - BaCO3(s)
= =
)
)
3
4
BaCO
BaSO
(
(
sp
sp
K
K
)
)
O32-
O42-
C
S
(
(
c
c
CO32-在溶液中的最大浓度约为2 mol/L , 故在溶液中c(SO42- )≤0.08 mol/L
时 ,都能转化。 但随着反应的进行 ,硫酸根离子很快就达到了这个浓度 , 转化就 达到了平衡。 所以溶解度相差的倍数越大 , 逆向转化越难。
K1= Ksp(BaSO4)
K2=
≈
K =
高中化学
BaCO3(s)+SO42 - 、 、 CO32-+BaSO4(s)
在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为:
将适量饱和Na2CO3溶液加入BaSO4沉淀中 , 充分搅拌 , 静置、 弃
去上层清液 , 如此操作 ,反复多次(直到BaSO4全部转化为BaCO3 )。
实验目的
实验方案
A 证明Mg(OH)2沉淀可以 转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L
MgCl2溶液 , 再加入3滴1 mol/L FeCl3溶液
B 证明非金属性S>C
测定等物质的量浓度的Na2 SO3与Na2CO3溶液的
C 常温下溶解度: BaSO4
沉淀中加稀盐酸 , 观察是否有气泡产生
D 酸性: 醋酸>硼酸
向两支分别盛有饱和碳酸钠溶液的试管中 , 滴加3滴
0. 1 mol/L 的醋酸和硼酸溶液 , 观察现象。
高中化学
1 .下列实验方案是否正确?如有问题 , 请予以改正。
pH ,后者的pH大 大量的 CO32- ,少量的 H+。
高中化学
高中化学
2. 某消毒液的主要成分为NaClO , 还含有一定量的NaOH , 下列用来解
释事实的方程式中不合理的是(饱和NaClO溶液的pH约为11) ( )
Cl2 +2OH- = Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:
ClO-+ H2O HClO+ OH -
C. 该消毒液与洁厕灵混用 , 产生Cl2:
2H++ Cl-+ ClO- = Cl2 ↑+ H2O
矛盾!
盐酸与醋酸比较
① 醋酸是弱酸 , 白醋浓度很低。
② 盐酸既引入了H+ , 增强了溶液 的酸性、 ClO-的氧化性; 又引入 了Cl- , 增强了Cl-的还原性。
D. 该消毒液加白醋生成HClO , 可增强漂白作用:
CH COOH+ ClO- = HClO+ CH COO—
A. 该消毒液可用NaOH溶液吸收Cl2制备:
3 3
高中化学
3 .废水中氨态氮以NH3 ·H2O、NH3和NH4+的形式存在 , 废水脱氮已成为主要污染
物减排和水体富营养化防治的研究热点。
Ⅰ . 沉淀法
向废水中投入MgCl2和Na2HPO4 , 生成MgNH4PO4 · 6H2O沉淀 , 可将氨态氮
NH3 ·H2O +Mg2+ + HPO42 -
NH4+ 和OH-
(2)废水中的NH3 ·H2O转化为MgNH4PO4 · 6H2O的离子方程式是 。
含量降至10 mg ·L 1以下。
( 1)NH3的电子式: 。
MgNH4PO4 · 6H2O↓
H N H
H
+5H2O
高中化学
(3) 16 ℃时 , 向废水中加入MgCl2和Na2HPO4 , 使镁、 氮、磷物质的量之比为 1 ︰ 1 ︰ 1 , 沉淀过程中的pH对剩余氨态氮浓度的影响如图。 欲使剩余氨态氮 浓度低于10 mg ·L 1 ,pH的适宜范围是 ;
pH偏大或者偏小均不利于MgNH4PO4 · 6H2O的生成 ,原因是 。
NH3 ·H2O +Mg2+ + HPO42-+5H2O MgNH4PO4 · 6H2O↓
pH偏大 , Mg2+易与OH 结合生成Mg(OH)2,
NH3 H2O的电离被抑制 , 使NH4+和Mg2+浓度降低。
pH偏小 ,不利于HPO42 电离 , PO43 浓度偏低。
pH =8~ 10
高中化学
3 .废水中氨态氮以NH3 ·H2O、NH3和NH4+的形式存在 , 废水脱氮已成为主要污染
物减排和水体富营养化防治的研究热点。
Ⅱ . 微波 氧化法
(4)仅对废水进行微波加热 ,pH对氨态氮脱出的影响如下表。
表中数据表明:pH增大有利于废水中化学平衡 (用化学用语表示)的移动。
溶液pH 6~7 8~9 10~11
11~12
剩余氨态氮浓度(mg ·L-1) 156 100 40
14
NH4+ + OH NH3 H2O
NH3 + H2O
高中化学
Ⅱ . 微波 氧化法
(5)微波协同CuO和H2O2 除去氨态氮
①其他条件相同 , 取相同体积的同一废水样品 , 微波10 min ,剩余氨态氮浓度
与一定浓度H2O2溶液添加量的关系如下图。 据图推测CuO在氨态氮脱除中可 能起催化作用 ,理由是 。
②微波协同CuO有利于H2O2 除去氨态氮。 该条件下 , H2O2将NH3氧化为N2的化
相同的H2O2溶液添加量 , 相同时间内, 与不加CuO相比 ,加入CuO , 氨态氮 浓度降低的多 ,反应速率快。
3H2O2+ 2NH3 N2+6H2O
学方程式是 。
感谢同学们收看!
高中化学
