3.2.4 水溶液中的离子平衡专题课件(共13张PPT)
文档属性
| 名称 | 3.2.4 水溶液中的离子平衡专题课件(共13张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 453.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:48:33 | ||
图片预览




文档简介
(共13张PPT)
水溶液中的离子平衡专题(四)
高中化学
学习目标
1. 能够运用多种手段获取信息, 能够从 “ 点 、 线 、 面 ”三个维度 分析图像, 并运用比较 、 分类 、 归纳 、 概括等方法对信息进行 加工, 提升获取信息能力和信息加工能力。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决有关电解质 溶液的实际问题, 进 一 步发展微粒观 、 平衡观和守恒观。
3. 进 一 步提升 “ 宏观辨识与微观探析 ” 的化学学科核心素养, 发 展系统思维能力。
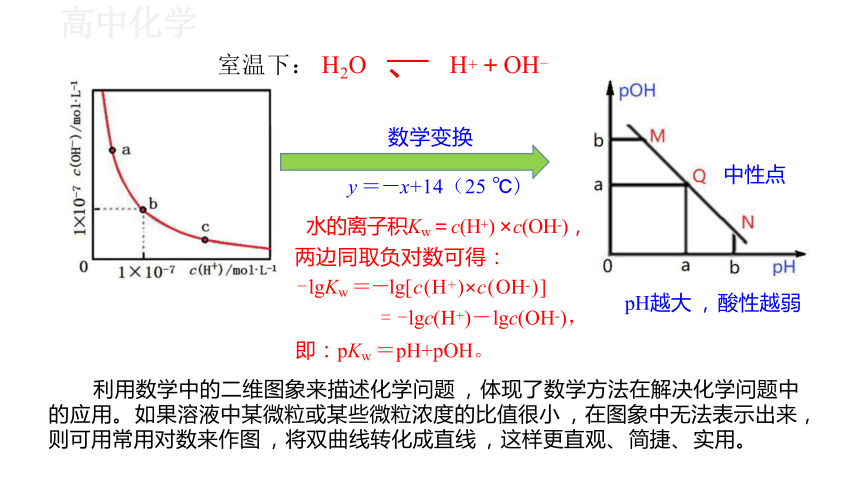
1 . 一定温度下 , 水溶液中H+和OH-的浓度变化曲线如图 , 下列说法正确的是( )
H2O H++OH-
A . 升高温度 , 可能引起由 c 向 b 的变化 酸性
B . 该温度下 , 水的离子积常数为1.0×10- 13
C . 该温度下 ,加入FeCl3可能引起由 b 向 a 的变化
D . 该温度下 ,稀释溶液可能引起由 c 向 d 的变化 碱性
高中化学
c(OH- ) ·c(H+ )=Kw
温度升高,Kw增大
Fe3+ +3H2O Fe(OH)3 +3H+
即:pKw =pH+pOH。
利用数学中的二维图象来描述化学问题 ,体现了数学方法在解决化学问题中 的应用。 如果溶液中某微粒或某些微粒浓度的比值很小 ,在图象中无法表示出来, 则可用常用对数来作图 ,将双曲线转化成直线 ,这样更直观、 简捷、 实用。
中性点
水的离子积Kw=c(H+) ×c(OH-),
两边同取负对数可得:
-lgKw =-lg[c(H+)×c(OH-)]
= -lgc(H+)-lgc(OH-),
数学变换
y =-x+14(25 ℃)
室温下: H2O 、 H++OH-
高中化学
pH越大 , 酸性越弱
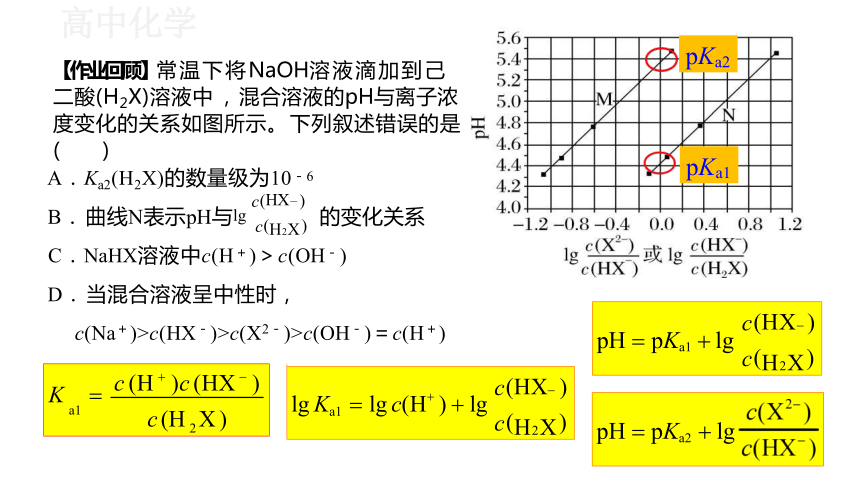
【作业回顾】常温下将NaOH溶液滴加到己 二酸(H2X)溶液中 , 混合溶液的pH与离子浓 度变化的关系如图所示。 下列叙述错误的是 ( )
A.Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与lg 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,
c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
)
)
H2X
HX-
(
(
c
c
K = a1 c (H 2 X )
lg Ka1 = lg c(H+ ) + lg
)
)
H2X
HX-
(
(
c
c
pH = pKa2 + lg
pH = pKa1 + lg
)
)
H2X
HX-
(
(
c
c
高中化学
c (H + )c (HX - )
pKa1
pKa2
A.Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与lg 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,
c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
c(Na2X) =c(NaHX)
)
)
H2X
HX-
(
(
c
c
高中化学
【作业回顾】常温下将NaOH溶液滴加到己 二酸(H2X)溶液中 , 混合溶液的pH与离子浓 度变化的关系如图所示。 下列叙述错误的是 ( D )
Kh2 = = 10-9 6
K .
pKa1
pKa2
高中化学
2. HA为一元弱酸。 已知溶液中HA、 A-的物质的量分数 δ 随溶液
pH变化的曲线如右图所示。 向10 mL 0. 1 mo 滴加 0. 1 mol ·L- 1 NaOH溶液 x mL。 下列说法中 ,不正确的是( )
A. pH = 9时 , c(A-) =c(HA)
B. x = 0时 , 1<pH<7
C. x = 5时 , c(A-) =c(HA)
D. x = 10时,
c(A-) + c(HA) = c(Na+) = 0.05mol ·L- 1
HA + NaOH = NaA +H2O
c (H + )c (A - ) K =
a c (HA )
HA H++A-
HA的电离平衡常数Ka= 10-9
HA 、NaA
水解>电离
10 mL 0. 1 mol ·L- 1
5 mL 0. 1 mol ·L- 1
Kh= 10-5
HA
A-
高中化学
2. HA为一元弱酸。 已知溶液中HA、 A-的物质的量分数 δ 随溶液
pH变化的曲线如右图所示。 向10 mL 0. 1 mol ·L- 1 HA溶液中 , 滴加
D. x = 10时,
0. 1 mol ·L- 1 NaOH溶液 x mL。 下列说法中 ,不正确的是(
c(A-) + c(HA) = c(Na+) = 0.05mol ·L- 1
NaA
物料守恒
① 坐标轴数据含义;
② 曲线对应的微粒及其曲线变化趋势;
③ 关键点;
④ 分析溶液问题的基本思路和守恒规律。
HA + NaOH = NaA +H2O
10 mL 0. 1 mol ·L- 1
10 mL 0. 1 mol ·L- 1
HA
A-
)
c(H2FeO4)>c(H3FeO4+)>c(HFeO4﹣)
( 1)pH=2.2时 , 溶液中主要含铁形体浓度的大小关系为 ;
为获得尽可能纯净的高铁酸盐 ,pH应控制在 ≥9 。
高中化学
3. 高铁酸盐在水溶液中有四种含铁形体。 25 ℃时 , 它们的物质的量 分数随pH的变化如图所示:
(2) 已知H3FeO4+ 的电离常数分别为:K1=2.51×10﹣2 ,K2=4. 16×10﹣4,
K3=5.01×10﹣8, 当 pH=4时 ,溶液中 )) = 。
(3) 向pH=6的高铁酸盐溶液中加入KOH溶液 ,反应的离子方程式 。
HFeO4﹣+OH﹣=FeO42﹣+H2O
4
﹣
(H2FeO
(HFeO4
c
c
高中化学
H2FeO4 H+ +HFeO4﹣
c(HFeO ) K2 4. 16 10
= =
c(H2 FeO4 ) c(H+ ) 10-4
-4
4
-
K2 = c(H ) c(HFeO )
c(H2 FeO4 )
+
4
-
= 4. 16
高中化学
(4) 高铁酸钾(K2FeO4 ) 具有极强的氧化性 ,是一种优良的水处理剂。
已知: 4FeO42-+10H2O 、 4Fe(OH)3+8OH-+3O2 ↑
K2FeO4在处理水的过程中所起的作用有 。
K2FeO4具有强氧化性 , 能够消毒杀菌;
同时FeO42- 被还原成Fe3+ , Fe3+水解形成Fe(OH)3胶体 , 能够吸附 水中悬浮杂质。
① 该电池的充电时的阳极反应为:Fe(OH)3 — 3e— + OH— = FeO42— + 4H2O
② 下图为该电池和常用的高能碱性电池的放电曲线 , 由此可得出的 高铁电池的优点有 放电时间长 、 工作电压稳定 。
高中化学
(5) 高铁电池是正在研制中的可充电电池 , 其工作原理如下:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn + 2K2FeO4 + 8H2O
放电
充电
感谢同学们收看!
高中化学
水溶液中的离子平衡专题(四)
高中化学
学习目标
1. 能够运用多种手段获取信息, 能够从 “ 点 、 线 、 面 ”三个维度 分析图像, 并运用比较 、 分类 、 归纳 、 概括等方法对信息进行 加工, 提升获取信息能力和信息加工能力。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决有关电解质 溶液的实际问题, 进 一 步发展微粒观 、 平衡观和守恒观。
3. 进 一 步提升 “ 宏观辨识与微观探析 ” 的化学学科核心素养, 发 展系统思维能力。
1 . 一定温度下 , 水溶液中H+和OH-的浓度变化曲线如图 , 下列说法正确的是( )
H2O H++OH-
A . 升高温度 , 可能引起由 c 向 b 的变化 酸性
B . 该温度下 , 水的离子积常数为1.0×10- 13
C . 该温度下 ,加入FeCl3可能引起由 b 向 a 的变化
D . 该温度下 ,稀释溶液可能引起由 c 向 d 的变化 碱性
高中化学
c(OH- ) ·c(H+ )=Kw
温度升高,Kw增大
Fe3+ +3H2O Fe(OH)3 +3H+
即:pKw =pH+pOH。
利用数学中的二维图象来描述化学问题 ,体现了数学方法在解决化学问题中 的应用。 如果溶液中某微粒或某些微粒浓度的比值很小 ,在图象中无法表示出来, 则可用常用对数来作图 ,将双曲线转化成直线 ,这样更直观、 简捷、 实用。
中性点
水的离子积Kw=c(H+) ×c(OH-),
两边同取负对数可得:
-lgKw =-lg[c(H+)×c(OH-)]
= -lgc(H+)-lgc(OH-),
数学变换
y =-x+14(25 ℃)
室温下: H2O 、 H++OH-
高中化学
pH越大 , 酸性越弱
【作业回顾】常温下将NaOH溶液滴加到己 二酸(H2X)溶液中 , 混合溶液的pH与离子浓 度变化的关系如图所示。 下列叙述错误的是 ( )
A.Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与lg 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,
c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
)
)
H2X
HX-
(
(
c
c
K = a1 c (H 2 X )
lg Ka1 = lg c(H+ ) + lg
)
)
H2X
HX-
(
(
c
c
pH = pKa2 + lg
pH = pKa1 + lg
)
)
H2X
HX-
(
(
c
c
高中化学
c (H + )c (HX - )
pKa1
pKa2
A.Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与lg 的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,
c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
c(Na2X) =c(NaHX)
)
)
H2X
HX-
(
(
c
c
高中化学
【作业回顾】常温下将NaOH溶液滴加到己 二酸(H2X)溶液中 , 混合溶液的pH与离子浓 度变化的关系如图所示。 下列叙述错误的是 ( D )
Kh2 = = 10-9 6
K .
pKa1
pKa2
高中化学
2. HA为一元弱酸。 已知溶液中HA、 A-的物质的量分数 δ 随溶液
pH变化的曲线如右图所示。 向10 mL 0. 1 mo 滴加 0. 1 mol ·L- 1 NaOH溶液 x mL。 下列说法中 ,不正确的是( )
A. pH = 9时 , c(A-) =c(HA)
B. x = 0时 , 1<pH<7
C. x = 5时 , c(A-) =c(HA)
D. x = 10时,
c(A-) + c(HA) = c(Na+) = 0.05mol ·L- 1
HA + NaOH = NaA +H2O
c (H + )c (A - ) K =
a c (HA )
HA H++A-
HA的电离平衡常数Ka= 10-9
HA 、NaA
水解>电离
10 mL 0. 1 mol ·L- 1
5 mL 0. 1 mol ·L- 1
Kh= 10-5
HA
A-
高中化学
2. HA为一元弱酸。 已知溶液中HA、 A-的物质的量分数 δ 随溶液
pH变化的曲线如右图所示。 向10 mL 0. 1 mol ·L- 1 HA溶液中 , 滴加
D. x = 10时,
0. 1 mol ·L- 1 NaOH溶液 x mL。 下列说法中 ,不正确的是(
c(A-) + c(HA) = c(Na+) = 0.05mol ·L- 1
NaA
物料守恒
① 坐标轴数据含义;
② 曲线对应的微粒及其曲线变化趋势;
③ 关键点;
④ 分析溶液问题的基本思路和守恒规律。
HA + NaOH = NaA +H2O
10 mL 0. 1 mol ·L- 1
10 mL 0. 1 mol ·L- 1
HA
A-
)
c(H2FeO4)>c(H3FeO4+)>c(HFeO4﹣)
( 1)pH=2.2时 , 溶液中主要含铁形体浓度的大小关系为 ;
为获得尽可能纯净的高铁酸盐 ,pH应控制在 ≥9 。
高中化学
3. 高铁酸盐在水溶液中有四种含铁形体。 25 ℃时 , 它们的物质的量 分数随pH的变化如图所示:
(2) 已知H3FeO4+ 的电离常数分别为:K1=2.51×10﹣2 ,K2=4. 16×10﹣4,
K3=5.01×10﹣8, 当 pH=4时 ,溶液中 )) = 。
(3) 向pH=6的高铁酸盐溶液中加入KOH溶液 ,反应的离子方程式 。
HFeO4﹣+OH﹣=FeO42﹣+H2O
4
﹣
(H2FeO
(HFeO4
c
c
高中化学
H2FeO4 H+ +HFeO4﹣
c(HFeO ) K2 4. 16 10
= =
c(H2 FeO4 ) c(H+ ) 10-4
-4
4
-
K2 = c(H ) c(HFeO )
c(H2 FeO4 )
+
4
-
= 4. 16
高中化学
(4) 高铁酸钾(K2FeO4 ) 具有极强的氧化性 ,是一种优良的水处理剂。
已知: 4FeO42-+10H2O 、 4Fe(OH)3+8OH-+3O2 ↑
K2FeO4在处理水的过程中所起的作用有 。
K2FeO4具有强氧化性 , 能够消毒杀菌;
同时FeO42- 被还原成Fe3+ , Fe3+水解形成Fe(OH)3胶体 , 能够吸附 水中悬浮杂质。
① 该电池的充电时的阳极反应为:Fe(OH)3 — 3e— + OH— = FeO42— + 4H2O
② 下图为该电池和常用的高能碱性电池的放电曲线 , 由此可得出的 高铁电池的优点有 放电时间长 、 工作电压稳定 。
高中化学
(5) 高铁电池是正在研制中的可充电电池 , 其工作原理如下:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn + 2K2FeO4 + 8H2O
放电
充电
感谢同学们收看!
高中化学
