3.2.5 水溶液中的离子平衡专题课件(15张PPT)
文档属性
| 名称 | 3.2.5 水溶液中的离子平衡专题课件(15张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 401.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:50:13 | ||
图片预览



文档简介
(共15张PPT)
水溶液中的离子平衡专题(五)
高中化学
学习目标
1. 运用比较 、 分类 、 归纳等方法对信息进行加工, 分清事物的主 次矛盾, 解决较为复杂的溶液问题。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决有关电解质 溶液的实际问题, 进 一 步发展微粒观 、 平衡观和守恒观。
3. 进 一 步提升 “ 宏观辨识与微观探析 ” 的化学学科核心素养, 发 展系统思维能力。
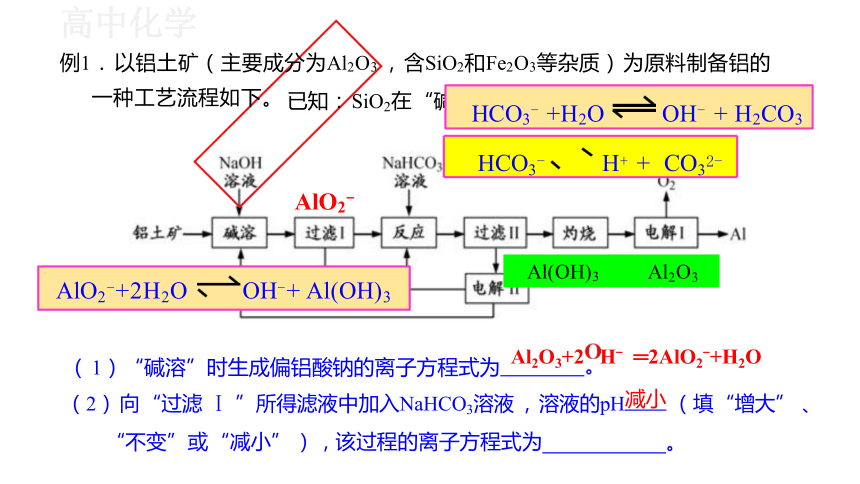
( 1)“碱溶”时生成偏铝酸钠的离子方程式为 Al2O3+2 H- ═2AlO2-+H2O
(2) 向 “过滤 Ⅰ ”所得滤液中加入NaHCO3溶液 , 溶液的pH减小 (填 “增大” 、
“不变”或 “减小” ) , 该过程的离子方程式为 。
AlO2-
高中化学
例1. 以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质) 为原料制备铝的
一种工艺流程如下。
AlO2-+2H2O OH-+ Al(OH)3
已知: SiO2在 “碱
HCO3- +H2O OH- + H2CO3
HCO3- H+ + CO32-
Al(OH)3 Al2O3
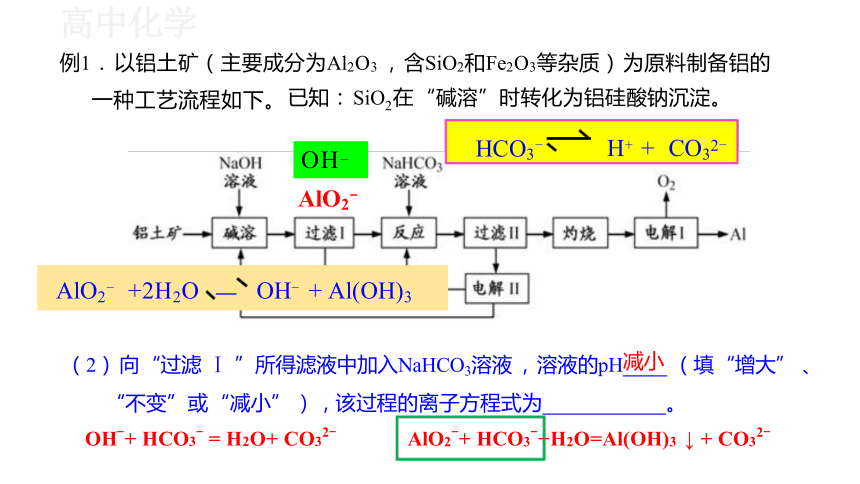
(2) 向 “过滤 Ⅰ ”所得滤液中加入NaHCO3溶液 , 溶液的pH减小 (填 “增大” 、
“不变”或 “减小” ) , 该过程的离子方程式为 。
OH-+ HCO3- = H2O+ CO32- AlO2-+ HCO3-+H2O=Al(OH)3 ↓ + CO32-
高中化学
例1. 以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质) 为原料制备铝的
一种工艺流程如下。 已知: SiO2在 “碱溶”时转化为铝硅酸钠沉淀。
AlO2- +2H2O OH- + Al(OH)3
HCO3-
H+ + CO32-
OH-
AlO2-
AlO2-+ HCO3-+H2O =Al(OH)3 ↓
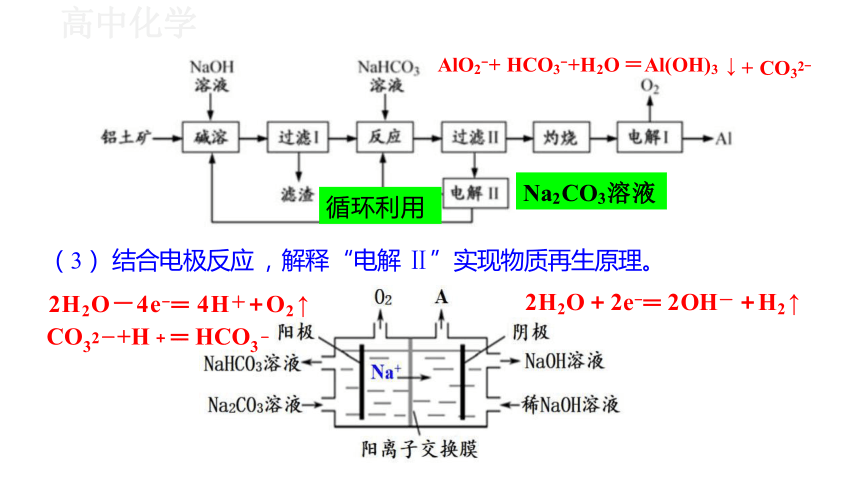
Na2CO3溶液
(3) 结合电极反应 , 解释 “电解 Ⅱ”实现物质再生原理。
2H2O-4e-═ 4H++O2 ↑
CO32-+H + ═ HCO3 -
2H2O+2e-═ 2OH- +H2 ↑
高中化学
循环利用
+ CO32-
本题的启示:
1.基本反应 { ) H2O
OH-+ HCO3- = H2O+ CO32-
解 4
3O
O3
Al
A
电
3
3
H
O
O
Al
Al
2
2
高考命题一向遵循 “知识源于教材 , 立意高于教材; 原理基于教材 , 试
题取材真实情境”的命题理念。 工艺流程中涉及的大部分化学反应均来源于 教材 , 其反应原理也源于教材。
Al2O3+2OH- ═2AlO2-+H2O
高中化学
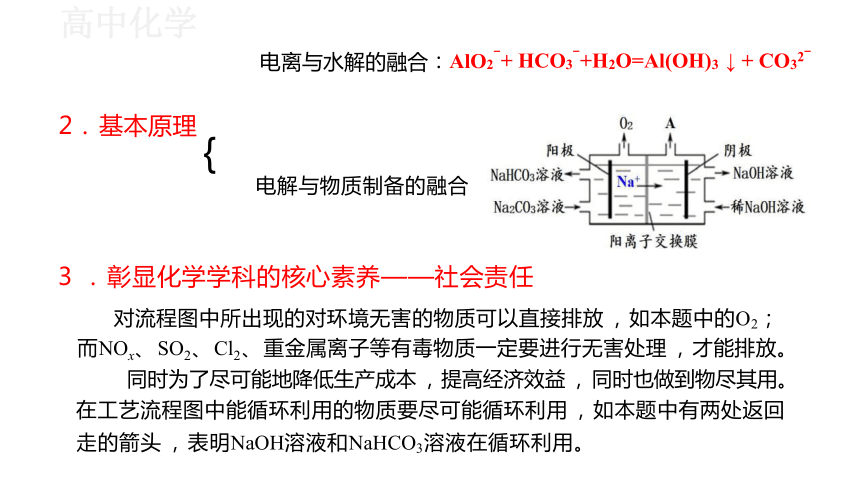
3 . 彰显化学学科的核心素养——社会责任
对流程图中所出现的对环境无害的物质可以直接排放 , 如本题中的O2;
而NOx、 SO2、 Cl2、 重金属离子等有毒物质一定要进行无害处理 , 才能排放。
同时为了尽可能地降低生产成本 , 提高经济效益 , 同时也做到物尽其用。
在工艺流程图中能循环利用的物质要尽可能循环利用 , 如本题中有两处返回 走的箭头 , 表明NaOH溶液和NaHCO3溶液在循环利用。
高中化学
{
电离与水解的融合:AlO2-+ HCO3-+H2O=Al(OH)3 ↓ + CO32-
电解与物质制备的融合
2. 基本原理
( 1) 为什么 I 中无明显现象?对比 Ⅰ、 Ⅲ , 解释说明 III 中的现象 。
① Na2CO3溶液能破坏铝表面的保护膜: Al2O3+2OH- ═2AlO2-+H2O
② Na2CO3溶液显碱性: CO32-+ H2O HCO3 -+ OH-
③ 气泡的产生: 2Al+2H2O+2OH- ═2AlO2-+3H2 ↑
高中化学
例2 . 探究铝片(未打磨) 与Na2CO3溶液的反应。
高中化学
推测出现白色浑浊的可能原因: AlO2 - + HCO3 - + H2O =Al(OH)3 ↓+ CO32 -
AlO2- +2H2O OH- + Al(OH)3
CO32-+ H2O 、 、HCO3 -+ OH- 2HCO3- CO32-+ H2O + CO2 ↑
2Al+2H2O+2OH- ═ 2AlO2- +3H2 ↑
(2)加热时发生 了哪些变化?
② 促进了碳酸钠的水解
① 加快反应速率
高中化学
例3 . 依据 “越热越水解”的规律 , 对 Na2CO3溶液升高温度 , 其水
解程度增大 , 溶液pH是否一定升高呢?
溶质 Na2CO3 溶剂 H2O
① Na2CO3= 2Na++CO32 - 水解
③
HCO3 -
电离
② H2O OH-+H+
客观
事实
分析溶质和溶剂在水溶液中行为
理清主次 , 得出结论
后期下降: ② 电离为主
前期上升: ③ 水解为主
高中化学
溶液
组成
高中化学
25 ℃时 ,碳酸钠的水解常数 Kh1 =1.78×10-4
55 ℃时 ,碳酸钠的水解常数 Kh2 =8. 10×10-4 80 ℃时 ,碳酸钠的水解常数 Kh3 =2.35×10-3
水解常数随温度的升高而增大,
所以 “越热越水解”的规律是正确的。
25 ℃时 , 水的离子积 Kw1 =1.0×10- 14
55 ℃时 , 水的离子积 Kw2 =7.3×10- 14 80 ℃时 , 水的离子积 Kw3 =2.5×10- 13
水的离子积随温度的升高而增大,
所以 “越热越电离”的规律是正确的。
对于一定浓度的 Na2CO3 溶液来
说 ,Kw 和 Kh 都随着温度的升 高而增大 ,所以 c(H+) 的 大小 就由Kw/ Kh 的相对大小而决定 , 若温度升高时 , Kw/ Kh 变大,
则 c(H+)变大 ,pH 减小。
pH 的大小是由温度对水的电离
和盐类水解影响的相对大小共 同决定的。
你能分析出可能的原因吗?
甲认为: HCO3 -的水解程度随温度升高而增大 , 溶液碱性增强。
乙认为: 温度升高造成NaHCO3受热生成Na2CO3 , 溶液碱性增强。
温度(℃) 10 20 30
加热煮沸后 冷却到50 ℃
pH 8.3 8.4 8.5
8.8
高中化学
例4 . 如果给碳酸氢钠溶液加热 , 溶液pH将如何变化?
10 ℃时加热 1 mol/L NaHCO3溶液
1 mol/L 酒精灯
水浴
加热约5分钟 溶液沸腾,产生大量气泡。 溶液颜色加深。澄清石灰水 变浑浊。
溶液颜色加深,有细小气泡放
出,振荡后放出大量气泡。澄 清石灰水变浑浊。
冷却至原温度 溶液停止沸腾。溶液颜色比 对照溶液深。
气泡不再放出。溶液颜色比对
照溶液深。
甲认为: HCO3 -的水解程度随温度升高而增大 , 溶液碱性增强。
乙认为: 温度升高造成NaHCO3受热生成Na2CO3 , 溶液碱性增强。
高中化学
感谢同学们收看!
高中化学
水溶液中的离子平衡专题(五)
高中化学
学习目标
1. 运用比较 、 分类 、 归纳等方法对信息进行加工, 分清事物的主 次矛盾, 解决较为复杂的溶液问题。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决有关电解质 溶液的实际问题, 进 一 步发展微粒观 、 平衡观和守恒观。
3. 进 一 步提升 “ 宏观辨识与微观探析 ” 的化学学科核心素养, 发 展系统思维能力。
( 1)“碱溶”时生成偏铝酸钠的离子方程式为 Al2O3+2 H- ═2AlO2-+H2O
(2) 向 “过滤 Ⅰ ”所得滤液中加入NaHCO3溶液 , 溶液的pH减小 (填 “增大” 、
“不变”或 “减小” ) , 该过程的离子方程式为 。
AlO2-
高中化学
例1. 以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质) 为原料制备铝的
一种工艺流程如下。
AlO2-+2H2O OH-+ Al(OH)3
已知: SiO2在 “碱
HCO3- +H2O OH- + H2CO3
HCO3- H+ + CO32-
Al(OH)3 Al2O3
(2) 向 “过滤 Ⅰ ”所得滤液中加入NaHCO3溶液 , 溶液的pH减小 (填 “增大” 、
“不变”或 “减小” ) , 该过程的离子方程式为 。
OH-+ HCO3- = H2O+ CO32- AlO2-+ HCO3-+H2O=Al(OH)3 ↓ + CO32-
高中化学
例1. 以铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3等杂质) 为原料制备铝的
一种工艺流程如下。 已知: SiO2在 “碱溶”时转化为铝硅酸钠沉淀。
AlO2- +2H2O OH- + Al(OH)3
HCO3-
H+ + CO32-
OH-
AlO2-
AlO2-+ HCO3-+H2O =Al(OH)3 ↓
Na2CO3溶液
(3) 结合电极反应 , 解释 “电解 Ⅱ”实现物质再生原理。
2H2O-4e-═ 4H++O2 ↑
CO32-+H + ═ HCO3 -
2H2O+2e-═ 2OH- +H2 ↑
高中化学
循环利用
+ CO32-
本题的启示:
1.基本反应 { ) H2O
OH-+ HCO3- = H2O+ CO32-
解 4
3O
O3
Al
A
电
3
3
H
O
O
Al
Al
2
2
高考命题一向遵循 “知识源于教材 , 立意高于教材; 原理基于教材 , 试
题取材真实情境”的命题理念。 工艺流程中涉及的大部分化学反应均来源于 教材 , 其反应原理也源于教材。
Al2O3+2OH- ═2AlO2-+H2O
高中化学
3 . 彰显化学学科的核心素养——社会责任
对流程图中所出现的对环境无害的物质可以直接排放 , 如本题中的O2;
而NOx、 SO2、 Cl2、 重金属离子等有毒物质一定要进行无害处理 , 才能排放。
同时为了尽可能地降低生产成本 , 提高经济效益 , 同时也做到物尽其用。
在工艺流程图中能循环利用的物质要尽可能循环利用 , 如本题中有两处返回 走的箭头 , 表明NaOH溶液和NaHCO3溶液在循环利用。
高中化学
{
电离与水解的融合:AlO2-+ HCO3-+H2O=Al(OH)3 ↓ + CO32-
电解与物质制备的融合
2. 基本原理
( 1) 为什么 I 中无明显现象?对比 Ⅰ、 Ⅲ , 解释说明 III 中的现象 。
① Na2CO3溶液能破坏铝表面的保护膜: Al2O3+2OH- ═2AlO2-+H2O
② Na2CO3溶液显碱性: CO32-+ H2O HCO3 -+ OH-
③ 气泡的产生: 2Al+2H2O+2OH- ═2AlO2-+3H2 ↑
高中化学
例2 . 探究铝片(未打磨) 与Na2CO3溶液的反应。
高中化学
推测出现白色浑浊的可能原因: AlO2 - + HCO3 - + H2O =Al(OH)3 ↓+ CO32 -
AlO2- +2H2O OH- + Al(OH)3
CO32-+ H2O 、 、HCO3 -+ OH- 2HCO3- CO32-+ H2O + CO2 ↑
2Al+2H2O+2OH- ═ 2AlO2- +3H2 ↑
(2)加热时发生 了哪些变化?
② 促进了碳酸钠的水解
① 加快反应速率
高中化学
例3 . 依据 “越热越水解”的规律 , 对 Na2CO3溶液升高温度 , 其水
解程度增大 , 溶液pH是否一定升高呢?
溶质 Na2CO3 溶剂 H2O
① Na2CO3= 2Na++CO32 - 水解
③
HCO3 -
电离
② H2O OH-+H+
客观
事实
分析溶质和溶剂在水溶液中行为
理清主次 , 得出结论
后期下降: ② 电离为主
前期上升: ③ 水解为主
高中化学
溶液
组成
高中化学
25 ℃时 ,碳酸钠的水解常数 Kh1 =1.78×10-4
55 ℃时 ,碳酸钠的水解常数 Kh2 =8. 10×10-4 80 ℃时 ,碳酸钠的水解常数 Kh3 =2.35×10-3
水解常数随温度的升高而增大,
所以 “越热越水解”的规律是正确的。
25 ℃时 , 水的离子积 Kw1 =1.0×10- 14
55 ℃时 , 水的离子积 Kw2 =7.3×10- 14 80 ℃时 , 水的离子积 Kw3 =2.5×10- 13
水的离子积随温度的升高而增大,
所以 “越热越电离”的规律是正确的。
对于一定浓度的 Na2CO3 溶液来
说 ,Kw 和 Kh 都随着温度的升 高而增大 ,所以 c(H+) 的 大小 就由Kw/ Kh 的相对大小而决定 , 若温度升高时 , Kw/ Kh 变大,
则 c(H+)变大 ,pH 减小。
pH 的大小是由温度对水的电离
和盐类水解影响的相对大小共 同决定的。
你能分析出可能的原因吗?
甲认为: HCO3 -的水解程度随温度升高而增大 , 溶液碱性增强。
乙认为: 温度升高造成NaHCO3受热生成Na2CO3 , 溶液碱性增强。
温度(℃) 10 20 30
加热煮沸后 冷却到50 ℃
pH 8.3 8.4 8.5
8.8
高中化学
例4 . 如果给碳酸氢钠溶液加热 , 溶液pH将如何变化?
10 ℃时加热 1 mol/L NaHCO3溶液
1 mol/L 酒精灯
水浴
加热约5分钟 溶液沸腾,产生大量气泡。 溶液颜色加深。澄清石灰水 变浑浊。
溶液颜色加深,有细小气泡放
出,振荡后放出大量气泡。澄 清石灰水变浑浊。
冷却至原温度 溶液停止沸腾。溶液颜色比 对照溶液深。
气泡不再放出。溶液颜色比对
照溶液深。
甲认为: HCO3 -的水解程度随温度升高而增大 , 溶液碱性增强。
乙认为: 温度升高造成NaHCO3受热生成Na2CO3 , 溶液碱性增强。
高中化学
感谢同学们收看!
高中化学
