3.2.3 水溶液中的离子平衡专题课件(共17张PPT)
文档属性
| 名称 | 3.2.3 水溶液中的离子平衡专题课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 509.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:51:23 | ||
图片预览


文档简介
(共17张PPT)
水溶液中的离子平衡专题(三)
高中化学
学习目标
1. 通过典型例题学习, 能从电离 、 水解 、 离子反应 、 化学平衡 的角度分析溶液中微粒变化及其宏观现象, 进 一 步加深对水 溶液中平衡的理解, 系统构建水溶液中离子间相互作用与平 衡的基本思路。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决生产 、 生 活中有关电解质溶液的实际问题, 形成微粒观 、 平衡观和守 恒观。
高中化学
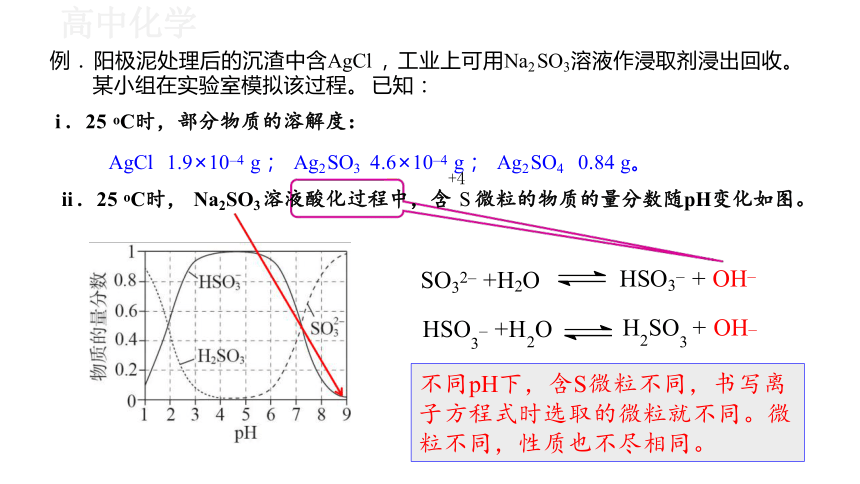
例. 阳极泥处理后的沉渣中含AgCl , 工业上可用Na2 SO3溶液作浸取剂浸出回收。 某小组在实验室模拟该过程。 已知:
i .25 oC时,部分物质的溶解度:
AgCl 1.9×10–4 g; Ag2 SO3 4.6×10–4 g; Ag2 SO4 0.84 g。
不同pH下,含S微粒不同,书写离 子方程式时选取的微粒就不同。微 粒不同,性质也不尽相同。
+4
ii .25 oC时, Na2SO3 溶液酸化过程中,含 S 微粒的物质的量分数随pH变化如图。
HSO3– + OH–
H2SO3 + OH–
SO32– +H2O
HSO3– +H2O
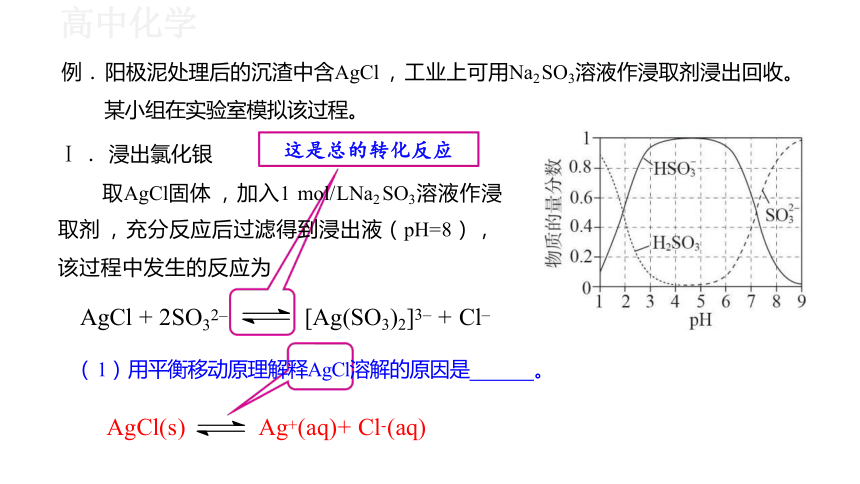
Ⅰ . 浸出氯化银
取AgCl固体 ,加入1 mol/LNa2 SO3溶液作浸
取剂 , 充分反应后过滤得到浸出液(pH=8) , 该过程中发生的反应为
高中化学
例. 阳极泥处理后的沉渣中含AgCl , 工业上可用Na2 SO3溶液作浸取剂浸出回收。
( 1) 用平衡移动原理解释AgCl溶解的原因是 。
AgCl + 2SO32– [Ag(SO3)2]3– + Cl–
AgCl(s) Ag+(aq)+ Cl-(aq)
某小组在实验室模拟该过程。
这是总的转化反应
高中化学
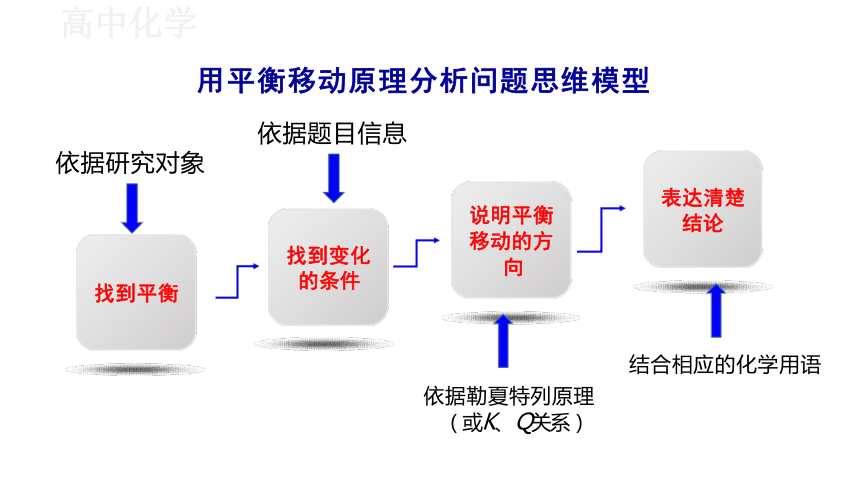
用平衡移动原理分析问题思维模型
说明平衡
移动的方
向
找到变化 的条件
表达清楚 结论
找到平衡
依据勒夏特列原理 (或K、 Q关系)
结合相应的化学用语
依据题目信息
依据研究对象
高中化学
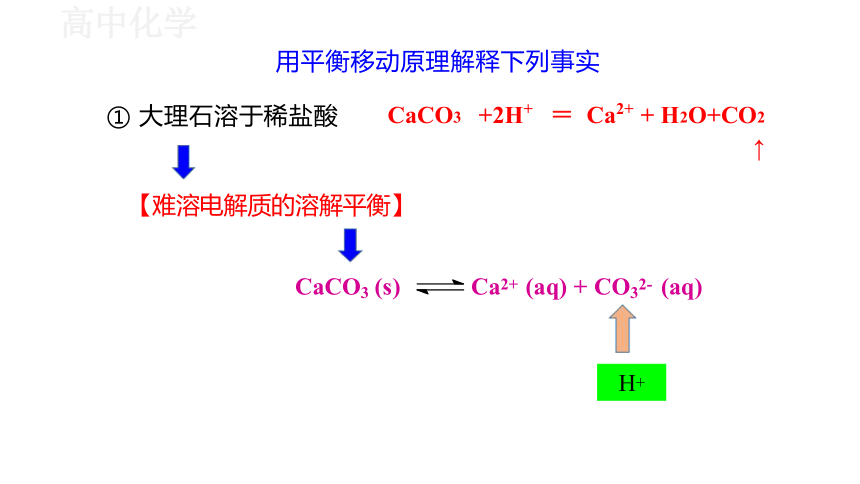
用平衡移动原理解释下列事实
【难溶电解质的溶解平衡】
CaCO3 (s)
CaCO3 +2H+ = Ca2+ + H2O+CO2 ↑
① 大理石溶于稀盐酸
Ca2+ (aq) + CO32- (aq)
H+
高中化学
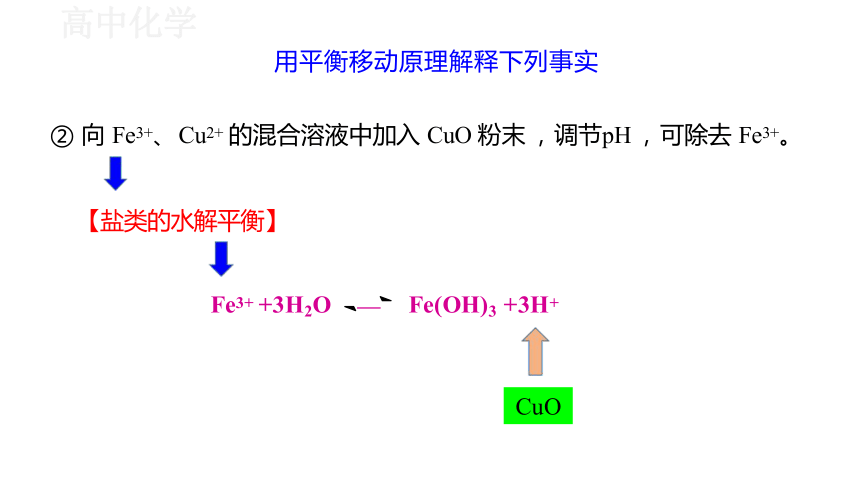
用平衡移动原理解释下列事实
② 向 Fe3+、 Cu2+ 的混合溶液中加入 CuO 粉末 , 调节pH , 可除去 Fe3+。
【盐类的水解平衡】
Fe3+ +3H2O Fe(OH)3 +3H+
CuO
高中化学
用平衡移动原理解释下列事实
③ 向浓氨水中加入NaOH固体 , 快速制取氨气
【弱电解质的电离平衡】
NH3 · H2O
NH4+ +OH-
NH3 · H2O NH3 +H2O
【气体的溶解平衡】
OH-
经检测 , 沉淀 m 为AgCl,
+ 4
则溶液 m 中含 S 微粒
的主要存在形式是 HS 3 –
高中化学
Ⅱ . 酸化沉银
AgCl + 2SO - [Ag(SO3)2]3– + Cl–
3
2
(pH=8)
(2)
AgCl 1.9×10–4 g; Ag2 SO3 4.6×10–4 g; Ag2 SO4 0.84 g。
(3) 探究沉淀 n 的成分。
① 甲同学认为沉淀 n 一定不含 Ag2SO4 , 其依据是 。
Ag2 SO4的溶解度远大于AgCl 或 Ag2 SO3 , 溶液中Ag+ 、 SO42-的浓度很小。
② 乙同学认为沉淀 n 可能含 Ag2SO3 , 进行实验验证。
高中化学
Ⅱ . 酸化沉银
AgCl + 2SO - [Ag(SO3)2]3– + Cl–
3
2
(pH=8)
AgCl
重要的氧化剂
i. 本实验设计的依据是 :Ag2SO3具有 还原 性。
ii. 乙同学观察到 , 得出结论 “沉淀 n 不含Ag2SO3”。
高中化学
② 乙同学认为沉淀 n 可能含 Ag2SO3 , 进行实验验证。
b 中清液的颜色与 c 相同 , 均为浅紫色溶液。
的总物质的量 < (填 “>”“=”或 “<” ) Cl– 物质的量。
ii. 结合实验现象简述丙同学的推理过程: 。
e中无沉淀生成 , 说明清液中没有Cl- ,则溶液n中加入稀硝酸使[Ag(SO3)2]3–全部转化为 Ag+ ,Ag+与Cl–全部沉淀 , 由此可知溶液n中含Ag元素的微粒总物质的量不小于n(Cl–)。
③ 丙同学从溶液 n 的成分角度再次设计实验证明沉淀 n 不含Ag2SO3。
+1 检验Cl-
n(Ag)<n(Cl-)
AgCl + 2SO - [Ag(SO3)2]3– + Cl–
3
2
i. 本实验设计的依据是: 若沉淀 n 含Ag2SO3 ,则溶液 n 中含
高中化学
+1
Ag
微粒
Ⅲ . 浸取剂再生
(4) 溶液 m 经处理后可再用于浸出 AgCl,
请简述该处理方法 。
加NaOH溶液调节pH至9~ 10。
H2SO3 H++HSO3 - HSO3 -
H++SO32 -
高中化学
(pH=8)
阳极泥处理后的沉渣中含AgCl
AgCl +2SO32– [Ag(SO3)2]3– + Cl–
[Ag(SO3)2]3– + Cl–
高中化学
[Ag(SO3)2]3– + Cl–
AgCl
AgCl +2SO32–
Ag(SO3)23-将HCHO氧化为CO32-
① 为充分利用资源 , 向浸银残液中通入气体X得到Na2SO3再生液 , X是 SO2。
② 在提取银过程中 , 其他条件不变 , Na2SO3再生液的循环使用次数与银的浸出 率关系如图。 试结合平衡移动原理 ,解释产生这种变化的原因 。
阳极泥
处理后
的沉渣
中含
AgCl
AgCl +2SO32– [Ag(SO3)2]3– + Cl–
高中化学
实验 pH
现象
a 10
产生白色沉淀,稍后溶解,溶液澄清
b 6
产生白色沉淀,一段时间后,沉淀未溶解
c 2
产生大量白色沉淀,一段时间后,产生海绵状棕
黑色物质X
高中化学
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究。 ( 1)测得Na2SO3溶液pH= 10 ,AgNO3溶液pH=5。
(2) 调节pH , 实验记录如下:
感谢同学们收看!
高中化学
水溶液中的离子平衡专题(三)
高中化学
学习目标
1. 通过典型例题学习, 能从电离 、 水解 、 离子反应 、 化学平衡 的角度分析溶液中微粒变化及其宏观现象, 进 一 步加深对水 溶液中平衡的理解, 系统构建水溶液中离子间相互作用与平 衡的基本思路。
2. 能综合运用离子反应 、 化学平衡原理, 分析和解决生产 、 生 活中有关电解质溶液的实际问题, 形成微粒观 、 平衡观和守 恒观。
高中化学
例. 阳极泥处理后的沉渣中含AgCl , 工业上可用Na2 SO3溶液作浸取剂浸出回收。 某小组在实验室模拟该过程。 已知:
i .25 oC时,部分物质的溶解度:
AgCl 1.9×10–4 g; Ag2 SO3 4.6×10–4 g; Ag2 SO4 0.84 g。
不同pH下,含S微粒不同,书写离 子方程式时选取的微粒就不同。微 粒不同,性质也不尽相同。
+4
ii .25 oC时, Na2SO3 溶液酸化过程中,含 S 微粒的物质的量分数随pH变化如图。
HSO3– + OH–
H2SO3 + OH–
SO32– +H2O
HSO3– +H2O
Ⅰ . 浸出氯化银
取AgCl固体 ,加入1 mol/LNa2 SO3溶液作浸
取剂 , 充分反应后过滤得到浸出液(pH=8) , 该过程中发生的反应为
高中化学
例. 阳极泥处理后的沉渣中含AgCl , 工业上可用Na2 SO3溶液作浸取剂浸出回收。
( 1) 用平衡移动原理解释AgCl溶解的原因是 。
AgCl + 2SO32– [Ag(SO3)2]3– + Cl–
AgCl(s) Ag+(aq)+ Cl-(aq)
某小组在实验室模拟该过程。
这是总的转化反应
高中化学
用平衡移动原理分析问题思维模型
说明平衡
移动的方
向
找到变化 的条件
表达清楚 结论
找到平衡
依据勒夏特列原理 (或K、 Q关系)
结合相应的化学用语
依据题目信息
依据研究对象
高中化学
用平衡移动原理解释下列事实
【难溶电解质的溶解平衡】
CaCO3 (s)
CaCO3 +2H+ = Ca2+ + H2O+CO2 ↑
① 大理石溶于稀盐酸
Ca2+ (aq) + CO32- (aq)
H+
高中化学
用平衡移动原理解释下列事实
② 向 Fe3+、 Cu2+ 的混合溶液中加入 CuO 粉末 , 调节pH , 可除去 Fe3+。
【盐类的水解平衡】
Fe3+ +3H2O Fe(OH)3 +3H+
CuO
高中化学
用平衡移动原理解释下列事实
③ 向浓氨水中加入NaOH固体 , 快速制取氨气
【弱电解质的电离平衡】
NH3 · H2O
NH4+ +OH-
NH3 · H2O NH3 +H2O
【气体的溶解平衡】
OH-
经检测 , 沉淀 m 为AgCl,
+ 4
则溶液 m 中含 S 微粒
的主要存在形式是 HS 3 –
高中化学
Ⅱ . 酸化沉银
AgCl + 2SO - [Ag(SO3)2]3– + Cl–
3
2
(pH=8)
(2)
AgCl 1.9×10–4 g; Ag2 SO3 4.6×10–4 g; Ag2 SO4 0.84 g。
(3) 探究沉淀 n 的成分。
① 甲同学认为沉淀 n 一定不含 Ag2SO4 , 其依据是 。
Ag2 SO4的溶解度远大于AgCl 或 Ag2 SO3 , 溶液中Ag+ 、 SO42-的浓度很小。
② 乙同学认为沉淀 n 可能含 Ag2SO3 , 进行实验验证。
高中化学
Ⅱ . 酸化沉银
AgCl + 2SO - [Ag(SO3)2]3– + Cl–
3
2
(pH=8)
AgCl
重要的氧化剂
i. 本实验设计的依据是 :Ag2SO3具有 还原 性。
ii. 乙同学观察到 , 得出结论 “沉淀 n 不含Ag2SO3”。
高中化学
② 乙同学认为沉淀 n 可能含 Ag2SO3 , 进行实验验证。
b 中清液的颜色与 c 相同 , 均为浅紫色溶液。
的总物质的量 < (填 “>”“=”或 “<” ) Cl– 物质的量。
ii. 结合实验现象简述丙同学的推理过程: 。
e中无沉淀生成 , 说明清液中没有Cl- ,则溶液n中加入稀硝酸使[Ag(SO3)2]3–全部转化为 Ag+ ,Ag+与Cl–全部沉淀 , 由此可知溶液n中含Ag元素的微粒总物质的量不小于n(Cl–)。
③ 丙同学从溶液 n 的成分角度再次设计实验证明沉淀 n 不含Ag2SO3。
+1 检验Cl-
n(Ag)<n(Cl-)
AgCl + 2SO - [Ag(SO3)2]3– + Cl–
3
2
i. 本实验设计的依据是: 若沉淀 n 含Ag2SO3 ,则溶液 n 中含
高中化学
+1
Ag
微粒
Ⅲ . 浸取剂再生
(4) 溶液 m 经处理后可再用于浸出 AgCl,
请简述该处理方法 。
加NaOH溶液调节pH至9~ 10。
H2SO3 H++HSO3 - HSO3 -
H++SO32 -
高中化学
(pH=8)
阳极泥处理后的沉渣中含AgCl
AgCl +2SO32– [Ag(SO3)2]3– + Cl–
[Ag(SO3)2]3– + Cl–
高中化学
[Ag(SO3)2]3– + Cl–
AgCl
AgCl +2SO32–
Ag(SO3)23-将HCHO氧化为CO32-
① 为充分利用资源 , 向浸银残液中通入气体X得到Na2SO3再生液 , X是 SO2。
② 在提取银过程中 , 其他条件不变 , Na2SO3再生液的循环使用次数与银的浸出 率关系如图。 试结合平衡移动原理 ,解释产生这种变化的原因 。
阳极泥
处理后
的沉渣
中含
AgCl
AgCl +2SO32– [Ag(SO3)2]3– + Cl–
高中化学
实验 pH
现象
a 10
产生白色沉淀,稍后溶解,溶液澄清
b 6
产生白色沉淀,一段时间后,沉淀未溶解
c 2
产生大量白色沉淀,一段时间后,产生海绵状棕
黑色物质X
高中化学
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究。 ( 1)测得Na2SO3溶液pH= 10 ,AgNO3溶液pH=5。
(2) 调节pH , 实验记录如下:
感谢同学们收看!
高中化学
