3.2.2 水溶液中的离子平衡专题课件(共17张PPT)
文档属性
| 名称 | 3.2.2 水溶液中的离子平衡专题课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 123.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:52:41 | ||
图片预览





文档简介
(共17张PPT)
水溶液中的离子平衡(二)
高中化学
学习目标
(1) 能从电离、水解、离子反应、化学平衡的角度分析溶液中微粒变
化及其宏观现象, 进 一 步加深对水溶液中离子平衡的理解, 系统构建水溶 液中离子间相互作用与平衡的基本思路;
(2) 通过分析典型事例中电解质溶液的变化,发展“宏观辨识与微观
探析 ”的化学学科核心素养,提升思维能力。
高中化学
水溶液中的离子平衡
Cr2O72- + H2O 2CrO42- + 2H+ 化学平衡
CH3COOH H+ + CH3COO- 弱电解质的电离平衡
CH3COO-+ H2O CH3COOH + OH- 盐类的水解平衡
AgCl(s) Ag+(aq) + Cl-(aq) 难溶电解质的溶解平衡
CH3COO-+ H2O CH3COOH + OH-
Kh= c(O O-)OH) = =5.71×10- 10mol/L
① 醋酸的电离、 醋酸根离子的水解程度均很小;
② 弱酸的电离能力越弱、 弱酸根离子的水解能力越强;
电离能力: HCO3- < H2CO3 水解能力: CO32- > HCO3-
Ka
KW
O
C
3CO
CH3
CH
·c(
c(
H-)
高中化学
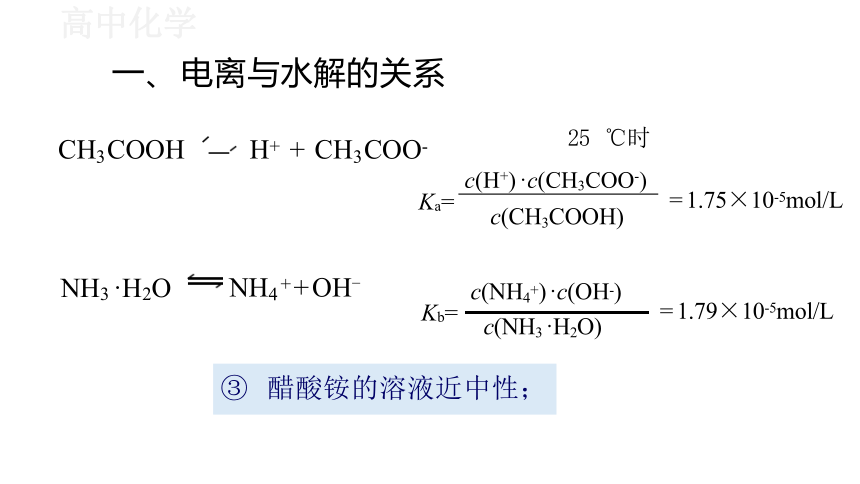
一、 电离与水解的关系
H+ + CH3COO- 25 ℃时
Ka= c( )
-
)
O
CH3COOH
)·c(CH3CO
c
H
= 1.75×10-5mol/L
CH3COOH
CH3COOH H+ + CH3COO-
Ka=
高中化学
一、 电离与水解的关系
25 ℃时
c(H+) ·c(CH3COO-)
c(CH3COOH)
③ 醋酸铵的溶液近中性;
= 1.75×10-5mol/L
= 1.79×10-5mol/L
NH4++OH-
c(NH4+) ·c(OH-)
NH3 ·H2O
c(NH3 ·H2O)
Kb=
高中化学
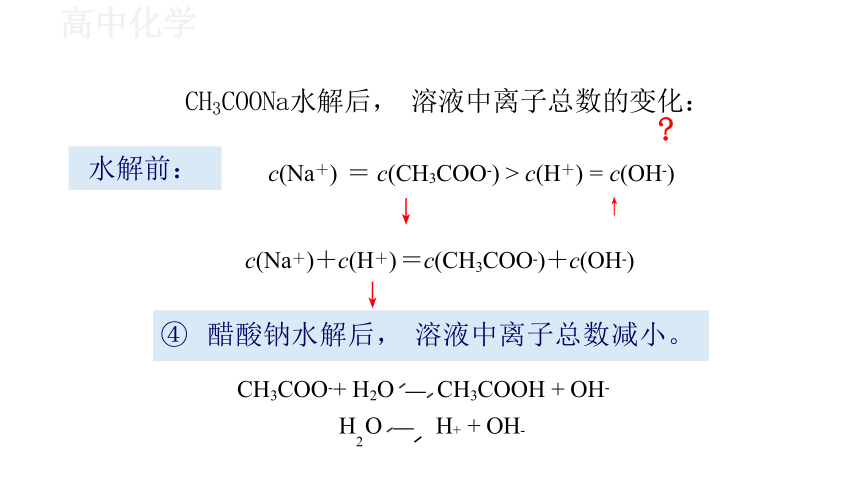
CH3COONa水解后, 溶液中离子总数的变化:
水解前: c(Na+) = c(CH3COO-) > c(H+) = c(OH-)
↓
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
↓
④ 醋酸钠水解后, 溶液中离子总数减小。
CH3COO-+ H2O CH3COOH + OH-
H O H+ + OH-
↓
2
高中化学
经 典 试 题
例1. 浓度均为0. 1 mol ·L - 1 的下列溶液
① NaHSO4 ② H2 SO4 ③ (NH4 )2 SO4 ④ NH4Cl
⑤ NaOH ⑥ NaHCO3 ⑦ Na2CO3 ⑧KCl
⑨ Ba(OH)2, 溶液的pH由小到大的顺序为:
c(H+)
②①③④⑧⑥⑦⑤⑨
例2. 25℃时,物质的量浓度相同的三种盐NaX 、NaY和NaZ的溶液, 若它
们的pH依次为8 、9 、 10, 则HX 、HY 、HZ的酸性由强到弱的顺序是
A. HX 、HZ 、HY B. HZ 、HY 、HX
HX 、HY 、HZ D. HY 、HZ 、HX
解析: 弱酸的酸性越弱, 其酸根离子的水解能力越强, 相同物质
的量浓度的盐溶液的碱性越强,pH越大。
高中化学
经 典 试 题
下列有关说法正确的是( ) 电离能力:HF>H2CO3>HClO
F
2c(CO32-)+c(HCO3-)=0. 1 mol ·L- 1 2c(CO32-)+c(HCO3-) =c(Na+) =0.2 mol ·L- 1
D. 向Na2CO3 溶液中通入少量的HF气体 ,化学方程式为
Na2CO3+2HF = CO2 +H2O+2NaF 酸性 :HF>H2CO3
子总数
3<HCl
离
O
液中
H2C
溶
:
F
力
Na
能
与
电
液
导
溶
的
O
液
、等物质的量浓度的NaCl
度下, 同浓度的三种酸溶
积
温
体
同
等
相
N前<N后 c(Na+)+c(H+) =c(A-)+c(OH-) C. 若将 c(Na+) + c(H+) = c(HCO3-) + 2c(CO32-)+ c(OH-) 液呈中性, 则溶液中:
高中化学
例3. 已知25℃时浓度均为
0. 1 mol ·L- 1 的下列溶液 的pH如右表:
溶质 NaF Na2CO3 NaClO
NaHCO3
pH 8.1 11.6 9.7
8.4
水解能力:CO32- > ClO- > HCO3- > F-
1.某同学在实验室探究NaHCO3 的性质:常温下,配制0. 10 mol ·L-1 NaHCO3
溶液,测得其pH为8.4;取少量该溶液滴加CaCl2 溶液至pH =7 ,滴加过程中 产生白色沉淀,但无气体放出。下列说法不正确的是(B )
A. NaHCO3 溶液呈碱性的原因是 HCO 的水解程度大于电离程度
B. 加入 CaCl2 促进了 HCO 的水解
C. 反应的离子方程式是 2HCO +Ca2+===CaCO3 ↓+H2CO3
D. 反应后的溶液中存在:c(Na+)+2c(Ca2+) =c(HCO )+2c(CO -)+c(Cl-)
+c(H+) +c(OH-)
3
2
3
-
3
-
3
-
3
-
HCO3- + H2 H2CO3 + OH- ① HCO3- CO32- + H+ ②
自 主 训 练
高中化学
2. 已知NaHSO3溶液常温时显酸性 ,溶液中存在以下平衡:
HSO3- + H2 H2 SO3 + OH- ① HSO3- SO32- + H+ ②
向0. 1 mol ·L- 1的NaHSO3溶液中分别加入以下物质 ,下列有关说法正确的是
C
A.加入少量金属 Na , 平衡①左移 , 平衡②右移 , 溶液中 c(HSO )增大
B.加入少量 Na2 SO3 固体 , 则 c(H +)+c(Na +) =c(HSO )+c(OH-)+c(SO -)
c(SO - c(OH -
D.加入氨水至中性 , 则 2c(Na +) =c(SO -)>c(H +)=c(OH-)
3
2
3
2
3
2
3
-
3
-
C.加入少量 NaOH 溶液 , 的值均增大
c(HSO3- 、 c(H+ HSO3- + OH- = SO32-+ H2O
自 主 训 练
高中化学
二、 多因素影响下的水溶液中的离子平衡
例4. 实验测得0.5 mol ·L 1CH3COONa溶液、
0.5 mol ·L 1 CuSO4 溶液以及H2O的pH随温度变化 的曲线如图所示 。 下列说法正确的是
A. 随温度升高, 纯水中c(H+)>c(OH )
B. 随温度升高 ,CH3COONa溶液的c(OH )减小
C. 随温度升高 ,CuSO4 溶液的pH变化是Kw 改变与
水解平衡移动共同作用的结果
D. 随温度升高 ,CH3COONa溶液和CuSO4 溶液的pH均降低, 是因为CH3COO 、Cu2+水解平衡移动方向不同
高中化学
B. 随温度升高, CH3COONa溶液的c(OH )减小 ×
C. 随温度升高, CuSO4 溶液的pH变化是Kw 改变与水解平衡移动共同作用的结果
D. 随温度升高, CH3COONa溶液和CuSO4 溶液的pH均降低, 是因为CH3COO 、
Cu2+水解平衡移动方向不同 ×
高中化学
核心任务:分析溶液中的成分、平衡和条件变化
pH↓= - lg c(H+)
①
②
③
② H2O = H++OH- Kw=c(H+) ·c(OH-)
A. 随温度升高, 纯水中c(H+)>c(OH ) ×
① CH3COO-+H2O= CH3COOH +OH-
③ Cu2++2H2O = Cu (OH)2+2H+
温度 升高
↓
↓
√
高中化学
经 验 总 结
1. 明确体系的粒子组成
2. 分析体系中存在的离子平衡
3. 温度改变, 对盐的水解平衡和水的电离平衡均
有影响, 故溶液pH的改变是Kw 改变与水解平衡
移动共同作用的结果。
①
②
③
实验过程中, 取①④时刻的溶液,加入盐酸酸化的BaCl2 溶液做对比实验,
④产生白色沉淀多 。 下列说法不正确的是(C )
A. Na2 SO3 溶液中存在水解平衡:SO32- +H2O HSO3- + OH- √ B. ④的pH与①不同, 是由于SO32- 浓度减小造成的 √
C. ①→③的过程中, 温度和浓度对水解平衡移动方向的影响 一 致 D. ①与④的Kw值相等 √
时刻 ① ② ③
④
温度/℃ 25 30 40
25
pH 9.52 9.37
高中化学
例5. 测定0. 1 mol ·L- 1Na2 SO3 溶液先升温再降温过程中的pH, 数据如下。
部分SO32- → SO42-
9.25
9.66
对于多因素影响下的平衡移动问题, 关键在于:
1. 分析体系中微粒成分、 性质及存在的平衡;
2. 厘清条件改变对平衡的影响;
3. 对异常现象合理推测 ,搜索证据获取结论。
高中化学
经 验 总 结
例5. 测定0. 1 mol ·L- 1Na2 SO3 溶液先升温再降温过程中的pH, 数据如下。
时刻 ① ② ③
④
温度/℃ 25 30 40
25
pH 9.66 9.52 9.37
9.25
谢谢同学们的收看!
祝同学们学业进步!
高中化学
水溶液中的离子平衡(二)
高中化学
学习目标
(1) 能从电离、水解、离子反应、化学平衡的角度分析溶液中微粒变
化及其宏观现象, 进 一 步加深对水溶液中离子平衡的理解, 系统构建水溶 液中离子间相互作用与平衡的基本思路;
(2) 通过分析典型事例中电解质溶液的变化,发展“宏观辨识与微观
探析 ”的化学学科核心素养,提升思维能力。
高中化学
水溶液中的离子平衡
Cr2O72- + H2O 2CrO42- + 2H+ 化学平衡
CH3COOH H+ + CH3COO- 弱电解质的电离平衡
CH3COO-+ H2O CH3COOH + OH- 盐类的水解平衡
AgCl(s) Ag+(aq) + Cl-(aq) 难溶电解质的溶解平衡
CH3COO-+ H2O CH3COOH + OH-
Kh= c(O O-)OH) = =5.71×10- 10mol/L
① 醋酸的电离、 醋酸根离子的水解程度均很小;
② 弱酸的电离能力越弱、 弱酸根离子的水解能力越强;
电离能力: HCO3- < H2CO3 水解能力: CO32- > HCO3-
Ka
KW
O
C
3CO
CH3
CH
·c(
c(
H-)
高中化学
一、 电离与水解的关系
H+ + CH3COO- 25 ℃时
Ka= c( )
-
)
O
CH3COOH
)·c(CH3CO
c
H
= 1.75×10-5mol/L
CH3COOH
CH3COOH H+ + CH3COO-
Ka=
高中化学
一、 电离与水解的关系
25 ℃时
c(H+) ·c(CH3COO-)
c(CH3COOH)
③ 醋酸铵的溶液近中性;
= 1.75×10-5mol/L
= 1.79×10-5mol/L
NH4++OH-
c(NH4+) ·c(OH-)
NH3 ·H2O
c(NH3 ·H2O)
Kb=
高中化学
CH3COONa水解后, 溶液中离子总数的变化:
水解前: c(Na+) = c(CH3COO-) > c(H+) = c(OH-)
↓
c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
↓
④ 醋酸钠水解后, 溶液中离子总数减小。
CH3COO-+ H2O CH3COOH + OH-
H O H+ + OH-
↓
2
高中化学
经 典 试 题
例1. 浓度均为0. 1 mol ·L - 1 的下列溶液
① NaHSO4 ② H2 SO4 ③ (NH4 )2 SO4 ④ NH4Cl
⑤ NaOH ⑥ NaHCO3 ⑦ Na2CO3 ⑧KCl
⑨ Ba(OH)2, 溶液的pH由小到大的顺序为:
c(H+)
②①③④⑧⑥⑦⑤⑨
例2. 25℃时,物质的量浓度相同的三种盐NaX 、NaY和NaZ的溶液, 若它
们的pH依次为8 、9 、 10, 则HX 、HY 、HZ的酸性由强到弱的顺序是
A. HX 、HZ 、HY B. HZ 、HY 、HX
HX 、HY 、HZ D. HY 、HZ 、HX
解析: 弱酸的酸性越弱, 其酸根离子的水解能力越强, 相同物质
的量浓度的盐溶液的碱性越强,pH越大。
高中化学
经 典 试 题
下列有关说法正确的是( ) 电离能力:HF>H2CO3>HClO
F
2c(CO32-)+c(HCO3-)=0. 1 mol ·L- 1 2c(CO32-)+c(HCO3-) =c(Na+) =0.2 mol ·L- 1
D. 向Na2CO3 溶液中通入少量的HF气体 ,化学方程式为
Na2CO3+2HF = CO2 +H2O+2NaF 酸性 :HF>H2CO3
子总数
3<HCl
离
O
液中
H2C
溶
:
F
力
Na
能
与
电
液
导
溶
的
O
液
、等物质的量浓度的NaCl
度下, 同浓度的三种酸溶
积
温
体
同
等
相
N前<N后 c(Na+)+c(H+) =c(A-)+c(OH-) C. 若将 c(Na+) + c(H+) = c(HCO3-) + 2c(CO32-)+ c(OH-) 液呈中性, 则溶液中:
高中化学
例3. 已知25℃时浓度均为
0. 1 mol ·L- 1 的下列溶液 的pH如右表:
溶质 NaF Na2CO3 NaClO
NaHCO3
pH 8.1 11.6 9.7
8.4
水解能力:CO32- > ClO- > HCO3- > F-
1.某同学在实验室探究NaHCO3 的性质:常温下,配制0. 10 mol ·L-1 NaHCO3
溶液,测得其pH为8.4;取少量该溶液滴加CaCl2 溶液至pH =7 ,滴加过程中 产生白色沉淀,但无气体放出。下列说法不正确的是(B )
A. NaHCO3 溶液呈碱性的原因是 HCO 的水解程度大于电离程度
B. 加入 CaCl2 促进了 HCO 的水解
C. 反应的离子方程式是 2HCO +Ca2+===CaCO3 ↓+H2CO3
D. 反应后的溶液中存在:c(Na+)+2c(Ca2+) =c(HCO )+2c(CO -)+c(Cl-)
+c(H+) +c(OH-)
3
2
3
-
3
-
3
-
3
-
HCO3- + H2 H2CO3 + OH- ① HCO3- CO32- + H+ ②
自 主 训 练
高中化学
2. 已知NaHSO3溶液常温时显酸性 ,溶液中存在以下平衡:
HSO3- + H2 H2 SO3 + OH- ① HSO3- SO32- + H+ ②
向0. 1 mol ·L- 1的NaHSO3溶液中分别加入以下物质 ,下列有关说法正确的是
C
A.加入少量金属 Na , 平衡①左移 , 平衡②右移 , 溶液中 c(HSO )增大
B.加入少量 Na2 SO3 固体 , 则 c(H +)+c(Na +) =c(HSO )+c(OH-)+c(SO -)
c(SO - c(OH -
D.加入氨水至中性 , 则 2c(Na +) =c(SO -)>c(H +)=c(OH-)
3
2
3
2
3
2
3
-
3
-
C.加入少量 NaOH 溶液 , 的值均增大
c(HSO3- 、 c(H+ HSO3- + OH- = SO32-+ H2O
自 主 训 练
高中化学
二、 多因素影响下的水溶液中的离子平衡
例4. 实验测得0.5 mol ·L 1CH3COONa溶液、
0.5 mol ·L 1 CuSO4 溶液以及H2O的pH随温度变化 的曲线如图所示 。 下列说法正确的是
A. 随温度升高, 纯水中c(H+)>c(OH )
B. 随温度升高 ,CH3COONa溶液的c(OH )减小
C. 随温度升高 ,CuSO4 溶液的pH变化是Kw 改变与
水解平衡移动共同作用的结果
D. 随温度升高 ,CH3COONa溶液和CuSO4 溶液的pH均降低, 是因为CH3COO 、Cu2+水解平衡移动方向不同
高中化学
B. 随温度升高, CH3COONa溶液的c(OH )减小 ×
C. 随温度升高, CuSO4 溶液的pH变化是Kw 改变与水解平衡移动共同作用的结果
D. 随温度升高, CH3COONa溶液和CuSO4 溶液的pH均降低, 是因为CH3COO 、
Cu2+水解平衡移动方向不同 ×
高中化学
核心任务:分析溶液中的成分、平衡和条件变化
pH↓= - lg c(H+)
①
②
③
② H2O = H++OH- Kw=c(H+) ·c(OH-)
A. 随温度升高, 纯水中c(H+)>c(OH ) ×
① CH3COO-+H2O= CH3COOH +OH-
③ Cu2++2H2O = Cu (OH)2+2H+
温度 升高
↓
↓
√
高中化学
经 验 总 结
1. 明确体系的粒子组成
2. 分析体系中存在的离子平衡
3. 温度改变, 对盐的水解平衡和水的电离平衡均
有影响, 故溶液pH的改变是Kw 改变与水解平衡
移动共同作用的结果。
①
②
③
实验过程中, 取①④时刻的溶液,加入盐酸酸化的BaCl2 溶液做对比实验,
④产生白色沉淀多 。 下列说法不正确的是(C )
A. Na2 SO3 溶液中存在水解平衡:SO32- +H2O HSO3- + OH- √ B. ④的pH与①不同, 是由于SO32- 浓度减小造成的 √
C. ①→③的过程中, 温度和浓度对水解平衡移动方向的影响 一 致 D. ①与④的Kw值相等 √
时刻 ① ② ③
④
温度/℃ 25 30 40
25
pH 9.52 9.37
高中化学
例5. 测定0. 1 mol ·L- 1Na2 SO3 溶液先升温再降温过程中的pH, 数据如下。
部分SO32- → SO42-
9.25
9.66
对于多因素影响下的平衡移动问题, 关键在于:
1. 分析体系中微粒成分、 性质及存在的平衡;
2. 厘清条件改变对平衡的影响;
3. 对异常现象合理推测 ,搜索证据获取结论。
高中化学
经 验 总 结
例5. 测定0. 1 mol ·L- 1Na2 SO3 溶液先升温再降温过程中的pH, 数据如下。
时刻 ① ② ③
④
温度/℃ 25 30 40
25
pH 9.66 9.52 9.37
9.25
谢谢同学们的收看!
祝同学们学业进步!
高中化学
