水溶液中的平衡习题课课件(共14张PPT)
文档属性
| 名称 | 水溶液中的平衡习题课课件(共14张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 795.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:53:42 | ||
图片预览





文档简介
(共14张PPT)
水溶液中的平衡习题课
高中化学
学习目标
1.通过对典型例题的研究,进一步加深对水溶液中平衡的理解, 系统构建水溶液中离子间相互作用与平衡的基本思路。
2.能从电离、水解、离子反应、化学平衡的角度分析溶液中微 粒变化及其宏观现象。
3.通过分析和解决生产、生活中有关电解质溶液的实际问题,发 展 “宏观辨识与微观探析 ”的化学学科核心素养,提升系统思 维能力。
高中化学
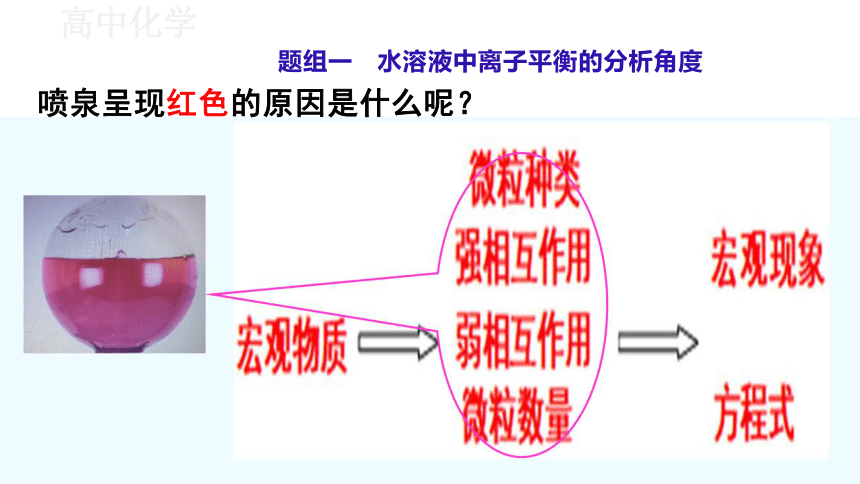
题组一 水溶液中离子平衡的分析角度
喷泉呈现红色的原因是什么呢?
Mg + 2H+=Mg2++ H2 ↑
H2O H+ + OH-
微粒—强弱作用—平衡和反应—现象
高中化学
(1)当溶液是单一的盐(CH3COONa)溶液并呈碱性时的情
形:守恒关系:(物料守恒)c(CH3COO-)+c(CH3COOH) = c(Na+);(质子守恒)c(OH-) =c(CH3COOH)+c(H+);(电 荷守恒)c(CH3COO-)+c(OH-) =c(Na+)+c(H+) 。大小关 系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
高中化学
【典例 1】 常温下,将a L 0.1 mol · L-1的NaOH溶液与b L 0.1 mol · L- 1 的CH3COOH溶液混合。下列有关混合溶液的说法一定不正确是( ) A .ac(Na+)>c(H+)>c(OH-)
B .a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C .a =b时,c(CH3COOH)+c(H+) =c(OH-)
(2)当溶液呈中性,溶质是CH3COONa和CH3COOH的混
合情形,相当于CH3COONa没水解。守恒关系:(物料 守恒)c(CH3COO-) =c(Na+);(质子守恒)c(OH-) =c(H+)。 大小关系:c(Na+) =c(CH3COO-)>c(OH-) =c(H+)。
(3)当溶液呈酸性,相当于在CH3COONa和
CH3COOH的混合溶液呈中性的基础上加入了 醋酸,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
高中化学
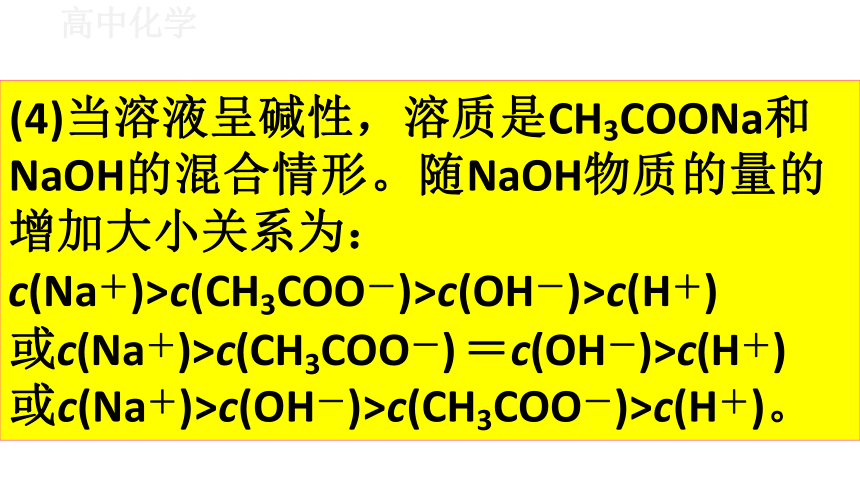
(4)当溶液呈碱性,溶质是CH3COONa和 NaOH的混合情形。随NaOH物质的量的 增加大小关系为:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
或c(Na+)>c(CH3COO-) =c(OH-)>c(H+) 或c(Na+)>c(OH-)>c(CH3COO-)>c(H+)。
高中化学
高中化学
【典例 1】 常温下,将a L 0.1 mol · L-1的NaOH溶液与b L 0.1
mol · L-1的CH3COOH溶液混合。下列有关混合溶液的说法一定不
正确是( ) B
A .ac(Na+)>c(H+)>c(OH-)
B .a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C .a =b时,c(CH3COOH)+c(H+) =c(OH-)
D .无论a、b有何关系,均有c(H+)+c(Na+) =c(CH3COO-)+ c(OH-)
先强后弱:找到思维起点
下列说法不正确的是
A .Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH- B .对比Ⅰ 、Ⅲ , 说明Na2CO3溶液能破坏铝表面的保护膜
C .推测出现白色浑浊的原因:AlO2- + HCO3- + H2O =Al(OH)3 ↓+ CO32- D .加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
CO32-+H2O HCO3-+OH-
HCO3-+H2O H2CO3 CO2 ↑ +H2O
2Al+2H2O+2OH-=2AlO2-+3H2 ↑ AlO2-+ HCO3-+H2O=Al(OH)3 ↓ + CO32-
高中化学
典例2.探究铝片与Na2CO3溶 液的反应。
D
高中化学
题组二 滴定曲线类问题
典例3.用一定浓度NaOH溶液滴定某醋酸溶液。滴定终点附近溶液pH和 导电能力的变化如下图所示(利用溶液导电能力的变化可判断滴定终点:
溶液总体积变化忽略不计);下列说法不正确的是( )
d点 和完全
V
H-
:
O
根据溶液pH和导电能力的变化可判断
c→d溶液导电性增强的主要原因是c(
.
.
D
C
A. a点对应的溶液中:c(CH3COO-)=c(Na+) B. a →b过程中,n(CH3COO-)不断增大
按图索骥:锁
c
Ka1 Ka2
C .pH =2.7 时,c(HA-)>c(H2A) =c(A2 -)
D .pH =4.2 时,c(HA-) =c(A2-) =c(H+)
【典例 4】改变 0.1 mol ·L-1 二元弱酸 H2A 溶液的 pH ,溶液中的 H2A、HA-、A2- 的物
质的量分数 δ(X)随 pH 的变化如图所示,已知:δ(X) = 。下列
叙述错误的是( )
A .pH =1.2 时,c(H2A) =c(HA ) D B .lg[K2(H2A)] =-4.2
-
常数交叉:巧妙应用信息
题组三 分布系数与pH的关系问题
高中化学
高中化学
题组四 pH与对数的关系问题
【典例 5】浓度均为 0.10 mol ·L-1 、体积均为 V0 的 MOH 和 ROH 溶液,分别加水
稀释至体积 V,pH 随 lg 的变化如图所示。下列叙述错误的是( ) pH=-lgc(H+)
A .MOH 的碱性强于 ROH 的碱性 D
B .ROH 的电离程度:b 点大于 a 点
C .若两溶液无限稀释,则它们的 c(OH-)相等
D .当 lg =2 时,若两溶液同时升高温度,则 增大
原型拓展 :定量理解电离水解
原型拓展 :定量理解电离水解
按图索骥:锁定中性中和点
先强后弱:找到思维起点
常数交叉:巧妙应用信息
高中化学
课堂小结
感谢同学们收看!
高中化学
水溶液中的平衡习题课
高中化学
学习目标
1.通过对典型例题的研究,进一步加深对水溶液中平衡的理解, 系统构建水溶液中离子间相互作用与平衡的基本思路。
2.能从电离、水解、离子反应、化学平衡的角度分析溶液中微 粒变化及其宏观现象。
3.通过分析和解决生产、生活中有关电解质溶液的实际问题,发 展 “宏观辨识与微观探析 ”的化学学科核心素养,提升系统思 维能力。
高中化学
题组一 水溶液中离子平衡的分析角度
喷泉呈现红色的原因是什么呢?
Mg + 2H+=Mg2++ H2 ↑
H2O H+ + OH-
微粒—强弱作用—平衡和反应—现象
高中化学
(1)当溶液是单一的盐(CH3COONa)溶液并呈碱性时的情
形:守恒关系:(物料守恒)c(CH3COO-)+c(CH3COOH) = c(Na+);(质子守恒)c(OH-) =c(CH3COOH)+c(H+);(电 荷守恒)c(CH3COO-)+c(OH-) =c(Na+)+c(H+) 。大小关 系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
高中化学
【典例 1】 常温下,将a L 0.1 mol · L-1的NaOH溶液与b L 0.1 mol · L- 1 的CH3COOH溶液混合。下列有关混合溶液的说法一定不正确是( ) A .a
B .a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C .a =b时,c(CH3COOH)+c(H+) =c(OH-)
(2)当溶液呈中性,溶质是CH3COONa和CH3COOH的混
合情形,相当于CH3COONa没水解。守恒关系:(物料 守恒)c(CH3COO-) =c(Na+);(质子守恒)c(OH-) =c(H+)。 大小关系:c(Na+) =c(CH3COO-)>c(OH-) =c(H+)。
(3)当溶液呈酸性,相当于在CH3COONa和
CH3COOH的混合溶液呈中性的基础上加入了 醋酸,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
高中化学
(4)当溶液呈碱性,溶质是CH3COONa和 NaOH的混合情形。随NaOH物质的量的 增加大小关系为:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
或c(Na+)>c(CH3COO-) =c(OH-)>c(H+) 或c(Na+)>c(OH-)>c(CH3COO-)>c(H+)。
高中化学
高中化学
【典例 1】 常温下,将a L 0.1 mol · L-1的NaOH溶液与b L 0.1
mol · L-1的CH3COOH溶液混合。下列有关混合溶液的说法一定不
正确是( ) B
A .a
B .a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C .a =b时,c(CH3COOH)+c(H+) =c(OH-)
D .无论a、b有何关系,均有c(H+)+c(Na+) =c(CH3COO-)+ c(OH-)
先强后弱:找到思维起点
下列说法不正确的是
A .Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH- B .对比Ⅰ 、Ⅲ , 说明Na2CO3溶液能破坏铝表面的保护膜
C .推测出现白色浑浊的原因:AlO2- + HCO3- + H2O =Al(OH)3 ↓+ CO32- D .加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
CO32-+H2O HCO3-+OH-
HCO3-+H2O H2CO3 CO2 ↑ +H2O
2Al+2H2O+2OH-=2AlO2-+3H2 ↑ AlO2-+ HCO3-+H2O=Al(OH)3 ↓ + CO32-
高中化学
典例2.探究铝片与Na2CO3溶 液的反应。
D
高中化学
题组二 滴定曲线类问题
典例3.用一定浓度NaOH溶液滴定某醋酸溶液。滴定终点附近溶液pH和 导电能力的变化如下图所示(利用溶液导电能力的变化可判断滴定终点:
溶液总体积变化忽略不计);下列说法不正确的是( )
d点 和完全
V
H-
:
O
根据溶液pH和导电能力的变化可判断
c→d溶液导电性增强的主要原因是c(
.
.
D
C
A. a点对应的溶液中:c(CH3COO-)=c(Na+) B. a →b过程中,n(CH3COO-)不断增大
按图索骥:锁
c
Ka1 Ka2
C .pH =2.7 时,c(HA-)>c(H2A) =c(A2 -)
D .pH =4.2 时,c(HA-) =c(A2-) =c(H+)
【典例 4】改变 0.1 mol ·L-1 二元弱酸 H2A 溶液的 pH ,溶液中的 H2A、HA-、A2- 的物
质的量分数 δ(X)随 pH 的变化如图所示,已知:δ(X) = 。下列
叙述错误的是( )
A .pH =1.2 时,c(H2A) =c(HA ) D B .lg[K2(H2A)] =-4.2
-
常数交叉:巧妙应用信息
题组三 分布系数与pH的关系问题
高中化学
高中化学
题组四 pH与对数的关系问题
【典例 5】浓度均为 0.10 mol ·L-1 、体积均为 V0 的 MOH 和 ROH 溶液,分别加水
稀释至体积 V,pH 随 lg 的变化如图所示。下列叙述错误的是( ) pH=-lgc(H+)
A .MOH 的碱性强于 ROH 的碱性 D
B .ROH 的电离程度:b 点大于 a 点
C .若两溶液无限稀释,则它们的 c(OH-)相等
D .当 lg =2 时,若两溶液同时升高温度,则 增大
原型拓展 :定量理解电离水解
原型拓展 :定量理解电离水解
按图索骥:锁定中性中和点
先强后弱:找到思维起点
常数交叉:巧妙应用信息
高中化学
课堂小结
感谢同学们收看!
高中化学
