3.2.1 水溶液中的离子平衡专题课件(21张PPT)
文档属性
| 名称 | 3.2.1 水溶液中的离子平衡专题课件(21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 256.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:55:05 | ||
图片预览








文档简介
(共21张PPT)
水溶液中的离子平衡专题(一)
高中化学
学习任务与目标
1.从电离 、 水解的方面认识水溶液中的离子行为与浓度平衡, 能够多角
度动态的分析水溶液中的离子平衡, 提升变化观念与平衡思想;
2.通过对溶液中各微粒的种类和浓度进行定性和定量的分析, 学会分析
溶液中的主要微粒以及溶液酸碱性判断和pH计算, 建立宏观微观相结 合的分析问题的视角;
3.通过对实际过程的分析, 学会综合运用离子反应和化学平衡的方法分
析和解决生活生产中有关电解质溶液的实际问题, 体会学科的有用性。
高中化学
一、 熟悉两大理论 , 构建思维基点
1.电离理论
(1)弱电解质的电离是微弱的, 电离产生的微粒都非常少, 同时还要考虑水的电离。
1- 1- 1. 氨水中:NH3 ·H2O 、NH4+ 、 OH- 浓度的大小关系:
NH3 ·H2O 、 NH4+ + OH- 电离程度小, 未电离的NH3 ·H2O占多数
H2 H + + OH-
c(NH3 ·H2O) >c(OH-) >c(NH4+)
高中化学
一、 熟悉两大理论 , 构建思维基点
1.电离理论
(2)多元弱酸的电离是分步进行的, 其主要是第 一 步电离。
1- 1-2.在H2 S溶液中: H2 S 、 HS- 、 S2 - 、 H + 的浓度大小关系
H2 S HS- + H+
HS- 、 S2 - + H+
c(H2 S)>c(H+)> c(HS-)>c(S2 -)
高中化学
一、 熟悉两大理论 , 构建思维基点
2.水解理论
(1)弱电解质离子的水解损失是微量的(双水解除外), 但由于水的电离, 故水解后酸
性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质的浓度
1-2- 1.NH4Cl溶液中:NH4+ 、 Cl- 、NH3 ·H2O 、 H + 的浓度大小关系
NH4+ +H2O 、 NH3 ·H2O+H+
c(Cl-)>c(NH4+)>c(H+)>c(NH3 ·H2O)
高中化学
一、 熟悉两大理论 , 构建思维基点
2.水解理论
(2)多元弱酸酸根离子的水解是分步进行的, 其主要是第 一 步水解。
1-2-2.在Na2CO3 溶液中: CO32 - 、 HCO3 - 、 H2CO3 的浓度大小关系
c(CO32 -)>c(HCO3 -)>c(H2CO3)
高中化学
二、 把握三种守恒 , 明确等量关系
1.电荷守恒规律
电解质溶液中, 无论存在多少种离子, 溶液都是呈电中性, 即阴离子所带负电荷总 数 一 定等于阳离子所带正电荷总数。
2- 1.NaHCO3 溶液中
c(Na+)+c(H+)=c(HCO3 -)+c(OH-)+2c(CO32 -)
高中化学
二、 把握三种守恒 , 明确等量关系
2.物料守恒规律
电解质溶液中, 由于某些离子能够水解, 离子种类增多, 但元素总是守恒的。
2-2.在Na2CO3 溶液中 c(Na+)=2[c(CO32 -)+c(HCO3 -)+c(H2CO3)]
高中化学
二、 把握三种守恒 , 明确等量关系
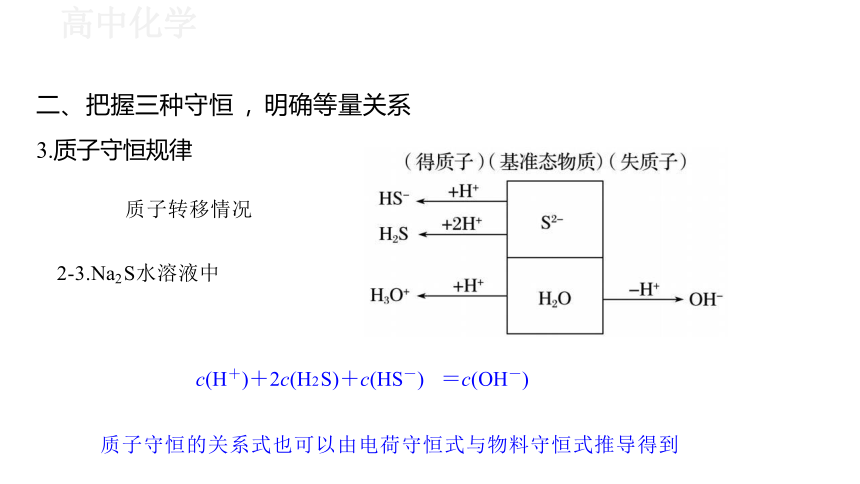
3.质子守恒规律
质子转移情况
2-3.Na2 S水溶液中
质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到
c(H+)+2c(H2 S)+c(HS-) =c(OH-)
1.水的离子积
Kw=c(H+)总 ·c(OH-)总
2.弱电解质的电离平衡常数
CH3COOH 、 CH3COO- + H +
高中化学
三、 熟记两个常数 , 建立思维模型
K = c(CH3COO ) ×c(H ) a c(CH3COOH)
+
-
4- 1- 1. 0. 1 mol/L的NH4Cl溶液
(1)粒子种类: 4 3 2 2 。
(2)离子浓度大小关系: c(Cl-)>c(NH4 +)>c(H+)>c(OH -) 。
(3)物料守恒: c(Cl -)=c(NH4 +)+c(NH3 ·H2O) 。
高中化学
四、 典型例题
1.单一溶液中离子浓度的关系
NH4Cl===NH4 ++Cl-(完全电离)
NH4 ++H2O 、 NH3 ·H2O+H+(微弱) H2 H ++OH-(极微弱)
Cl- 、NH + 、 H + 、 OH- 、NH ·H O 、 H O
(1)大小关系: c(Na +)>c(CO32 -)>c(OH -)>c(HCO3 -)>c(H+) 。
(2)物料守恒: c(Na +) =2[c(CO32 -) +c(HCO3 -)+c(H2CO3)] 。
(3)电荷守恒: c(Na +)+c(H+) =c(HCO3 -) +c(OH -) +2c(CO32 -) 。
(4)质子守恒: c(OH -)=c(H +)+2c(H2CO3) +c(HCO3 -) 。
Na2CO3===2Na++CO32 -(完全电离),
CO32 -+H2O HCO3 -+OH-(主要), HCO3 -+H2 H2CO3+OH-(次要), H2 H ++OH-(极微弱)。
4- 1-2. 0. 1 mol/L的Na2CO3 溶液中各离子浓度的关系
高中化学
(1)大小关系:c(Na +)>c(H CO3 -)>c(OH -)>c(H +)>c(CO32 -) 。 (2)物料守恒:c(Na +) =c(HCO3 -) +c(CO32 -)+c(H2CO3) 。 (3)电荷守恒:c(Na +)+c(H+) =c(OH -) +2c(CO32 -) +c(OH-) 。 (4)质子守恒:c(OH -)+c(CO32 -) =c(H2CO3) +c(H+) 。
NaHCO3===Na++HCO3 -(完全电离),
HCO3 -+H2O 2CO3+OH-(主要),
HCO3 H ++CO32 -(次要),
H2 H ++OH-(极微弱)。
高中化学
4- 1-3. 0. 1 mol/L 的NaHCO3 溶液中各离子浓度的关系
酸式盐溶液的酸碱性主要取决于
酸式盐中酸式酸根离子的电离能力和水解能力哪 一 个更强
高中化学
四、 典型例题
2.酸、碱中和型离子浓度的关系
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合, 离子浓度大小顺序为
。
___________________________________________
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7
①离子浓度大小顺序为 。
②电荷守恒式: 。
③物料守恒式: 。
(3)pH=2的CH3COOH与pH= 12的NaOH等体积混合, 离子浓度大小顺序为
。
______________________________________
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合, 离子浓度大小顺序为
c(Na +)>c(CH3COO -)>c(OH-)>c(H+) 。
NaOH + CH3COOH === CH3COONa + H2O
恰好中和:
单 一CH3COONa溶液
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7
①离子浓度大小顺序为 c(CH3COO -)>c(Na +)>c(H +)>c(OH-) 。
CH3COOH剩余: 等浓度的CH3COOH和CH3COONa混合溶液
CH3COO-+H2 CH3COOH+OH-
CH3 H ++CH3COO-
②电荷守恒式: c(CH3COO-)+c(OH -) =c(Na+) +c(H+) 。
③物料守恒式: 2c(Na+)=c(CH3COO -) +c(CH3COOH) 。
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(3)pH=2的CH3COOH与pH= 12的NaOH等体积混合, 离子浓度大小顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
。
______________________________________
混合后溶液:
大量CH3COOH和少量CH3COONa混合液
未电离的
CH3COOH
+ === CH3COONa + H2O
CH3COO- H+
Na+
OH-
H ++CH3COO-
A. 点①所示溶液中:c(CH3COOH)+2c(H+) =c(CH3COO-)+2c(OH-)
×
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) 0.002 mol CH3COONa B. 点②所示溶液中:电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
×
c(Na+)=c(CH3COOH)+c(CH3COO-) 0.001 mol CH3COOH
C. 点③所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(H+)=c(OH-)
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
高中化学
4-2-2. 常温下 , 用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH
D. 滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
溶液所得滴定曲线如下图。 下列说法正确的是( D )
0.001 mol CH3COONa
×
D
高中化学
四、 典型例题
3.不同溶液中同一离子浓度的大小比较
4-3. 25 ℃时 , 相同物质的量浓度的下列溶液中:
①NH4Cl 、 ②CH3COONH4 、 ③NH4HSO4 、 ④(NH4)2SO4 、 ⑤(NH4)2Fe(SO4)2,
c(NH4﹢)由大到小 ⑤ > ④ >③ > ① > ②
感谢同学们的收看,
祝同学们学业进步!
高中化学
水溶液中的离子平衡专题(一)
高中化学
学习任务与目标
1.从电离 、 水解的方面认识水溶液中的离子行为与浓度平衡, 能够多角
度动态的分析水溶液中的离子平衡, 提升变化观念与平衡思想;
2.通过对溶液中各微粒的种类和浓度进行定性和定量的分析, 学会分析
溶液中的主要微粒以及溶液酸碱性判断和pH计算, 建立宏观微观相结 合的分析问题的视角;
3.通过对实际过程的分析, 学会综合运用离子反应和化学平衡的方法分
析和解决生活生产中有关电解质溶液的实际问题, 体会学科的有用性。
高中化学
一、 熟悉两大理论 , 构建思维基点
1.电离理论
(1)弱电解质的电离是微弱的, 电离产生的微粒都非常少, 同时还要考虑水的电离。
1- 1- 1. 氨水中:NH3 ·H2O 、NH4+ 、 OH- 浓度的大小关系:
NH3 ·H2O 、 NH4+ + OH- 电离程度小, 未电离的NH3 ·H2O占多数
H2 H + + OH-
c(NH3 ·H2O) >c(OH-) >c(NH4+)
高中化学
一、 熟悉两大理论 , 构建思维基点
1.电离理论
(2)多元弱酸的电离是分步进行的, 其主要是第 一 步电离。
1- 1-2.在H2 S溶液中: H2 S 、 HS- 、 S2 - 、 H + 的浓度大小关系
H2 S HS- + H+
HS- 、 S2 - + H+
c(H2 S)>c(H+)> c(HS-)>c(S2 -)
高中化学
一、 熟悉两大理论 , 构建思维基点
2.水解理论
(1)弱电解质离子的水解损失是微量的(双水解除外), 但由于水的电离, 故水解后酸
性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质的浓度
1-2- 1.NH4Cl溶液中:NH4+ 、 Cl- 、NH3 ·H2O 、 H + 的浓度大小关系
NH4+ +H2O 、 NH3 ·H2O+H+
c(Cl-)>c(NH4+)>c(H+)>c(NH3 ·H2O)
高中化学
一、 熟悉两大理论 , 构建思维基点
2.水解理论
(2)多元弱酸酸根离子的水解是分步进行的, 其主要是第 一 步水解。
1-2-2.在Na2CO3 溶液中: CO32 - 、 HCO3 - 、 H2CO3 的浓度大小关系
c(CO32 -)>c(HCO3 -)>c(H2CO3)
高中化学
二、 把握三种守恒 , 明确等量关系
1.电荷守恒规律
电解质溶液中, 无论存在多少种离子, 溶液都是呈电中性, 即阴离子所带负电荷总 数 一 定等于阳离子所带正电荷总数。
2- 1.NaHCO3 溶液中
c(Na+)+c(H+)=c(HCO3 -)+c(OH-)+2c(CO32 -)
高中化学
二、 把握三种守恒 , 明确等量关系
2.物料守恒规律
电解质溶液中, 由于某些离子能够水解, 离子种类增多, 但元素总是守恒的。
2-2.在Na2CO3 溶液中 c(Na+)=2[c(CO32 -)+c(HCO3 -)+c(H2CO3)]
高中化学
二、 把握三种守恒 , 明确等量关系
3.质子守恒规律
质子转移情况
2-3.Na2 S水溶液中
质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到
c(H+)+2c(H2 S)+c(HS-) =c(OH-)
1.水的离子积
Kw=c(H+)总 ·c(OH-)总
2.弱电解质的电离平衡常数
CH3COOH 、 CH3COO- + H +
高中化学
三、 熟记两个常数 , 建立思维模型
K = c(CH3COO ) ×c(H ) a c(CH3COOH)
+
-
4- 1- 1. 0. 1 mol/L的NH4Cl溶液
(1)粒子种类: 4 3 2 2 。
(2)离子浓度大小关系: c(Cl-)>c(NH4 +)>c(H+)>c(OH -) 。
(3)物料守恒: c(Cl -)=c(NH4 +)+c(NH3 ·H2O) 。
高中化学
四、 典型例题
1.单一溶液中离子浓度的关系
NH4Cl===NH4 ++Cl-(完全电离)
NH4 ++H2O 、 NH3 ·H2O+H+(微弱) H2 H ++OH-(极微弱)
Cl- 、NH + 、 H + 、 OH- 、NH ·H O 、 H O
(1)大小关系: c(Na +)>c(CO32 -)>c(OH -)>c(HCO3 -)>c(H+) 。
(2)物料守恒: c(Na +) =2[c(CO32 -) +c(HCO3 -)+c(H2CO3)] 。
(3)电荷守恒: c(Na +)+c(H+) =c(HCO3 -) +c(OH -) +2c(CO32 -) 。
(4)质子守恒: c(OH -)=c(H +)+2c(H2CO3) +c(HCO3 -) 。
Na2CO3===2Na++CO32 -(完全电离),
CO32 -+H2O HCO3 -+OH-(主要), HCO3 -+H2 H2CO3+OH-(次要), H2 H ++OH-(极微弱)。
4- 1-2. 0. 1 mol/L的Na2CO3 溶液中各离子浓度的关系
高中化学
(1)大小关系:c(Na +)>c(H CO3 -)>c(OH -)>c(H +)>c(CO32 -) 。 (2)物料守恒:c(Na +) =c(HCO3 -) +c(CO32 -)+c(H2CO3) 。 (3)电荷守恒:c(Na +)+c(H+) =c(OH -) +2c(CO32 -) +c(OH-) 。 (4)质子守恒:c(OH -)+c(CO32 -) =c(H2CO3) +c(H+) 。
NaHCO3===Na++HCO3 -(完全电离),
HCO3 -+H2O 2CO3+OH-(主要),
HCO3 H ++CO32 -(次要),
H2 H ++OH-(极微弱)。
高中化学
4- 1-3. 0. 1 mol/L 的NaHCO3 溶液中各离子浓度的关系
酸式盐溶液的酸碱性主要取决于
酸式盐中酸式酸根离子的电离能力和水解能力哪 一 个更强
高中化学
四、 典型例题
2.酸、碱中和型离子浓度的关系
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合, 离子浓度大小顺序为
。
___________________________________________
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7
①离子浓度大小顺序为 。
②电荷守恒式: 。
③物料守恒式: 。
(3)pH=2的CH3COOH与pH= 12的NaOH等体积混合, 离子浓度大小顺序为
。
______________________________________
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合, 离子浓度大小顺序为
c(Na +)>c(CH3COO -)>c(OH-)>c(H+) 。
NaOH + CH3COOH === CH3COONa + H2O
恰好中和:
单 一CH3COONa溶液
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(2)NaOH和CH3COOH等浓度按1∶2体积比混合后pH<7
①离子浓度大小顺序为 c(CH3COO -)>c(Na +)>c(H +)>c(OH-) 。
CH3COOH剩余: 等浓度的CH3COOH和CH3COONa混合溶液
CH3COO-+H2 CH3COOH+OH-
CH3 H ++CH3COO-
②电荷守恒式: c(CH3COO-)+c(OH -) =c(Na+) +c(H+) 。
③物料守恒式: 2c(Na+)=c(CH3COO -) +c(CH3COOH) 。
高中化学
4-2-1.常温下 , 比较下列几种溶液混合后各离子浓度的大小。
(3)pH=2的CH3COOH与pH= 12的NaOH等体积混合, 离子浓度大小顺序为
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
。
______________________________________
混合后溶液:
大量CH3COOH和少量CH3COONa混合液
未电离的
CH3COOH
+ === CH3COONa + H2O
CH3COO- H+
Na+
OH-
H ++CH3COO-
A. 点①所示溶液中:c(CH3COOH)+2c(H+) =c(CH3COO-)+2c(OH-)
×
c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) 0.002 mol CH3COONa B. 点②所示溶液中:电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
×
c(Na+)=c(CH3COOH)+c(CH3COO-) 0.001 mol CH3COOH
C. 点③所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(H+)=c(OH-)
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
高中化学
4-2-2. 常温下 , 用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH
D. 滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
溶液所得滴定曲线如下图。 下列说法正确的是( D )
0.001 mol CH3COONa
×
D
高中化学
四、 典型例题
3.不同溶液中同一离子浓度的大小比较
4-3. 25 ℃时 , 相同物质的量浓度的下列溶液中:
①NH4Cl 、 ②CH3COONH4 、 ③NH4HSO4 、 ④(NH4)2SO4 、 ⑤(NH4)2Fe(SO4)2,
c(NH4﹢)由大到小 ⑤ > ④ >③ > ① > ②
感谢同学们的收看,
祝同学们学业进步!
高中化学
