酸碱中和滴定图像分析课件(共16张PPT)
文档属性
| 名称 | 酸碱中和滴定图像分析课件(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 343.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:56:05 | ||
图片预览






文档简介
(共16张PPT)
酸碱中和滴定图像分析
高中化学
学习目标
(1 ) 通过对不同情况下酸碱混合后溶液中的离子浓度关系
分析, 能从宏观和微观相结合的视角分析与解决实际问题, 能 有效提取出事物的主要矛盾;
(2 ) 通过对氢氧化钠溶液滴定醋酸溶液的过程分析, 体会
和总结酸碱中和滴定的图像类试题的分析方法和步骤;
(3 ) 通过对比氢氧化钠溶液分别滴定 一 定浓度的盐酸 、 醋
酸时滴定曲线的差异, 进 一 步强化对强弱电解质的认知, 以及 对比方法在化学学习中的重要性。
高中化学
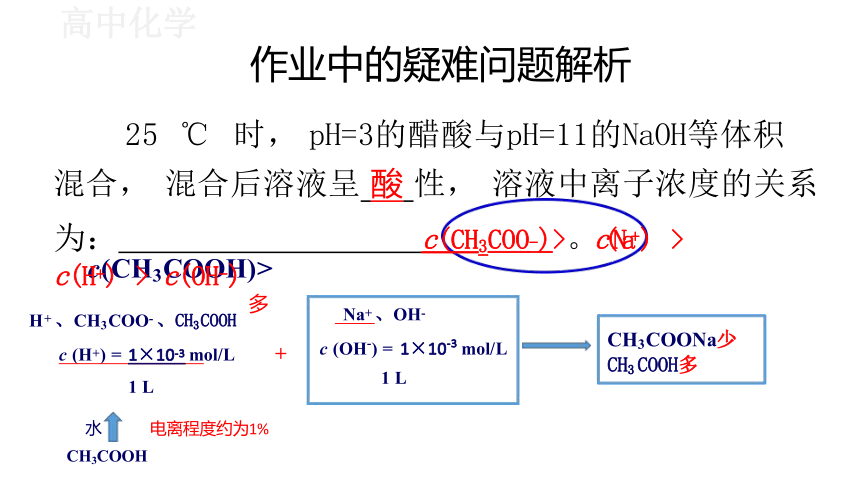
作业中的疑难问题解析
25 ℃ 时, pH=3的醋酸与pH=11的NaOH等体积
混合, 混合后溶液呈 酸 性, 溶液中离子浓度的关系
c(CH3COOH)>
为: c(CH3COO-)>。c(Na+) > c(H+) > c(OH-)
Na+ 、OH-
c (OH-) = 1×10-3 mol/L
1 L
多
H+ 、CH3COO- 、CH3COOH
c (H+) = 1×10-3 mol/L
1 L
CH3COONa少 CH3COOH多
电离程度约为1%
CH3COOH
+
水
高中化学
醋酸与氢氧化钠溶液的混合问题
1. 25 ℃ 时, 将浓度均为0.2 mol/L醋酸与NaOH溶液等体积 混合, 所得溶液的溶质为 CH3COONa, 溶液呈 碱 性, 混合后溶 液中各种离子浓度的大小关系为 c(Na+)>c(C。H3COO-) > c(OH-) > c(H+)
2. 25 ℃ 时 ,pH=3的醋酸与pH=11NaOH等体积混合, 所得 溶液的溶质为 CH3COOH和CH3COONa , 混合后溶液呈 酸 性, 溶
液中各种离子浓度的关系为: 。
c(CH3COO-)> c(Na+) > c(H+) > c(OH-)
高中化学
醋酸与氢氧化钠溶液的混合问题
3. 25 ℃时, 若醋酸溶液与NaOH溶液等体积混
合, 若混合后溶液成中性, 则混合前:
c(醋酸) > c(NaOH) , c(H+)酸< c(OH-)碱
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶液中离子浓度大小关系:
1. 弄清 “谁滴谁” ,看曲线的变化趋势;
2. 抓住关键点,依据用量分析溶液组成;
起点后的溶液:c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶液中离子浓度大小关系:
(1)起点: pH ≈ 3 部分电离
溶质:CH3COOH
主要微粒: CH3COOH分子
离子浓度关系: c(H+) =c(CH3COO-)+c(OH-)
c(H+) >c(CH3COO-)>c(OH-)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释
曲线上几个关键点所对应的溶质及离子浓度大小关系:
(2)C点: 恰好中和点
溶质: CH3COONa pH ≈ 8
主要微粒: Na+、CH3COO-
离子浓度关系: c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
c(Na+) =c(CH3COO-)+ c(CH3COOH)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一 】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶质及离子浓度大小关系:
(3)B点: pH =7 溶液呈中性
溶质: CH3COONa和CH3COOH(少)
主要微粒: Na+、CH3COO-
离子浓度关系:
c(Na+) =c(CH3COO-)>c(OH-)=c(H+)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶质及离子浓度大小关系:
(4)A点: pH <7 醋酸被中和一半
离子浓度关系:
c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
2c(Na+) =c(CH3COO-)+ c(CH3COOH)
主要微粒: Na+、CH3COO-、 CH3COOH
CH3COONa和CH3COOH 1:1
半等点
0
溶质:
室温下, 用0. 10 mol ·L - 1 的盐酸滴
某碱BOH溶液得到的滴定曲线如下,
下列判断不正确的是( B ) BOH为弱碱
. a 点时, 溶液呈碱性,
溶液中c(B+)>c(Cl-)
B. b点时溶液的pH=7
. 当c(Cl-)=c(B+)时, V(HCl)<20 mL
. c 点时溶液中c(H+)约为0.03 mol ·L - 1
BCl和BOH
1:1 半等点
【任务二】
起点后的溶液:c(B+)+c(H+) =c(Cl-)+c(OH-)
定20.00 mL 0. 10 mol ·L - 1 的
BCl
c(Cl-)>c(B+)
pH<7
BCl和HCl
1:1
高中化学
恰好中和
高中化学
酸碱中和滴定图像类试题 分析步骤
1. 依据题干或图像弄清楚“谁滴谁”。
2. 抓住关键点 ,依据反应用量分析溶液的组成。
3. 抓住事物的主要矛盾(主要微粒, 电离和
水解谁为主) ,将问题简单化。
4. 依据物料守恒、 电荷守恒、质子守恒的观念建立或判断溶液中微粒浓度 的数学关系式。
mol/L CH3COOH溶液, 其滴定曲线如图所示, 试回答:
(1) 该滴定实验中最适宜的指示剂为 酚酞 ,
滴定终点的颜色变化为 由无色 变 为粉色, 且 半。分钟内不改变
(2) 下列关于B点的判断正确的是 C 。
a. 醋酸和氢氧化钠恰好完全反应
b. 混合液中的微粒种类共四种
c.c(CH3COO-)=c(Na+) ﹥c(H+)=c(OH-)
课 堂 检 测
用 0. 1000 mol/L NaOH溶液滴定 20.00 mL 0. 1000
高中化学
1. 常温下,
CH3COOH溶液, 其滴定曲线如图所示, 试回答:
(3 ) A点溶液的溶质为 CH3COOH和CH3COONa , 此时
c(CH3COO-) > c(CH3COOH) (填“﹥ ” 或“﹤ ” 或“﹦ ” ) ,
溶液中水的电离平衡 被抑制 (填“被抑制 ”
或“被促进” 或“ 无影响 ”)。
(4) C点的溶液中,c(CH3COO-)+c(CH3COOH)= 0.05 mol/L 。 =c(Na+) (溶液混合时体积的微弱变化忽略不计)
该溶液中, 各种离子浓度由大到小的顺序为c(Na+)>c。(CH3COO-)>c(OH-)>c(H+)
高中化学
课 堂 检 测
1. 常温下, 用 0. 1000 mol/L NaOH溶液滴定 20.00 mL 0. 1000 mol/L
0.100 mol ·L-1 的盐酸和醋酸, 滴定曲线 如图所示 。 下列说法正确的是( B )
A. Ⅱ表示的是滴定醋酸的曲线
. pH= 7时, 滴定醋酸消耗的
V(NaOH) 小于20.00 mL
C.V(NaOH) =20.00 mL时, 两份溶液中c(Cl-
D.V(NaOH) =10.00 mL时, 醋酸溶液中CH3COOH和CH3COONa 1:1 c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
2. 室温下, 用0.100 mol ·L-1 NaOH溶液分别滴定20.00 mL
CH3COOH
HCl
课 堂 检 测
高中化学
谢谢同学们的收看!
祝同学们学业进步!
高中化学
酸碱中和滴定图像分析
高中化学
学习目标
(1 ) 通过对不同情况下酸碱混合后溶液中的离子浓度关系
分析, 能从宏观和微观相结合的视角分析与解决实际问题, 能 有效提取出事物的主要矛盾;
(2 ) 通过对氢氧化钠溶液滴定醋酸溶液的过程分析, 体会
和总结酸碱中和滴定的图像类试题的分析方法和步骤;
(3 ) 通过对比氢氧化钠溶液分别滴定 一 定浓度的盐酸 、 醋
酸时滴定曲线的差异, 进 一 步强化对强弱电解质的认知, 以及 对比方法在化学学习中的重要性。
高中化学
作业中的疑难问题解析
25 ℃ 时, pH=3的醋酸与pH=11的NaOH等体积
混合, 混合后溶液呈 酸 性, 溶液中离子浓度的关系
c(CH3COOH)>
为: c(CH3COO-)>。c(Na+) > c(H+) > c(OH-)
Na+ 、OH-
c (OH-) = 1×10-3 mol/L
1 L
多
H+ 、CH3COO- 、CH3COOH
c (H+) = 1×10-3 mol/L
1 L
CH3COONa少 CH3COOH多
电离程度约为1%
CH3COOH
+
水
高中化学
醋酸与氢氧化钠溶液的混合问题
1. 25 ℃ 时, 将浓度均为0.2 mol/L醋酸与NaOH溶液等体积 混合, 所得溶液的溶质为 CH3COONa, 溶液呈 碱 性, 混合后溶 液中各种离子浓度的大小关系为 c(Na+)>c(C。H3COO-) > c(OH-) > c(H+)
2. 25 ℃ 时 ,pH=3的醋酸与pH=11NaOH等体积混合, 所得 溶液的溶质为 CH3COOH和CH3COONa , 混合后溶液呈 酸 性, 溶
液中各种离子浓度的关系为: 。
c(CH3COO-)> c(Na+) > c(H+) > c(OH-)
高中化学
醋酸与氢氧化钠溶液的混合问题
3. 25 ℃时, 若醋酸溶液与NaOH溶液等体积混
合, 若混合后溶液成中性, 则混合前:
c(醋酸) > c(NaOH) , c(H+)酸< c(OH-)碱
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶液中离子浓度大小关系:
1. 弄清 “谁滴谁” ,看曲线的变化趋势;
2. 抓住关键点,依据用量分析溶液组成;
起点后的溶液:c(Na+)+c(H+) =c(CH3COO-)+c(OH-)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶液中离子浓度大小关系:
(1)起点: pH ≈ 3 部分电离
溶质:CH3COOH
主要微粒: CH3COOH分子
离子浓度关系: c(H+) =c(CH3COO-)+c(OH-)
c(H+) >c(CH3COO-)>c(OH-)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释
曲线上几个关键点所对应的溶质及离子浓度大小关系:
(2)C点: 恰好中和点
溶质: CH3COONa pH ≈ 8
主要微粒: Na+、CH3COO-
离子浓度关系: c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
c(Na+) =c(CH3COO-)+ c(CH3COOH)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一 】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶质及离子浓度大小关系:
(3)B点: pH =7 溶液呈中性
溶质: CH3COONa和CH3COOH(少)
主要微粒: Na+、CH3COO-
离子浓度关系:
c(Na+) =c(CH3COO-)>c(OH-)=c(H+)
高中化学
醋酸与氢氧化钠溶液的滴定问题
【任务一】常温下, 用 0.1000 mol/L NaOH溶液滴定 20.00 mL 0.1000 mol/L CH3COOH溶液, 其滴定曲线如图所示, 试解释 曲线上几个关键点所对应的溶质及离子浓度大小关系:
(4)A点: pH <7 醋酸被中和一半
离子浓度关系:
c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
2c(Na+) =c(CH3COO-)+ c(CH3COOH)
主要微粒: Na+、CH3COO-、 CH3COOH
CH3COONa和CH3COOH 1:1
半等点
0
溶质:
室温下, 用0. 10 mol ·L - 1 的盐酸滴
某碱BOH溶液得到的滴定曲线如下,
下列判断不正确的是( B ) BOH为弱碱
. a 点时, 溶液呈碱性,
溶液中c(B+)>c(Cl-)
B. b点时溶液的pH=7
. 当c(Cl-)=c(B+)时, V(HCl)<20 mL
. c 点时溶液中c(H+)约为0.03 mol ·L - 1
BCl和BOH
1:1 半等点
【任务二】
起点后的溶液:c(B+)+c(H+) =c(Cl-)+c(OH-)
定20.00 mL 0. 10 mol ·L - 1 的
BCl
c(Cl-)>c(B+)
pH<7
BCl和HCl
1:1
高中化学
恰好中和
高中化学
酸碱中和滴定图像类试题 分析步骤
1. 依据题干或图像弄清楚“谁滴谁”。
2. 抓住关键点 ,依据反应用量分析溶液的组成。
3. 抓住事物的主要矛盾(主要微粒, 电离和
水解谁为主) ,将问题简单化。
4. 依据物料守恒、 电荷守恒、质子守恒的观念建立或判断溶液中微粒浓度 的数学关系式。
mol/L CH3COOH溶液, 其滴定曲线如图所示, 试回答:
(1) 该滴定实验中最适宜的指示剂为 酚酞 ,
滴定终点的颜色变化为 由无色 变 为粉色, 且 半。分钟内不改变
(2) 下列关于B点的判断正确的是 C 。
a. 醋酸和氢氧化钠恰好完全反应
b. 混合液中的微粒种类共四种
c.c(CH3COO-)=c(Na+) ﹥c(H+)=c(OH-)
课 堂 检 测
用 0. 1000 mol/L NaOH溶液滴定 20.00 mL 0. 1000
高中化学
1. 常温下,
CH3COOH溶液, 其滴定曲线如图所示, 试回答:
(3 ) A点溶液的溶质为 CH3COOH和CH3COONa , 此时
c(CH3COO-) > c(CH3COOH) (填“﹥ ” 或“﹤ ” 或“﹦ ” ) ,
溶液中水的电离平衡 被抑制 (填“被抑制 ”
或“被促进” 或“ 无影响 ”)。
(4) C点的溶液中,c(CH3COO-)+c(CH3COOH)= 0.05 mol/L 。 =c(Na+) (溶液混合时体积的微弱变化忽略不计)
该溶液中, 各种离子浓度由大到小的顺序为c(Na+)>c。(CH3COO-)>c(OH-)>c(H+)
高中化学
课 堂 检 测
1. 常温下, 用 0. 1000 mol/L NaOH溶液滴定 20.00 mL 0. 1000 mol/L
0.100 mol ·L-1 的盐酸和醋酸, 滴定曲线 如图所示 。 下列说法正确的是( B )
A. Ⅱ表示的是滴定醋酸的曲线
. pH= 7时, 滴定醋酸消耗的
V(NaOH) 小于20.00 mL
C.V(NaOH) =20.00 mL时, 两份溶液中c(Cl-
D.V(NaOH) =10.00 mL时, 醋酸溶液中CH3COOH和CH3COONa 1:1 c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
2. 室温下, 用0.100 mol ·L-1 NaOH溶液分别滴定20.00 mL
CH3COOH
HCl
课 堂 检 测
高中化学
谢谢同学们的收看!
祝同学们学业进步!
高中化学
