探究性化学实验专题课件(共23张PPT)
文档属性
| 名称 | 探究性化学实验专题课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 825.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:57:01 | ||
图片预览




文档简介
(共23张PPT)
探究性化学实验专题(二)
高中化学
学习目标
1. 了解干扰因素的存在对实验的影响, 学会系统的寻找干扰因素。
2. 进 一 步巩固课本中出现的典型实验存在的干扰因素及其排除方法。
3. 通过案例学习, 学会针对不同情境选择恰当的方案排除干扰因素,
获取可靠的证据, 提升科学探究能力。
高中化学
化学实验干扰因素的确定与排除
在实验探究过程中 , 经常会有多个变量存在 , 一些变量会干扰
实验的正常进行 , 影响实验现象的观察 , 增大实验结果的误差。
因此 , 在实验中 , 为使实验结论准确可靠 , 就要准确找到干扰
因素 , 并对干扰因素做出一定的处理。
高中化学
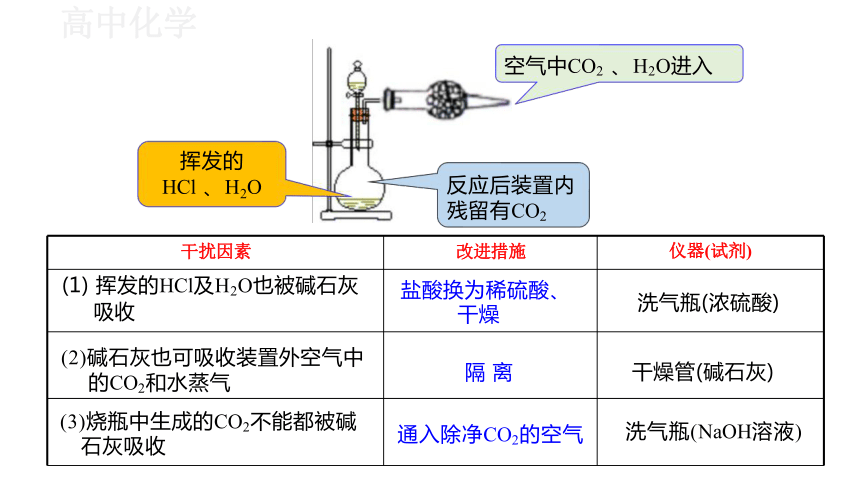
例1. 为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl) ,
某学生设计了实验装置如右图。
(1) 准确称量盛有碱石灰的干燥管的质量(设为m1 )。
(2) 准确称取一定量纯碱样品(设为m0 ) , 并放入烧瓶中。
(3)从分液漏斗缓缓滴入稀盐酸 , 待不再产生气体后,
称得干燥管的总质量(设为m2 )。
Na2CO3+2HCl=2NaCl+CO2 ↑+H2O
计算公式为:碳酸钠的质量分数= × 100%
该同学想用( m2 -m1 )来表示CO2的质量。 如果不考虑称量误差 , 该生
的实验结果有无明显误差?如果有 , 请简要说明依据并提出改进措施。
碱石灰
干扰因素 改进措施
仪器(试剂)
(1) 挥发的HCl及H2O也被碱石灰 吸收 盐酸换为稀硫酸、 干燥
洗气瓶(浓硫酸)
(2)碱石灰也可吸收装置外空气中 的CO2和水蒸气 隔 离
干燥管(碱石灰)
(3)烧瓶中生成的CO2不能都被碱 石灰吸收 通入除净CO2的空气
洗气瓶(NaOH溶液)
挥发的
HCl 、 H2O
空气中CO2 、 H2O进入
反应后装置内 残留有CO2
高中化学
避免气体残留
高中化学
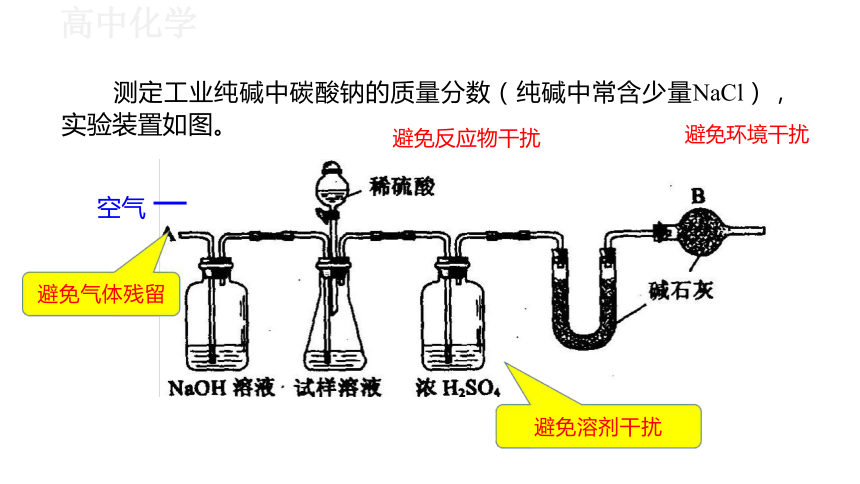
测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl) ,
实验装置如图。 避免反应物干扰 避免环境干扰
空气 一
避免溶剂干扰
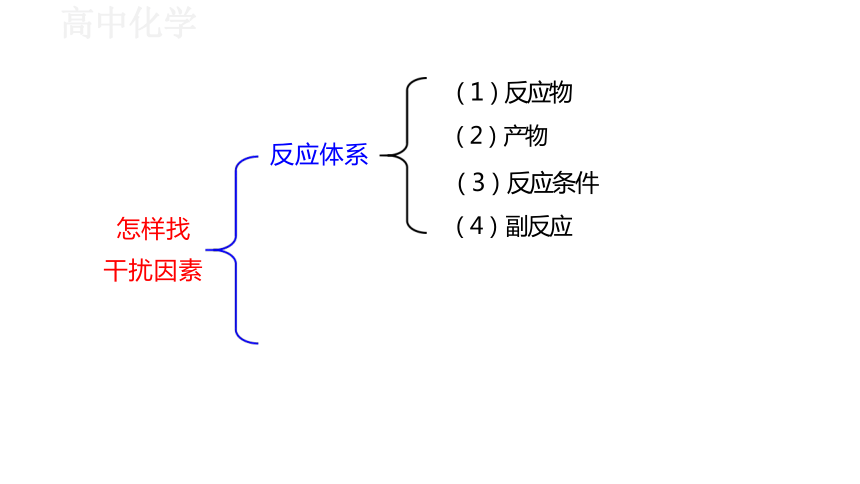
(1)反应物
(2) 产物
(3)反应条件
(4) 副反应
怎样找
干扰因素
高中化学
反应体系
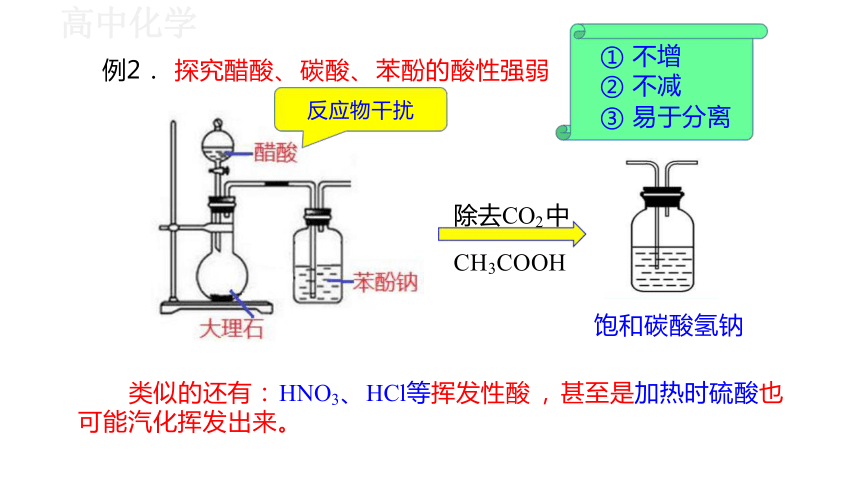
类似的还有: HNO3、 HCl等挥发性酸 , 甚至是加热时硫酸也 可能汽化挥发出来。
高中化学
例2. 探究醋酸、 碳酸、 苯酚的酸性强弱
① 不增
② 不减
③ 易于分离
反应物干扰
除去CO2 中
CH3COOH
饱和碳酸氢钠
Cl2污染环境
高中化学
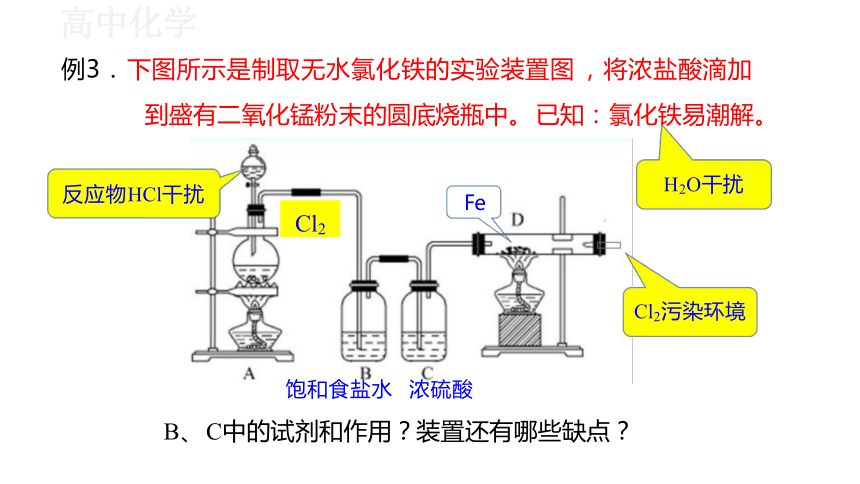
例3. 下图所示是制取无水氯化铁的实验装置图 ,将浓盐酸滴加
饱和食盐水 浓硫酸
B、 C中的试剂和作用?装置还有哪些缺点?
到盛有二氧化锰粉末的圆底烧瓶中。 已知: 氯化铁易潮解。
反应物HCl干扰
Fe
Cl2
H2O干扰
高中化学
例4. 实验小组制备高铁酸钾(K2FeO4 ) 并探究其性质。
将除杂装置B补充完整并标明所用试剂。
Cl2(HCl 、H2O)
饱和食盐水
查阅资料:Fe2++NO Fe(NO)2+
棕色
请你设计实验方案 , 可以观察
到反应有无色气泡产生 , 溶液变黄 的理想现象。
研究0. 1 mol/LFeSO4 溶液与8 mol/L稀硝酸的反应时会观察到溶
液变为棕色。 放置一段时间后 , 待有气泡逸出后溶液才变为黄色。
高中化学
例5. 已知: 3Fe2++4H++NO3 -=3Fe3++NO↑ +2H2O
产物干扰
H2O的作用
高中化学
例6. 溴乙烷的消去反应
CH3CH2Br +NaOH
v ×
CH2=CH2 ↑+NaBr+H2O
× v
反应条件干扰
v
乙醇
Δ
高中化学
例7. 乙醇的消去反应:CH3CH2OH
检验产物乙烯生成是否合理?
CH2=CH2 ↑+H2O
浓硫酸
170℃
CH2=CH2
SO2 、CO2等
高中化学
例7. 乙醇的消去反应:CH3CH2OH
C2H5OH + 4H2SO4 2 ↑ + 4SO2 ↑ + 7H2O
副反应干扰
CH2= 2 ↑+H2O
浓硫酸
170℃
反应体系 (1)反应物
(2)产物
(3)反应条件
(4) 副反应
环境(O2、 CO2、 H2O等) :
怎样找
干扰因素
高中化学
反应物干扰 :换反应原理 或增加除杂装置
环境O2干扰: 通入N2
① 煮沸
② 隔离
③ 替换
④ 空白对照
Fe2+、 SO2、 SO32-等
排除O2干扰的 常用方法
白雾
白色沉淀
高中化学
反应体系 (1)反应物
(2)产物
(3)反应条件
(4) 副反应
环境(O2、 CO2、 H2O等)
多个反应的竞争
怎样找
干扰因素
高中化学
小烧杯中的液体
现象
① 2 mL 1 mol/LKI溶液 + 5滴淀粉 + 2 mL 0.2 mol/LHCl溶液
5 min后,溶液变蓝
② 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=8.5
5小时后,溶液略变蓝
③ 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=10
5小时后,无明显变化
高中化学
例8. 资料显示“O2 的氧化性随溶液pH的增大逐渐减弱 ”。某兴趣小组 探究不同条件下KI与O2反应,实验如下。
( 1)pH增大 , O2的氧化性减弱 , O2 已经不能氧化KI。
——反应方向问题
(2)pH增大 , O2的氧化性减弱 , O2氧化速率太慢 , I2浓度太小。
——反应速率问题
(3) I2产生了 , 但pH增大 , I2在碱性条件下歧化了。
——反应竞争问题
υ (I2生成)< υ (I2歧化)
小烧杯中的液体
现象
③ 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=10
5小时后,无明显变化
高中化学
小烧杯中的液体
现象
③ 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=10
5小时后,无明显变化
反应1: 4I- +O2+2H2O=I2+4OH-
反应2: 3I2+6OH-=5I- +IO3 - +3H2O
ⅰ . 烧杯 a中的溶液为 。
ⅱ . 实验结果表明 , O2在此条件下可以氧化KI。
支持该结论的实验现象是: 通入O2后 , 。
电流表指针偏转; b中溶液颜色变蓝
高中化学
物质 正丁醇
正丁醛
沸点/℃ 117.2
75.7
密度/ (g ·cm-3) 0.81
水中溶解性 微溶
微溶
高中化学
例9. 某实验小组设计方案由正丁醇合成正丁醛。 相关数据如下:
试剂A?温度计控温?蒸出来的是谁?
Na2Cr2O7/H+
90~95℃
Na2Cr2O7/H+
90~95℃
Na2Cr2O7/H+
已知: 正丁醇
正丁醇
正丁醛
正丁醛
正丁酸
反应体系 (1)反应物
(2)产物
(3)反应条件
(4) 副反应
环境(O2、 CO2、 H2O等)
多个反应的竞争
怎样找
干扰因素
高中化学
感谢同学们收看!
高中化学
探究性化学实验专题(二)
高中化学
学习目标
1. 了解干扰因素的存在对实验的影响, 学会系统的寻找干扰因素。
2. 进 一 步巩固课本中出现的典型实验存在的干扰因素及其排除方法。
3. 通过案例学习, 学会针对不同情境选择恰当的方案排除干扰因素,
获取可靠的证据, 提升科学探究能力。
高中化学
化学实验干扰因素的确定与排除
在实验探究过程中 , 经常会有多个变量存在 , 一些变量会干扰
实验的正常进行 , 影响实验现象的观察 , 增大实验结果的误差。
因此 , 在实验中 , 为使实验结论准确可靠 , 就要准确找到干扰
因素 , 并对干扰因素做出一定的处理。
高中化学
例1. 为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl) ,
某学生设计了实验装置如右图。
(1) 准确称量盛有碱石灰的干燥管的质量(设为m1 )。
(2) 准确称取一定量纯碱样品(设为m0 ) , 并放入烧瓶中。
(3)从分液漏斗缓缓滴入稀盐酸 , 待不再产生气体后,
称得干燥管的总质量(设为m2 )。
Na2CO3+2HCl=2NaCl+CO2 ↑+H2O
计算公式为:碳酸钠的质量分数= × 100%
该同学想用( m2 -m1 )来表示CO2的质量。 如果不考虑称量误差 , 该生
的实验结果有无明显误差?如果有 , 请简要说明依据并提出改进措施。
碱石灰
干扰因素 改进措施
仪器(试剂)
(1) 挥发的HCl及H2O也被碱石灰 吸收 盐酸换为稀硫酸、 干燥
洗气瓶(浓硫酸)
(2)碱石灰也可吸收装置外空气中 的CO2和水蒸气 隔 离
干燥管(碱石灰)
(3)烧瓶中生成的CO2不能都被碱 石灰吸收 通入除净CO2的空气
洗气瓶(NaOH溶液)
挥发的
HCl 、 H2O
空气中CO2 、 H2O进入
反应后装置内 残留有CO2
高中化学
避免气体残留
高中化学
测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl) ,
实验装置如图。 避免反应物干扰 避免环境干扰
空气 一
避免溶剂干扰
(1)反应物
(2) 产物
(3)反应条件
(4) 副反应
怎样找
干扰因素
高中化学
反应体系
类似的还有: HNO3、 HCl等挥发性酸 , 甚至是加热时硫酸也 可能汽化挥发出来。
高中化学
例2. 探究醋酸、 碳酸、 苯酚的酸性强弱
① 不增
② 不减
③ 易于分离
反应物干扰
除去CO2 中
CH3COOH
饱和碳酸氢钠
Cl2污染环境
高中化学
例3. 下图所示是制取无水氯化铁的实验装置图 ,将浓盐酸滴加
饱和食盐水 浓硫酸
B、 C中的试剂和作用?装置还有哪些缺点?
到盛有二氧化锰粉末的圆底烧瓶中。 已知: 氯化铁易潮解。
反应物HCl干扰
Fe
Cl2
H2O干扰
高中化学
例4. 实验小组制备高铁酸钾(K2FeO4 ) 并探究其性质。
将除杂装置B补充完整并标明所用试剂。
Cl2(HCl 、H2O)
饱和食盐水
查阅资料:Fe2++NO Fe(NO)2+
棕色
请你设计实验方案 , 可以观察
到反应有无色气泡产生 , 溶液变黄 的理想现象。
研究0. 1 mol/LFeSO4 溶液与8 mol/L稀硝酸的反应时会观察到溶
液变为棕色。 放置一段时间后 , 待有气泡逸出后溶液才变为黄色。
高中化学
例5. 已知: 3Fe2++4H++NO3 -=3Fe3++NO↑ +2H2O
产物干扰
H2O的作用
高中化学
例6. 溴乙烷的消去反应
CH3CH2Br +NaOH
v ×
CH2=CH2 ↑+NaBr+H2O
× v
反应条件干扰
v
乙醇
Δ
高中化学
例7. 乙醇的消去反应:CH3CH2OH
检验产物乙烯生成是否合理?
CH2=CH2 ↑+H2O
浓硫酸
170℃
CH2=CH2
SO2 、CO2等
高中化学
例7. 乙醇的消去反应:CH3CH2OH
C2H5OH + 4H2SO4 2 ↑ + 4SO2 ↑ + 7H2O
副反应干扰
CH2= 2 ↑+H2O
浓硫酸
170℃
反应体系 (1)反应物
(2)产物
(3)反应条件
(4) 副反应
环境(O2、 CO2、 H2O等) :
怎样找
干扰因素
高中化学
反应物干扰 :换反应原理 或增加除杂装置
环境O2干扰: 通入N2
① 煮沸
② 隔离
③ 替换
④ 空白对照
Fe2+、 SO2、 SO32-等
排除O2干扰的 常用方法
白雾
白色沉淀
高中化学
反应体系 (1)反应物
(2)产物
(3)反应条件
(4) 副反应
环境(O2、 CO2、 H2O等)
多个反应的竞争
怎样找
干扰因素
高中化学
小烧杯中的液体
现象
① 2 mL 1 mol/LKI溶液 + 5滴淀粉 + 2 mL 0.2 mol/LHCl溶液
5 min后,溶液变蓝
② 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=8.5
5小时后,溶液略变蓝
③ 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=10
5小时后,无明显变化
高中化学
例8. 资料显示“O2 的氧化性随溶液pH的增大逐渐减弱 ”。某兴趣小组 探究不同条件下KI与O2反应,实验如下。
( 1)pH增大 , O2的氧化性减弱 , O2 已经不能氧化KI。
——反应方向问题
(2)pH增大 , O2的氧化性减弱 , O2氧化速率太慢 , I2浓度太小。
——反应速率问题
(3) I2产生了 , 但pH增大 , I2在碱性条件下歧化了。
——反应竞争问题
υ (I2生成)< υ (I2歧化)
小烧杯中的液体
现象
③ 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=10
5小时后,无明显变化
高中化学
小烧杯中的液体
现象
③ 2 mL 1 mol/LKI溶液+ 5滴淀粉 用KOH调pH=10
5小时后,无明显变化
反应1: 4I- +O2+2H2O=I2+4OH-
反应2: 3I2+6OH-=5I- +IO3 - +3H2O
ⅰ . 烧杯 a中的溶液为 。
ⅱ . 实验结果表明 , O2在此条件下可以氧化KI。
支持该结论的实验现象是: 通入O2后 , 。
电流表指针偏转; b中溶液颜色变蓝
高中化学
物质 正丁醇
正丁醛
沸点/℃ 117.2
75.7
密度/ (g ·cm-3) 0.81
水中溶解性 微溶
微溶
高中化学
例9. 某实验小组设计方案由正丁醇合成正丁醛。 相关数据如下:
试剂A?温度计控温?蒸出来的是谁?
Na2Cr2O7/H+
90~95℃
Na2Cr2O7/H+
90~95℃
Na2Cr2O7/H+
已知: 正丁醇
正丁醇
正丁醛
正丁醛
正丁酸
反应体系 (1)反应物
(2)产物
(3)反应条件
(4) 副反应
环境(O2、 CO2、 H2O等)
多个反应的竞争
怎样找
干扰因素
高中化学
感谢同学们收看!
高中化学
同课章节目录
