探究性化学实验专题复习课件(共21张PPT)
文档属性
| 名称 | 探究性化学实验专题复习课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 378.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:57:40 | ||
图片预览




文档简介
(共21张PPT)
探究性化学实验专题(四)
高中化学
学 习 目 标
(1) 通过对高铁酸钾的制备和性质探究实验的分析, 提升运用化学
反应原理解读实际问题的能力, 会从复杂反应体系的存在成分以及物质 之间的相互作用的角度综合分析物质的性质。
(2) 通过对Na2 S溶液与KMnO4 溶液反应探究过程的分析, 体会条件
不同对物质性质的影响, 了解探究物质性质实验的核心思路和基本方
法, 掌握实验探究题的解题思路和注意事项, 提升科学、 准确、 规范答
题的能力。
高中化学
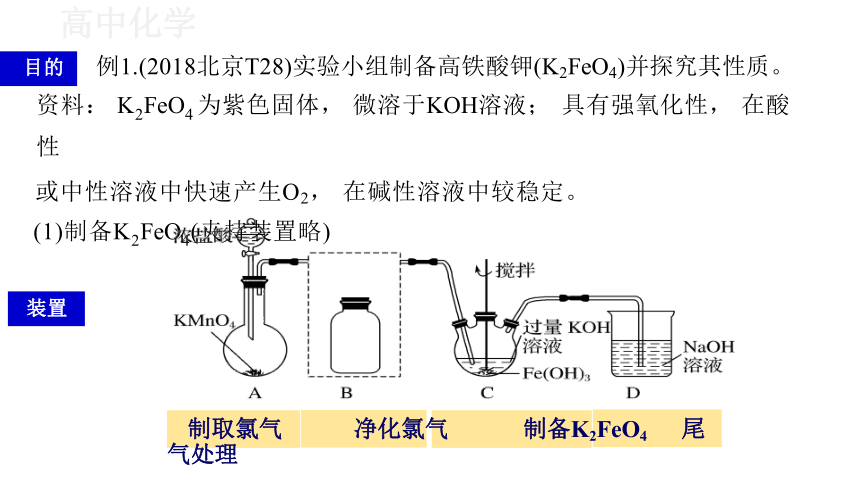
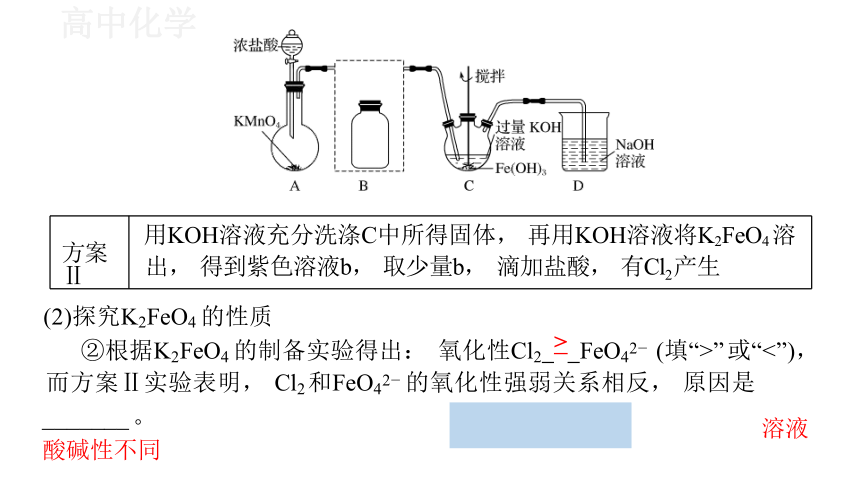
目的 例1.(2018北京T28)实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料: K2FeO4 为紫色固体, 微溶于KOH溶液; 具有强氧化性, 在酸性
或中性溶液中快速产生O2, 在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
制取氯气 净化氯气 制备K2FeO4 尾气处理
装置
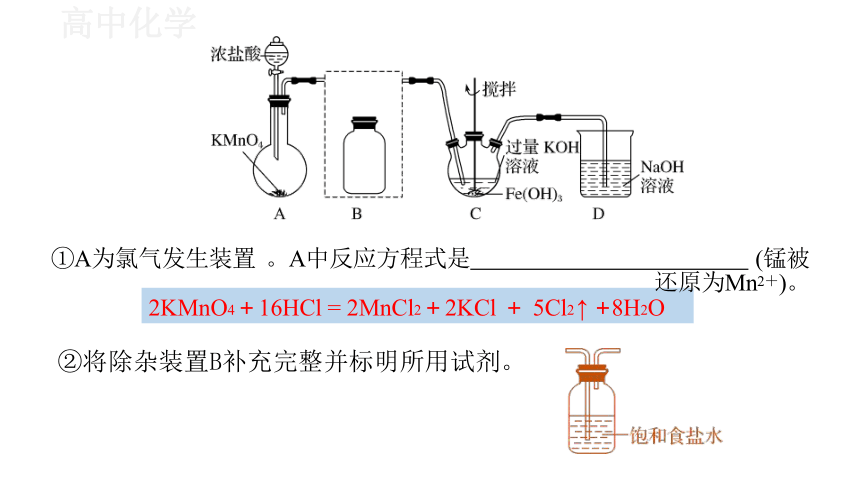
①A为氯气发生装置 。A中反应方程式是 (锰被还原为Mn2+)。
2KMnO4+16HCl = 2MnCl2+2KCl + 5Cl2 ↑ +8H2O
②将除杂装置B补充完整并标明所用试剂。
高中化学
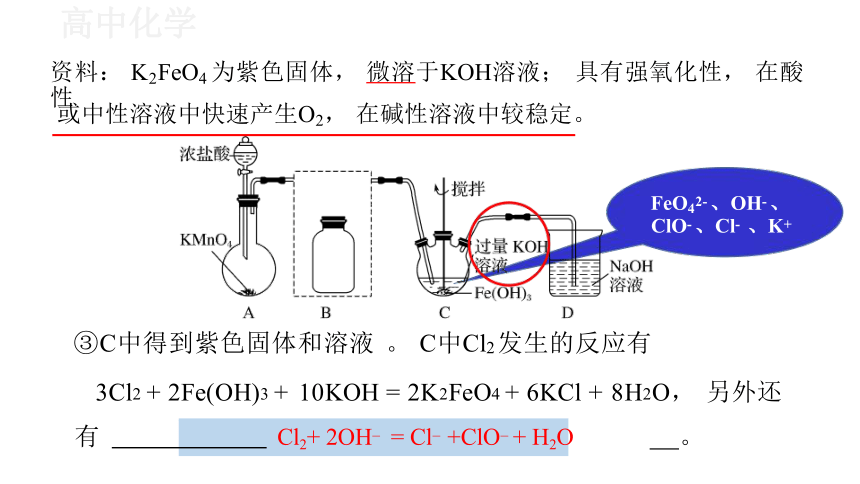
FeO42- 、OH- 、 ClO- 、Cl- 、K+
③C中得到紫色固体和溶液 。 C中Cl2 发生的反应有
3Cl2 + 2Fe(OH)3 + 10KOH = 2K2FeO4 + 6KCl + 8H2O, 另外还
有 Cl2+ 2OH = Cl +ClO + H2O 。
高中化学
资料: K2FeO4 为紫色固体, 微溶于KOH溶液; 具有强氧化性, 在酸性
或中性溶液中快速产生O2, 在碱性溶液中较稳定。
高中化学
资料: K2FeO4 为紫色固体, 微溶于KOH溶液;
具有强氧化性, 在酸性或中性溶液中快速产生O2, 在碱性溶液
中较稳定。
如果FeO42 → Fe (Ⅲ) ,如何完成产生氧气的离子方程式?
4FeO42 + 10H2O = 4Fe(OH)3 (胶体) + 3O2 ↑ + 8OH-
4FeO42 + 20 H+ = 4Fe3+ + 3O2 ↑ + 10H2O
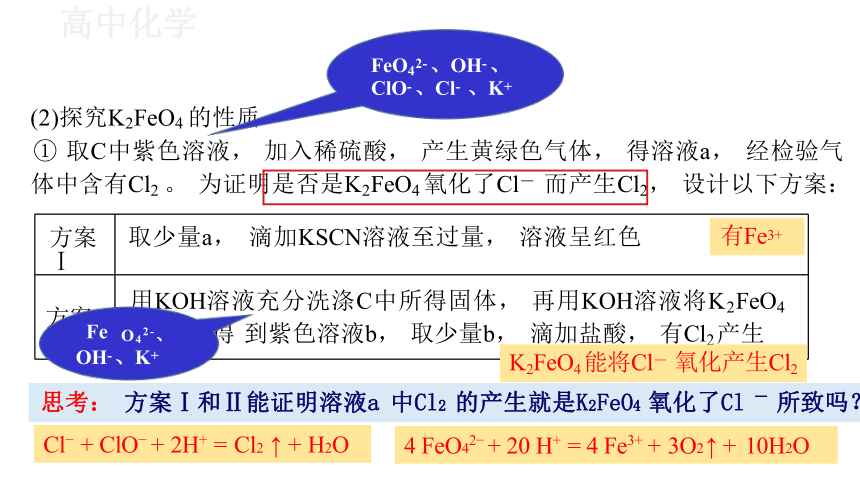
方案Ⅰ 取少量a, 滴加KSCN溶液至过量, 溶液呈红色
方案Ⅱ 用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶出, 得 到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
① 取C中紫色溶液, 加入稀硫酸, 产生黄绿色气体, 得溶液a, 经检验气
体中含有Cl2 。 为证明是否是K2FeO4 氧化了Cl- 而产生Cl2, 设计以下方案:
高中化学
(2)探究K2FeO4 的性质
思考: 方案Ⅰ和Ⅱ能证明溶液a 中Cl2 的产生就是K2FeO4 氧化了Cl - 所致吗?
OH- 、K+
4 FeO42 + 20 H+ = 4 Fe3+ + 3O2 ↑ + 10H2O
K2FeO4 能将Cl- 氧化产生Cl2
Cl + ClO + 2H+ = Cl2 ↑ + H2O
FeO42- 、OH- 、 ClO- 、Cl- 、K+
有Fe3+
O42-、
Fe
高中化学
(2)探究K2FeO4 的性质
①取C中紫色溶液, 加入稀硫酸, 产生黄绿色气体, 得溶液a, 经检验气体 中含有Cl2 。 为证明是否是K2FeO4 氧化了Cl- 而产生Cl2, 设计以下方案:
方案Ⅰ
取少量a, 滴加KSCN溶液至过量, 溶液呈红色
方案Ⅱ
用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶
出, 得到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
Ⅰ . 由方案Ⅰ中溶液变红可知a 中含有 Fe3+ 离子,但该离子的产生不能判断 一 定是K2FeO4 将Cl- 氧化, 还可能由 产生(用方程式表示)。
Ⅱ . 方案Ⅱ可证明K2FeO4 氧化了Cl- 。 用KOH溶液洗涤的目的是 。
排除ClO 的干扰
4FeO42 + 20 H+ = 4Fe3+ + 3O2 ↑ + 10H2O
(2)探究K2FeO4 的性质
②根据K2FeO4 的制备实验得出: 氧化性Cl2 > FeO42 (填“>” 或“<”), 而方案Ⅱ实验表明, Cl2 和FeO42 的氧化性强弱关系相反, 原因是
_______ 。 溶液酸碱性不同
方案Ⅱ
用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶
出, 得到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
高中化学
理由:FeO42 在过量酸的作用下会完全转化为Fe3+和O2, 所得溶液的浅 紫色 一 定是MnO4 的颜色。
方案: 向紫色溶液b中滴加足量稀H2 SO4, 观察溶液的紫色是快速褪去还
是显浅紫色。
(2)探究K2FeO4 的性质
③资料表明, 酸性溶液中的氧化性FeO42 > MnO4 , 验证实验如
下: 将溶液b滴入MnSO4 和足量H2 SO4 的混合溶液中,振荡后溶液呈浅紫 色, 该现象能否证明氧化性 FeO42 > MnO4 。 若能, 请说明理由; 若不
方案Ⅱ
用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶
出, 得 到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
高中化学
FeO42-、 OH- K+
、
高中化学
经 验 总 结
(1)FeO42 在碱性条件下才相对稳定, 而在中性和酸性条件
下非常活泼, 因此制备高铁酸钾和完成高铁酸钾性质实验时, 要 关注溶液酸碱性环境的不同。
(2)在探究FeO42 的性质实验时, 一 定要关注体系的微粒组
成, 关注微粒间的相互影响, 提升综合分析问题的能力。
() 清
本题( 2 ) 针对C中紫色溶液加稀硫酸产生氯气的探究过程:
① 产物中有Fe3+就能说明FeO42- 将Cl- 氧化了吗?
② FeO42- 能将Cl- 氧化就能说明FeO42-确实将Cl- 氧化了吗? ?
③ 产物中有Fe3+,FeO42- 又具备氧化Cl- 的能力, 就能确定FeO42- 将Cl- 氧化了吗?
实验序号 Ⅰ
Ⅱ
实验过程 滴加10滴(约0.3 mL) 0. 1 mol/LNa2 S溶液 5 mL 0.01 mol/L 酸性 KMnO4 溶液(H2 SO4 酸 化至pH=0)
滴加10滴(约0.3 mL)
0.01 mol/L 酸性KMnO4 溶液(H2 SO4 酸化至pH=0)
5 mL 0. 1 mol/L
Na2 S溶液
实验现象 紫色变浅(pH<1), 生成棕褐 色沉淀(MnO2)
溶液呈淡黄色(pH≈ 8), 生成 浅粉色沉淀(MnS)
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
资料:ⅰ . MnO4-在强酸性条件下被还原为Mn2+ ,在近中性条件下被还MnO2。
ⅱ . 单质硫可溶于硫化钠溶液, 溶液呈淡黄色。
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
( 1) 根据实验可知,Na2 S具有 还原 性。
(2) 甲同学预测实验I中S2– 被氧化成SO32-。
①根据实验现象, 乙同学认为甲的预测不合理, 理由是
②乙同学取实验I中少量溶液进行实验, 检测到有SO42- , 得出S2– 被
氧化成SO42- 的结论, 丙同学否定了该结论, 理由是 。
因KMnO4 溶液是用H2SO4 酸化的, 故反应后溶液中有SO42- 不能证明是被氧化生成的。
溶液呈紫色, 说明酸性KMnO4 溶液过量, SO32- 能被其继续氧化。
高中化学
(2) 甲同学预测实验I中S2– 被氧化成SO32-。
①根据实验现象, 乙同学认为甲的预测不合理, 理由是 。
②乙同学取实验I中少量溶液进行实验, 检测到有SO42- , 得出S2– 被氧
化成SO42- 的结论, 丙同学否定了该结论, 理由是 。
③同学们经讨论后, 设计了如下实验, 证实该条件下MnO4- 的确可以
将S2– 氧化成SO42- 。 0.01 mol/L KMnO4 溶液 a.右侧烧杯中的溶液是 ( H2 SO4 酸化至pH=0)
(填操作和现象)。
取左侧烧杯中的溶液, 用盐酸酸化后,
滴加BaCl2 溶液, 观察到有白色沉淀生成
b. 连通后电流计指针偏转, 一段时间后,
0 . 1 m o l / L
Na2S溶液
碳棒
碳棒
(3) 实验I的现象与资料i存在差异, 其原因是新生成的产物
(Mn2+) 与过量的反应物( MnO4- ) 发生反应, 该反应的离子方程式是 2 MnO4- + 3Mn2+ + 2H2O = 5MnO2 ↓ + 4H+
(4) 实验II的现象与资料也不完全相符, 丁同学猜想其原因与(3) 相似, 经验证猜想成立, 他的实验方案是
将实验I中生成的MnO2 分离洗涤后, 加入0. 1 mol/L Na2 S溶液, 观察到有浅粉色沉 淀, 且溶液呈淡黄色, 证明新生成的MnO2 与过量的S2- 反应, 故没得到MnO2 沉淀。
实验序号 Ⅰ
Ⅱ
实验过程 滴加10滴(约0.3 mL) 0. 1 mol/L Na2S溶液 5 mL 0.01 mol/L酸性KMnO4 溶 液(H2SO4 酸化至pH=0)
滴加10滴(约0.3 mL) 0.01 mol/L 酸 性KMnO4 溶液(H2SO4 酸化至pH=0)
5 mL 0. 1 mol/L Na2S溶液
实验现象 紫色变浅(pH<1), 生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH≈ 8), 生成浅粉色沉淀(MnS)
(5) 反思该实验, 反应物相同, 而现象不同, 体现了物质变化不仅与其
自身的性质有关, 还与 浓 度 、 用 量 、 溶液的酸碱性 因素有关。
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
实验序号 Ⅰ
Ⅱ
滴加10滴(约0.3mL)
滴加10滴(约0.3 mL) 0.01 mol/L酸性
实验过程 0. 1 mol/L Na2S溶液
KMnO4 溶液(H2SO4 酸化至pH=0)
5 mL 0.01 mol/L 酸性KMnO4
溶液(H2SO4 酸化至pH=0)
5 mL 0. 1 mol/L Na2S溶液
实验现象 紫色变浅(pH<1), 生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH≈ 8), 生成浅粉色沉淀(MnS)
(2 ) 甲同学预测实验I中S2– 被氧化成SO32-。
① 根据实验现象, 乙同学认为甲的预测不合理, 理由是 。
② 乙同学取实验I中少量溶液进行实验, 检测到有SO42- , 得出S2– 被氧 化成SO42- 的结论, 丙同学否定了该结论, 理由是 。
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
资料:ⅰ. MnO4-在强酸性条件下被还原为Mn2+ ,在近中性条件下被还MnO2。 ⅱ. 单质硫可溶于硫化钠溶液, 溶液呈淡黄色。
发现问题
提出预测
分析预测
实验目的
实验现象
实验操作
(4 ) 实验II的现象与资料也不完全相符, 丁同学猜想其原因与(3 ) 相似, 经
验证猜想成立, 他的实验方案是 。
____________________
③同学们经讨论后, 设计了如下实验, 证实该条件下 MnO4- 的确可以将S2– 氧化成SO42- 。
a.右侧烧杯中的溶液是 。
b. 连通后电流计指针偏转, 一段时间后 , 。
(3 ) 实验I的现象与资料i存在差异, 其原因是新生成的产物(Mn2+) 与过量
的反应物( MnO4- ) 发生反应, 该反应的离子方程式是 。
(5) 反思该实验, 反应物相同, 而现象不同, 体现了物质变化不仅与其 性质有关, 还与 因素有关。
设计实验验证预测
实验结论
原理分析 实验取证
高中化学
_______________
高中化学
实验探究的一般思路
收集证据 获取结论
试剂用量 、 操作设计
变量控制 、排除干扰
出现异常、合理预测
及时改进、验证预测
设计实验 验证假设
发现问题 提出假设
结论
操作
目的
现象
高中化学
解答实验探究题的基本步骤
(1) 明确干什么—— 审清题干和设问, 明确实验目的
(2)信息有什么—— 明确物质的特性及题目所给信息
(3)原理是什么——根据实验目的和实验操作, 弄清实验的基本原理
(4) 问题问什么—— 细审试题设问 ,斟酌命题意图 ,确定答题方向 (5) 答案写什么——科学 、 规范 、严谨 、 有针对性的回答问题
谢谢同学们的收看!
祝同学们学业进步!
高中化学
探究性化学实验专题(四)
高中化学
学 习 目 标
(1) 通过对高铁酸钾的制备和性质探究实验的分析, 提升运用化学
反应原理解读实际问题的能力, 会从复杂反应体系的存在成分以及物质 之间的相互作用的角度综合分析物质的性质。
(2) 通过对Na2 S溶液与KMnO4 溶液反应探究过程的分析, 体会条件
不同对物质性质的影响, 了解探究物质性质实验的核心思路和基本方
法, 掌握实验探究题的解题思路和注意事项, 提升科学、 准确、 规范答
题的能力。
高中化学
目的 例1.(2018北京T28)实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料: K2FeO4 为紫色固体, 微溶于KOH溶液; 具有强氧化性, 在酸性
或中性溶液中快速产生O2, 在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
制取氯气 净化氯气 制备K2FeO4 尾气处理
装置
①A为氯气发生装置 。A中反应方程式是 (锰被还原为Mn2+)。
2KMnO4+16HCl = 2MnCl2+2KCl + 5Cl2 ↑ +8H2O
②将除杂装置B补充完整并标明所用试剂。
高中化学
FeO42- 、OH- 、 ClO- 、Cl- 、K+
③C中得到紫色固体和溶液 。 C中Cl2 发生的反应有
3Cl2 + 2Fe(OH)3 + 10KOH = 2K2FeO4 + 6KCl + 8H2O, 另外还
有 Cl2+ 2OH = Cl +ClO + H2O 。
高中化学
资料: K2FeO4 为紫色固体, 微溶于KOH溶液; 具有强氧化性, 在酸性
或中性溶液中快速产生O2, 在碱性溶液中较稳定。
高中化学
资料: K2FeO4 为紫色固体, 微溶于KOH溶液;
具有强氧化性, 在酸性或中性溶液中快速产生O2, 在碱性溶液
中较稳定。
如果FeO42 → Fe (Ⅲ) ,如何完成产生氧气的离子方程式?
4FeO42 + 10H2O = 4Fe(OH)3 (胶体) + 3O2 ↑ + 8OH-
4FeO42 + 20 H+ = 4Fe3+ + 3O2 ↑ + 10H2O
方案Ⅰ 取少量a, 滴加KSCN溶液至过量, 溶液呈红色
方案Ⅱ 用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶出, 得 到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
① 取C中紫色溶液, 加入稀硫酸, 产生黄绿色气体, 得溶液a, 经检验气
体中含有Cl2 。 为证明是否是K2FeO4 氧化了Cl- 而产生Cl2, 设计以下方案:
高中化学
(2)探究K2FeO4 的性质
思考: 方案Ⅰ和Ⅱ能证明溶液a 中Cl2 的产生就是K2FeO4 氧化了Cl - 所致吗?
OH- 、K+
4 FeO42 + 20 H+ = 4 Fe3+ + 3O2 ↑ + 10H2O
K2FeO4 能将Cl- 氧化产生Cl2
Cl + ClO + 2H+ = Cl2 ↑ + H2O
FeO42- 、OH- 、 ClO- 、Cl- 、K+
有Fe3+
O42-、
Fe
高中化学
(2)探究K2FeO4 的性质
①取C中紫色溶液, 加入稀硫酸, 产生黄绿色气体, 得溶液a, 经检验气体 中含有Cl2 。 为证明是否是K2FeO4 氧化了Cl- 而产生Cl2, 设计以下方案:
方案Ⅰ
取少量a, 滴加KSCN溶液至过量, 溶液呈红色
方案Ⅱ
用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶
出, 得到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
Ⅰ . 由方案Ⅰ中溶液变红可知a 中含有 Fe3+ 离子,但该离子的产生不能判断 一 定是K2FeO4 将Cl- 氧化, 还可能由 产生(用方程式表示)。
Ⅱ . 方案Ⅱ可证明K2FeO4 氧化了Cl- 。 用KOH溶液洗涤的目的是 。
排除ClO 的干扰
4FeO42 + 20 H+ = 4Fe3+ + 3O2 ↑ + 10H2O
(2)探究K2FeO4 的性质
②根据K2FeO4 的制备实验得出: 氧化性Cl2 > FeO42 (填“>” 或“<”), 而方案Ⅱ实验表明, Cl2 和FeO42 的氧化性强弱关系相反, 原因是
_______ 。 溶液酸碱性不同
方案Ⅱ
用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶
出, 得到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
高中化学
理由:FeO42 在过量酸的作用下会完全转化为Fe3+和O2, 所得溶液的浅 紫色 一 定是MnO4 的颜色。
方案: 向紫色溶液b中滴加足量稀H2 SO4, 观察溶液的紫色是快速褪去还
是显浅紫色。
(2)探究K2FeO4 的性质
③资料表明, 酸性溶液中的氧化性FeO42 > MnO4 , 验证实验如
下: 将溶液b滴入MnSO4 和足量H2 SO4 的混合溶液中,振荡后溶液呈浅紫 色, 该现象能否证明氧化性 FeO42 > MnO4 。 若能, 请说明理由; 若不
方案Ⅱ
用KOH溶液充分洗涤C中所得固体, 再用KOH溶液将K2FeO4 溶
出, 得 到紫色溶液b, 取少量b, 滴加盐酸, 有Cl2 产生
高中化学
FeO42-、 OH- K+
、
高中化学
经 验 总 结
(1)FeO42 在碱性条件下才相对稳定, 而在中性和酸性条件
下非常活泼, 因此制备高铁酸钾和完成高铁酸钾性质实验时, 要 关注溶液酸碱性环境的不同。
(2)在探究FeO42 的性质实验时, 一 定要关注体系的微粒组
成, 关注微粒间的相互影响, 提升综合分析问题的能力。
() 清
本题( 2 ) 针对C中紫色溶液加稀硫酸产生氯气的探究过程:
① 产物中有Fe3+就能说明FeO42- 将Cl- 氧化了吗?
② FeO42- 能将Cl- 氧化就能说明FeO42-确实将Cl- 氧化了吗? ?
③ 产物中有Fe3+,FeO42- 又具备氧化Cl- 的能力, 就能确定FeO42- 将Cl- 氧化了吗?
实验序号 Ⅰ
Ⅱ
实验过程 滴加10滴(约0.3 mL) 0. 1 mol/LNa2 S溶液 5 mL 0.01 mol/L 酸性 KMnO4 溶液(H2 SO4 酸 化至pH=0)
滴加10滴(约0.3 mL)
0.01 mol/L 酸性KMnO4 溶液(H2 SO4 酸化至pH=0)
5 mL 0. 1 mol/L
Na2 S溶液
实验现象 紫色变浅(pH<1), 生成棕褐 色沉淀(MnO2)
溶液呈淡黄色(pH≈ 8), 生成 浅粉色沉淀(MnS)
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
资料:ⅰ . MnO4-在强酸性条件下被还原为Mn2+ ,在近中性条件下被还MnO2。
ⅱ . 单质硫可溶于硫化钠溶液, 溶液呈淡黄色。
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
( 1) 根据实验可知,Na2 S具有 还原 性。
(2) 甲同学预测实验I中S2– 被氧化成SO32-。
①根据实验现象, 乙同学认为甲的预测不合理, 理由是
②乙同学取实验I中少量溶液进行实验, 检测到有SO42- , 得出S2– 被
氧化成SO42- 的结论, 丙同学否定了该结论, 理由是 。
因KMnO4 溶液是用H2SO4 酸化的, 故反应后溶液中有SO42- 不能证明是被氧化生成的。
溶液呈紫色, 说明酸性KMnO4 溶液过量, SO32- 能被其继续氧化。
高中化学
(2) 甲同学预测实验I中S2– 被氧化成SO32-。
①根据实验现象, 乙同学认为甲的预测不合理, 理由是 。
②乙同学取实验I中少量溶液进行实验, 检测到有SO42- , 得出S2– 被氧
化成SO42- 的结论, 丙同学否定了该结论, 理由是 。
③同学们经讨论后, 设计了如下实验, 证实该条件下MnO4- 的确可以
将S2– 氧化成SO42- 。 0.01 mol/L KMnO4 溶液 a.右侧烧杯中的溶液是 ( H2 SO4 酸化至pH=0)
(填操作和现象)。
取左侧烧杯中的溶液, 用盐酸酸化后,
滴加BaCl2 溶液, 观察到有白色沉淀生成
b. 连通后电流计指针偏转, 一段时间后,
0 . 1 m o l / L
Na2S溶液
碳棒
碳棒
(3) 实验I的现象与资料i存在差异, 其原因是新生成的产物
(Mn2+) 与过量的反应物( MnO4- ) 发生反应, 该反应的离子方程式是 2 MnO4- + 3Mn2+ + 2H2O = 5MnO2 ↓ + 4H+
(4) 实验II的现象与资料也不完全相符, 丁同学猜想其原因与(3) 相似, 经验证猜想成立, 他的实验方案是
将实验I中生成的MnO2 分离洗涤后, 加入0. 1 mol/L Na2 S溶液, 观察到有浅粉色沉 淀, 且溶液呈淡黄色, 证明新生成的MnO2 与过量的S2- 反应, 故没得到MnO2 沉淀。
实验序号 Ⅰ
Ⅱ
实验过程 滴加10滴(约0.3 mL) 0. 1 mol/L Na2S溶液 5 mL 0.01 mol/L酸性KMnO4 溶 液(H2SO4 酸化至pH=0)
滴加10滴(约0.3 mL) 0.01 mol/L 酸 性KMnO4 溶液(H2SO4 酸化至pH=0)
5 mL 0. 1 mol/L Na2S溶液
实验现象 紫色变浅(pH<1), 生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH≈ 8), 生成浅粉色沉淀(MnS)
(5) 反思该实验, 反应物相同, 而现象不同, 体现了物质变化不仅与其
自身的性质有关, 还与 浓 度 、 用 量 、 溶液的酸碱性 因素有关。
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
实验序号 Ⅰ
Ⅱ
滴加10滴(约0.3mL)
滴加10滴(约0.3 mL) 0.01 mol/L酸性
实验过程 0. 1 mol/L Na2S溶液
KMnO4 溶液(H2SO4 酸化至pH=0)
5 mL 0.01 mol/L 酸性KMnO4
溶液(H2SO4 酸化至pH=0)
5 mL 0. 1 mol/L Na2S溶液
实验现象 紫色变浅(pH<1), 生成棕褐色沉淀(MnO2)
溶液呈淡黄色(pH≈ 8), 生成浅粉色沉淀(MnS)
(2 ) 甲同学预测实验I中S2– 被氧化成SO32-。
① 根据实验现象, 乙同学认为甲的预测不合理, 理由是 。
② 乙同学取实验I中少量溶液进行实验, 检测到有SO42- , 得出S2– 被氧 化成SO42- 的结论, 丙同学否定了该结论, 理由是 。
高中化学
例2. 某小组研究Na2 S溶液与KMnO4 溶液反应, 探究过程如下。
资料:ⅰ. MnO4-在强酸性条件下被还原为Mn2+ ,在近中性条件下被还MnO2。 ⅱ. 单质硫可溶于硫化钠溶液, 溶液呈淡黄色。
发现问题
提出预测
分析预测
实验目的
实验现象
实验操作
(4 ) 实验II的现象与资料也不完全相符, 丁同学猜想其原因与(3 ) 相似, 经
验证猜想成立, 他的实验方案是 。
____________________
③同学们经讨论后, 设计了如下实验, 证实该条件下 MnO4- 的确可以将S2– 氧化成SO42- 。
a.右侧烧杯中的溶液是 。
b. 连通后电流计指针偏转, 一段时间后 , 。
(3 ) 实验I的现象与资料i存在差异, 其原因是新生成的产物(Mn2+) 与过量
的反应物( MnO4- ) 发生反应, 该反应的离子方程式是 。
(5) 反思该实验, 反应物相同, 而现象不同, 体现了物质变化不仅与其 性质有关, 还与 因素有关。
设计实验验证预测
实验结论
原理分析 实验取证
高中化学
_______________
高中化学
实验探究的一般思路
收集证据 获取结论
试剂用量 、 操作设计
变量控制 、排除干扰
出现异常、合理预测
及时改进、验证预测
设计实验 验证假设
发现问题 提出假设
结论
操作
目的
现象
高中化学
解答实验探究题的基本步骤
(1) 明确干什么—— 审清题干和设问, 明确实验目的
(2)信息有什么—— 明确物质的特性及题目所给信息
(3)原理是什么——根据实验目的和实验操作, 弄清实验的基本原理
(4) 问题问什么—— 细审试题设问 ,斟酌命题意图 ,确定答题方向 (5) 答案写什么——科学 、 规范 、严谨 、 有针对性的回答问题
谢谢同学们的收看!
祝同学们学业进步!
高中化学
同课章节目录
