探究性化学实验专题课件(共21张PPT)
文档属性
| 名称 | 探究性化学实验专题课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 345.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:58:42 | ||
图片预览







文档简介
(共21张PPT)
探究性化学实验专题(三)
高中化学
学习目标
( 1) 通过对SO2 与AgNO3 溶液反应的典型事例分析, 发展对实验现象
和数据进行缜密分析和推理的能力, 并能用恰当的形式进行表达和归纳;
(2) 明确SO2 与AgNO3 溶液反应的实验探究过程中的实验目的、 实验
设计、 证据获取和结论总结之间的逻辑关系 ,厘清探究过程中的物质转化 关系, 认识实验中的取证措施和具体意义;
(3) 强化实验探究分析过程中的问题意识, 能对异常现象作出预测和
假设, 能依据实验目的和假设, 设计解决问题的实验方案, 并能对实验方 案进行合理评价和反思。
高中化学
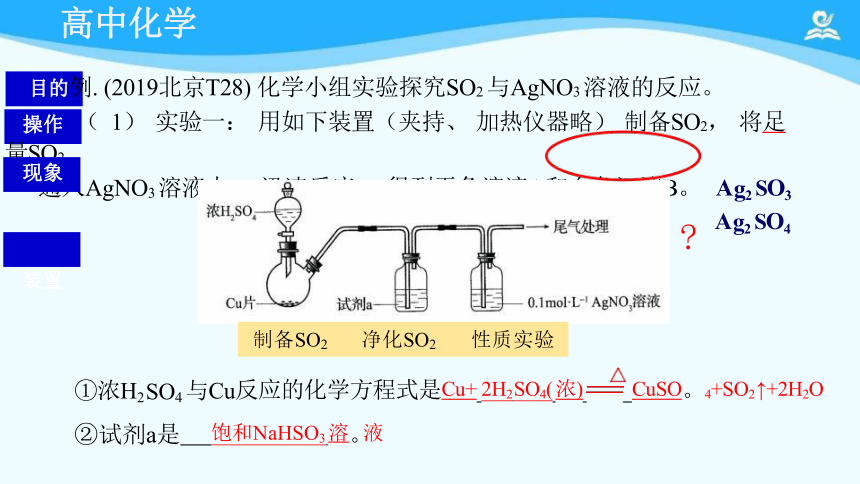
目的例. (2019北京T28) 化学小组实验探究SO2 与AgNO3 溶液的反应。
操作 ( 1) 实验一: 用如下装置(夹持、 加热仪器略) 制备SO2, 将足量SO2
通入AgNO3 溶液中, 迅速反应, 得到无色溶液A和白色沉淀B。
装置
4
3
O
O
S
S
2
2
g
g
A
A
①浓H2 SO4 与Cu反应的化学方程式是Cu+ 2H2 SO4( 浓) CuSO。4+SO2 ↑+2H2O
②试剂a是 饱和NaHSO3 溶。液
制备SO2 净化SO2 性质实验
现象
例. (2019北京T28) 化学小组实验探究SO2 与AgNO3 溶液的反应。
( 1) 实验一: 用如下装置(夹持、 加热仪器略) 制备SO2, 将足量SO2 通入AgNO3 溶液中, 迅速反应, 得到无色溶液A和白色沉淀B。
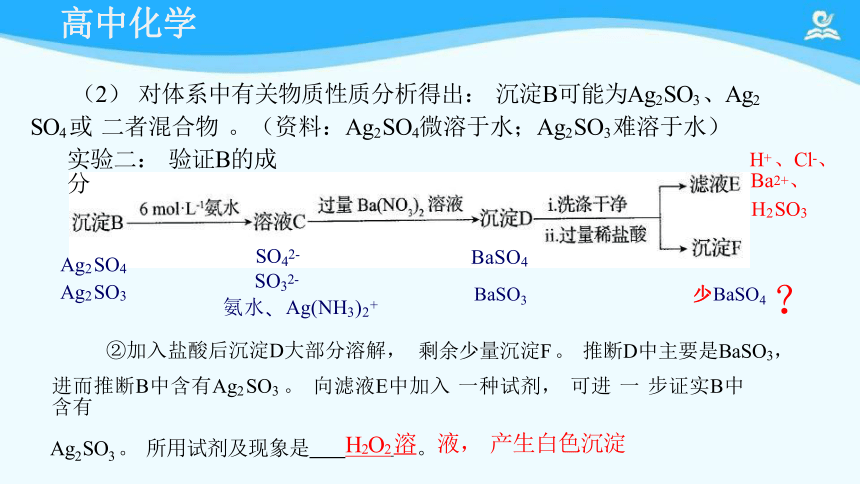
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2 SO3 、Ag2 SO4 或 二者混合物 。(资料:Ag2 SO4微溶于水;Ag2 SO3 难溶于水)
思考: 如果让你设计实验, 你将如何完成沉淀B的成分检验?
①加酸? ②加氧化剂? ③如何检验Ag2 SO4 ?
Ag+ 、NO3- 或O2 参与
Ag+ 和H2 SO3
高中化学
①写出Ag2 SO3 溶于氨水的离子方程式:Ag2 SO3+4NH3 ·H2O =2Ag(NH3)2+ + SO32- +4H2O
②加入盐酸后沉淀D大部分溶解, 剩余少量沉淀F 。 推断D中主要是BaSO3, 进而
推断B中含有Ag2 SO3 。 向滤液E中加入 一种试剂, 可进 一 步证实B中含有Ag2 SO3。
所用试剂及现象是 。
高中化学
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2 SO3 、Ag2 SO4 或 二者混合物 。(资料:Ag2 SO4微溶于水;Ag2 SO3 难溶于水)
Ag2SO4 + 4NH3 ·H2O = 2Ag(NH3)2+ + SO42- +4H2O
实验二: 验证B的成分
Ag2 SO4
Ag2 SO3
目的
高中化学
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2 SO3 、Ag2 SO4 或 二者混合物 。(资料:Ag2 SO4微溶于水;Ag2 SO3 难溶于水)
进而推断B中含有Ag2 SO3 。 向滤液E中加入 一种试剂, 可进 一 步证实B中含有
Ag2 SO3 。 所用试剂及现象是 H2O2 溶。液, 产生白色沉淀
BaSO4
BaSO3 少BaSO4 ?
剩余少量沉淀F 。 推断D中主要是BaSO3,
SO42-
SO32-
氨水、Ag(NH3)2+
②加入盐酸后沉淀D大部分溶解,
H+ 、Cl-、 Ba2+、
H2 SO3
实验二: 验证B的成分
Ag2 SO4
Ag2 SO3
①向溶液A中滴入过量盐酸, 产生白色沉淀, 证明溶液中含有 Ag+ ; 取上 层清液继续滴加BaCl2 溶液, 未 出 现白色沉淀, 可判断B中不含Ag2 SO4 。 做出判 断的理由: Ag2 SO4。溶解度大于BaSO4, 没有BaSO4 沉淀时, 必定没有Ag2 SO4
②实验三的结论: 。
少BaSO4
SO42- ?
SO32- 、 氨水
Ag2SO4? Ag SO
实验一: 将足量SO2 通入AgNO3 溶液中,
Ag2 SO3 迅速反应, 得到无色溶液A和白色沉淀B。
Ag+ 、NO3- 、H2SO3 、HSO3- 、SO32-
实验三: 探究SO42- 的产生途径
高中化学
实验二: 验证B的成分
少BaSO4
SO42-?
高中化学
实验二: 验证B的成分
Ag2 SO3 SO32- 、 氨水 主要BaSO3
少量BaSO4 少BaSO4
(3 ) 根据沉淀F的存在, 推测SO42- 的产生有两个途径:
途径1: 实验一 中, SO2在AgNO3 溶液中被氧化生成Ag2 SO4, 随沉淀B进入D。
途径2: 实验二 中,SO32-被氧化为SO42- 进入D。
目 实验三: 探究SO42- 的产生途径
的 ①向溶液A中滴入过量盐酸, 产生白色沉淀, 证明溶液中含有 Ag+ ; 取上 层清液继续滴加 碱性环境中+4价硫更易被氧化成SO42- 出判
断的理由: 。
②实验三的结论: 途径1 不产。生SO42- , 途径2产生SO42-
(4) 实验一 中SO2 与AgNO3 溶液反应的离子方程式 。
2Ag++ SO2 + H2O = Ag2 SO3 ↓ + 2H+
(5) 根据物质性质分析, SO2 与AgNO3 溶液应该可以发生氧化还原反
应 。 将实验一所得混合物放置 一段时间, 有Ag和SO42- 生成。
(6) 根据上述实验所得结论: 。
SO2 与AgNO3 溶液生成Ag2 SO3 的速率大于生成Ag和SO42- 的速率; 碱性溶液中SO32- 更易被氧化为SO42- 。
高中化学
硝酸银与二氧化硫
如何反应?
白色固体成分确定
SO42-
Ag
NOx
Ag2 SO4
Ag2 SO4 、Ag2 SO3
逻 辑 关 系
高中化学
Ag2 SO3
证据
目的
实验二: 验证B的成分 B中主要是Ag2 SO3
实验三: 探究实验二 中SO42- 的产生途径 B中不含Ag2 SO4
(4 ) 实验一 中SO2 与AgNO3 溶液反应的离子方 溶液C中SO32-被氧化为SO42- 进入D
高中化学
逻 辑 关 系
实验一: 将足量SO2 通入AgNO3 溶液中, 迅速反应, 得到无色溶液A和白色沉淀B。
(5 ) 根据物质性质分析, SO2 与AgNO3 溶液应该可以发生氧化还原反应 。 将实
验一 所得混合物放置 一段时间, 有Ag和SO42- 生成 。 生成Ag和SO42- 的速率慢
(6 ) 根据上述实验所得结论: 。
SO2 与AgNO3 溶液生成Ag2 SO3 的速率大于生成Ag和SO42- 的速率; 碱性溶液中SO32- 更易被氧化为SO42-。
固体B
Ag2 SO4 Ag2 SO3
氨水
沉淀D
主要BaSO3
少量BaSO4
Ag(NH3)2+、
SO32- 、SO42- 、 OH- 、NO3-
NH3 .H2O等
B主要Ag2 SO3
硝酸钡
Ag+ 、SO32- 、 SO42- 、H+ 、 NO3- 等
+4价硫在碱性环境更易被氧化
①过量盐酸
②取清液加氯化钡
设计过程环环相扣
严谨的印证思路
B不含Ag2 SO4
高中化学
证 方 法
再次确认
大多溶解
无沉淀
溶液A
H2O2
白沉
取
再次确认
白沉
H2O2
1. 还有什么方法可以确认B中的Ag2SO3?
Ag(NH3)2+、
SO32- 、S 42- 、 OH- 、NO3-
NH3 .H2O
Ag+ 、SO32- 、 S 42- 、H+ 、 NO3-
①过量盐酸
②取清液加氯化钡
沉淀D
主要BaSO3
少量BaSO4
B主要Ag2 SO3
B不含Ag2 SO4
固体B
Ag2 SO4 Ag2 SO3
高中化学
思考提升
×
大多溶解
硝酸钡
无沉淀
溶液A
氨水
高中化学
思考提升
2. SO2 通入0. 1 mol/L AgNO3 溶液, 能够快速得到Ag2 SO3 沉淀
而不是 Ag2 SO4 沉淀, 其本质原因是什么?
2AgNO3+ SO2 + H2O = Ag2 SO3 ↓ + 2HNO3
25 ℃ 时: Ksp(Ag2 SO3 )= 1.5×10- 14
Ksp(Ag2 SO4 )= 1.4×10-5
实验事实: 将实验一 所得混合物放置 一段时间, 有Ag和SO42- 生成。
慢
高中化学
思考提升
3. SO2 与0. 1 mol/L AgNO3 反应后的溶液在放置过程中, 哪些物质
会有可能参与对+4价硫的氧化? 产物会是什么?
2AgNO3+ SO2 + H2O = Ag2 SO3 ↓ + 2HNO3
实验事实: 将实验一 所得混合物放置 一段时间, 有Ag和SO42- 生成。
NO3- 、O2 、Ag+
4. SO2 通入0. 1 mol/L AgNO3 溶液, 能够快速得到Ag2 SO3 沉淀而不是 Ag2 SO4 沉淀, SO2 分别通入0. 1 mol/L BaCl2 和0. 1 mol/L Ba(NO3)2 溶液是否 也会发生类似的反应?
分别将2 mL 0.1 mol/L的BaCl2 溶液、Ba(NO3)2 溶液、AgNO3 溶液 加入盛装SO2 气体的试管中, 迅速密封 ,0~3 min的实验现象如下:
① ② ③ ① ② ③ ① ② ③
迅速产生大量白色沉淀
高中化学
思考提升
高中化学
SO2与0. 1 mol/L 的BaCl2溶液、 Ba(NO3)2溶液、 AgNO3溶液 反应现象的对比与 分析:
③中主要反应:2Ag++ SO2 + H2O = Ag2 SO3 ↓ + 2H+
①中3 min内未见明显现象:
思考:如何证明NO3-确实参与了反应呢 ?
该条件下 ,NO3- 可能参与了反应
该条件下 ,BaSO3 难以沉淀析出
① ② ③
0.1 mol/L
Ba(NO3)2 溶液
0.1 mol/L BaCl2 溶液
②中略有白色浑浊:
0.1 mol/L AgNO3 溶液
高中化学
将SO2 分别通入无氧和有氧 、 浓度均为0. 1 mol ·L - 1 的 BaCl2 溶液和Ba(NO3)2 溶液中, 实验记录如下:
BaCl2 溶液(无氧)中无白色沉淀,
BaCl2 溶液(有氧)中有白色沉淀;
Ba(NO3)2 溶液(无氧)中有白色沉淀, Ba(NO3)2 溶液(有氧)中有白色沉淀。
②在有氧环境时, SO2 气体通入0. 1 mol/L Ba(NO3)2 溶液, O2 的作用比NO3- 更明显, 且反应速率很快。
结论:① 0. 1 mol/L Ba(NO3)2 溶液中,NO3- 参与了反应。
3Ba2++ 3SO2 +2NO3- + 2H2O = 3BaSO4 ↓+2NO ↑ + 4H+
SO2 + H2O H2SO3 H+ + HSO3-
现象:
2Ba2++ 2SO2 + O2+ 2H2O = 2BaSO4 ↓ + 4H+
高中化学
SO2与0. 1 mol/L 的BaCl2溶液、 Ba(NO3)2溶液、 AgNO3溶液 反应现象的对比与 分析:
【资料信息】
Ksp (Ag2 SO3 )= 1.5×10- 14 Ksp (Ag2 SO4 ) = 1.4×10-5 Ksp (BaSO3 ) = 5.3×10-7 Ksp (BaSO4 ) = 1. 1×10- 10
③中主要反应:2Ag++ SO2 + H2O = Ag2 SO3 ↓ + 2H+
①中3min内未见明显现象:
① ② ③
0.1mol/L
Ba(NO3)2 溶液
该条件下 ,BaSO3 难以沉淀
白色浑浊应主要为BaSO4
②中略有白色浑浊:
0.1mol/L BaCl2 溶液
0.1mol/L AgNO3 溶液
② SO2 与0. 1 mol/L Ba(NO3)2 溶液的反应中NO3- 能参与反应;
③ 由于Ag2 SO3 的溶解性特点导致SO2 与0. 1 mol/L AgNO3 的复分解反应
很明显,但最终依然还是发生了氧化还原反应;
④ 在完成以上实验时, 不能忽视氧气的参与。
能力收获:
探究实验的设计要科学、严谨、 精细、 可行。
高中化学
课堂小结
知识收获:
① SO2 与0. 1 mol/L BaCl2 溶液很难反应生成BaSO3;
0.5 mol/L BaCl2 溶液? 饱和BaCl2 溶液?
谢谢同学们的收看!
祝同学们学业进步!
高中化学
探究性化学实验专题(三)
高中化学
学习目标
( 1) 通过对SO2 与AgNO3 溶液反应的典型事例分析, 发展对实验现象
和数据进行缜密分析和推理的能力, 并能用恰当的形式进行表达和归纳;
(2) 明确SO2 与AgNO3 溶液反应的实验探究过程中的实验目的、 实验
设计、 证据获取和结论总结之间的逻辑关系 ,厘清探究过程中的物质转化 关系, 认识实验中的取证措施和具体意义;
(3) 强化实验探究分析过程中的问题意识, 能对异常现象作出预测和
假设, 能依据实验目的和假设, 设计解决问题的实验方案, 并能对实验方 案进行合理评价和反思。
高中化学
目的例. (2019北京T28) 化学小组实验探究SO2 与AgNO3 溶液的反应。
操作 ( 1) 实验一: 用如下装置(夹持、 加热仪器略) 制备SO2, 将足量SO2
通入AgNO3 溶液中, 迅速反应, 得到无色溶液A和白色沉淀B。
装置
4
3
O
O
S
S
2
2
g
g
A
A
①浓H2 SO4 与Cu反应的化学方程式是Cu+ 2H2 SO4( 浓) CuSO。4+SO2 ↑+2H2O
②试剂a是 饱和NaHSO3 溶。液
制备SO2 净化SO2 性质实验
现象
例. (2019北京T28) 化学小组实验探究SO2 与AgNO3 溶液的反应。
( 1) 实验一: 用如下装置(夹持、 加热仪器略) 制备SO2, 将足量SO2 通入AgNO3 溶液中, 迅速反应, 得到无色溶液A和白色沉淀B。
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2 SO3 、Ag2 SO4 或 二者混合物 。(资料:Ag2 SO4微溶于水;Ag2 SO3 难溶于水)
思考: 如果让你设计实验, 你将如何完成沉淀B的成分检验?
①加酸? ②加氧化剂? ③如何检验Ag2 SO4 ?
Ag+ 、NO3- 或O2 参与
Ag+ 和H2 SO3
高中化学
①写出Ag2 SO3 溶于氨水的离子方程式:Ag2 SO3+4NH3 ·H2O =2Ag(NH3)2+ + SO32- +4H2O
②加入盐酸后沉淀D大部分溶解, 剩余少量沉淀F 。 推断D中主要是BaSO3, 进而
推断B中含有Ag2 SO3 。 向滤液E中加入 一种试剂, 可进 一 步证实B中含有Ag2 SO3。
所用试剂及现象是 。
高中化学
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2 SO3 、Ag2 SO4 或 二者混合物 。(资料:Ag2 SO4微溶于水;Ag2 SO3 难溶于水)
Ag2SO4 + 4NH3 ·H2O = 2Ag(NH3)2+ + SO42- +4H2O
实验二: 验证B的成分
Ag2 SO4
Ag2 SO3
目的
高中化学
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2 SO3 、Ag2 SO4 或 二者混合物 。(资料:Ag2 SO4微溶于水;Ag2 SO3 难溶于水)
进而推断B中含有Ag2 SO3 。 向滤液E中加入 一种试剂, 可进 一 步证实B中含有
Ag2 SO3 。 所用试剂及现象是 H2O2 溶。液, 产生白色沉淀
BaSO4
BaSO3 少BaSO4 ?
剩余少量沉淀F 。 推断D中主要是BaSO3,
SO42-
SO32-
氨水、Ag(NH3)2+
②加入盐酸后沉淀D大部分溶解,
H+ 、Cl-、 Ba2+、
H2 SO3
实验二: 验证B的成分
Ag2 SO4
Ag2 SO3
①向溶液A中滴入过量盐酸, 产生白色沉淀, 证明溶液中含有 Ag+ ; 取上 层清液继续滴加BaCl2 溶液, 未 出 现白色沉淀, 可判断B中不含Ag2 SO4 。 做出判 断的理由: Ag2 SO4。溶解度大于BaSO4, 没有BaSO4 沉淀时, 必定没有Ag2 SO4
②实验三的结论: 。
少BaSO4
SO42- ?
SO32- 、 氨水
Ag2SO4? Ag SO
实验一: 将足量SO2 通入AgNO3 溶液中,
Ag2 SO3 迅速反应, 得到无色溶液A和白色沉淀B。
Ag+ 、NO3- 、H2SO3 、HSO3- 、SO32-
实验三: 探究SO42- 的产生途径
高中化学
实验二: 验证B的成分
少BaSO4
SO42-?
高中化学
实验二: 验证B的成分
Ag2 SO3 SO32- 、 氨水 主要BaSO3
少量BaSO4 少BaSO4
(3 ) 根据沉淀F的存在, 推测SO42- 的产生有两个途径:
途径1: 实验一 中, SO2在AgNO3 溶液中被氧化生成Ag2 SO4, 随沉淀B进入D。
途径2: 实验二 中,SO32-被氧化为SO42- 进入D。
目 实验三: 探究SO42- 的产生途径
的 ①向溶液A中滴入过量盐酸, 产生白色沉淀, 证明溶液中含有 Ag+ ; 取上 层清液继续滴加 碱性环境中+4价硫更易被氧化成SO42- 出判
断的理由: 。
②实验三的结论: 途径1 不产。生SO42- , 途径2产生SO42-
(4) 实验一 中SO2 与AgNO3 溶液反应的离子方程式 。
2Ag++ SO2 + H2O = Ag2 SO3 ↓ + 2H+
(5) 根据物质性质分析, SO2 与AgNO3 溶液应该可以发生氧化还原反
应 。 将实验一所得混合物放置 一段时间, 有Ag和SO42- 生成。
(6) 根据上述实验所得结论: 。
SO2 与AgNO3 溶液生成Ag2 SO3 的速率大于生成Ag和SO42- 的速率; 碱性溶液中SO32- 更易被氧化为SO42- 。
高中化学
硝酸银与二氧化硫
如何反应?
白色固体成分确定
SO42-
Ag
NOx
Ag2 SO4
Ag2 SO4 、Ag2 SO3
逻 辑 关 系
高中化学
Ag2 SO3
证据
目的
实验二: 验证B的成分 B中主要是Ag2 SO3
实验三: 探究实验二 中SO42- 的产生途径 B中不含Ag2 SO4
(4 ) 实验一 中SO2 与AgNO3 溶液反应的离子方 溶液C中SO32-被氧化为SO42- 进入D
高中化学
逻 辑 关 系
实验一: 将足量SO2 通入AgNO3 溶液中, 迅速反应, 得到无色溶液A和白色沉淀B。
(5 ) 根据物质性质分析, SO2 与AgNO3 溶液应该可以发生氧化还原反应 。 将实
验一 所得混合物放置 一段时间, 有Ag和SO42- 生成 。 生成Ag和SO42- 的速率慢
(6 ) 根据上述实验所得结论: 。
SO2 与AgNO3 溶液生成Ag2 SO3 的速率大于生成Ag和SO42- 的速率; 碱性溶液中SO32- 更易被氧化为SO42-。
固体B
Ag2 SO4 Ag2 SO3
氨水
沉淀D
主要BaSO3
少量BaSO4
Ag(NH3)2+、
SO32- 、SO42- 、 OH- 、NO3-
NH3 .H2O等
B主要Ag2 SO3
硝酸钡
Ag+ 、SO32- 、 SO42- 、H+ 、 NO3- 等
+4价硫在碱性环境更易被氧化
①过量盐酸
②取清液加氯化钡
设计过程环环相扣
严谨的印证思路
B不含Ag2 SO4
高中化学
证 方 法
再次确认
大多溶解
无沉淀
溶液A
H2O2
白沉
取
再次确认
白沉
H2O2
1. 还有什么方法可以确认B中的Ag2SO3?
Ag(NH3)2+、
SO32- 、S 42- 、 OH- 、NO3-
NH3 .H2O
Ag+ 、SO32- 、 S 42- 、H+ 、 NO3-
①过量盐酸
②取清液加氯化钡
沉淀D
主要BaSO3
少量BaSO4
B主要Ag2 SO3
B不含Ag2 SO4
固体B
Ag2 SO4 Ag2 SO3
高中化学
思考提升
×
大多溶解
硝酸钡
无沉淀
溶液A
氨水
高中化学
思考提升
2. SO2 通入0. 1 mol/L AgNO3 溶液, 能够快速得到Ag2 SO3 沉淀
而不是 Ag2 SO4 沉淀, 其本质原因是什么?
2AgNO3+ SO2 + H2O = Ag2 SO3 ↓ + 2HNO3
25 ℃ 时: Ksp(Ag2 SO3 )= 1.5×10- 14
Ksp(Ag2 SO4 )= 1.4×10-5
实验事实: 将实验一 所得混合物放置 一段时间, 有Ag和SO42- 生成。
慢
高中化学
思考提升
3. SO2 与0. 1 mol/L AgNO3 反应后的溶液在放置过程中, 哪些物质
会有可能参与对+4价硫的氧化? 产物会是什么?
2AgNO3+ SO2 + H2O = Ag2 SO3 ↓ + 2HNO3
实验事实: 将实验一 所得混合物放置 一段时间, 有Ag和SO42- 生成。
NO3- 、O2 、Ag+
4. SO2 通入0. 1 mol/L AgNO3 溶液, 能够快速得到Ag2 SO3 沉淀而不是 Ag2 SO4 沉淀, SO2 分别通入0. 1 mol/L BaCl2 和0. 1 mol/L Ba(NO3)2 溶液是否 也会发生类似的反应?
分别将2 mL 0.1 mol/L的BaCl2 溶液、Ba(NO3)2 溶液、AgNO3 溶液 加入盛装SO2 气体的试管中, 迅速密封 ,0~3 min的实验现象如下:
① ② ③ ① ② ③ ① ② ③
迅速产生大量白色沉淀
高中化学
思考提升
高中化学
SO2与0. 1 mol/L 的BaCl2溶液、 Ba(NO3)2溶液、 AgNO3溶液 反应现象的对比与 分析:
③中主要反应:2Ag++ SO2 + H2O = Ag2 SO3 ↓ + 2H+
①中3 min内未见明显现象:
思考:如何证明NO3-确实参与了反应呢 ?
该条件下 ,NO3- 可能参与了反应
该条件下 ,BaSO3 难以沉淀析出
① ② ③
0.1 mol/L
Ba(NO3)2 溶液
0.1 mol/L BaCl2 溶液
②中略有白色浑浊:
0.1 mol/L AgNO3 溶液
高中化学
将SO2 分别通入无氧和有氧 、 浓度均为0. 1 mol ·L - 1 的 BaCl2 溶液和Ba(NO3)2 溶液中, 实验记录如下:
BaCl2 溶液(无氧)中无白色沉淀,
BaCl2 溶液(有氧)中有白色沉淀;
Ba(NO3)2 溶液(无氧)中有白色沉淀, Ba(NO3)2 溶液(有氧)中有白色沉淀。
②在有氧环境时, SO2 气体通入0. 1 mol/L Ba(NO3)2 溶液, O2 的作用比NO3- 更明显, 且反应速率很快。
结论:① 0. 1 mol/L Ba(NO3)2 溶液中,NO3- 参与了反应。
3Ba2++ 3SO2 +2NO3- + 2H2O = 3BaSO4 ↓+2NO ↑ + 4H+
SO2 + H2O H2SO3 H+ + HSO3-
现象:
2Ba2++ 2SO2 + O2+ 2H2O = 2BaSO4 ↓ + 4H+
高中化学
SO2与0. 1 mol/L 的BaCl2溶液、 Ba(NO3)2溶液、 AgNO3溶液 反应现象的对比与 分析:
【资料信息】
Ksp (Ag2 SO3 )= 1.5×10- 14 Ksp (Ag2 SO4 ) = 1.4×10-5 Ksp (BaSO3 ) = 5.3×10-7 Ksp (BaSO4 ) = 1. 1×10- 10
③中主要反应:2Ag++ SO2 + H2O = Ag2 SO3 ↓ + 2H+
①中3min内未见明显现象:
① ② ③
0.1mol/L
Ba(NO3)2 溶液
该条件下 ,BaSO3 难以沉淀
白色浑浊应主要为BaSO4
②中略有白色浑浊:
0.1mol/L BaCl2 溶液
0.1mol/L AgNO3 溶液
② SO2 与0. 1 mol/L Ba(NO3)2 溶液的反应中NO3- 能参与反应;
③ 由于Ag2 SO3 的溶解性特点导致SO2 与0. 1 mol/L AgNO3 的复分解反应
很明显,但最终依然还是发生了氧化还原反应;
④ 在完成以上实验时, 不能忽视氧气的参与。
能力收获:
探究实验的设计要科学、严谨、 精细、 可行。
高中化学
课堂小结
知识收获:
① SO2 与0. 1 mol/L BaCl2 溶液很难反应生成BaSO3;
0.5 mol/L BaCl2 溶液? 饱和BaCl2 溶液?
谢谢同学们的收看!
祝同学们学业进步!
高中化学
同课章节目录
