影响化学反应速率的因素 课件(共22张PPT)
文档属性
| 名称 | 影响化学反应速率的因素 课件(共22张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 314.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 20:59:58 | ||
图片预览








文档简介
(共22张PPT)
探究影响化学反应速率的因素
【学习目标】
⑴理解外界条件对反应速率的影响;
⑵会设计实验证明条件对反应速率的影响,
有证据推理能力;
⑶具备一定的识图、析图、画图能力。
一、影响化学反应速率的因素
内因: 物质本身的性质
元素的非金属性不同
物质的化学性质的强弱不同
物质的稳定性不同
H2 + F2 == 2HF (阴暗处爆炸)
H2 + I2 2HI (持续加热)
不同反应速率对比:
一、影响化学反应速率的因素
外因: 外部条件
N2 + 3H2 2NH3
Zn+H2SO4==ZnSO4+H2 ↑
反应物浓度、温度、
压强、催化剂、
接触面积等
不同条件下反应速率对比:
一、影响化学反应速率的因素
内因: 物质本身的性质
外因: 外部条件
研究影响化学反应速率的因素, 有何意义呢?
如何设计实验 、 寻找证据,探究或验证这些 因素对化学反应速率的影响呢?
反应物浓度、温度、压
强、催化剂、
接触面积等
【思考】
一、影响化学反应速率的因素
1、温度对反应速率的影响
思考:
选择什么 样的实验素材好? 如何设计实验操作?
在实验过程中如何寻找证据?
好操作、现象明显、无危险、无毒等
1、温度对化学反应速率的影响
Na2S2O3 + H2SO4==Na2SO4 + SO2 ↑+ S↓+H2O
思考:
你想通过什么现象验证温度对速率的 影响?
你准备选择多大浓度的反应物进行 实验?
如何操作能达到最佳的对比效果呢?
证据寻找:出现浑浊的时间
实验操作 ① ② 出现浑浊的时间 后
先
实验结论 其他条件相同,升高温度,
1、温度对化学反应速率的影响
Na2S2O3 + H2SO4==Na2SO4 + SO2 ↑+ S↓+H2O
可以增加化学反应速率
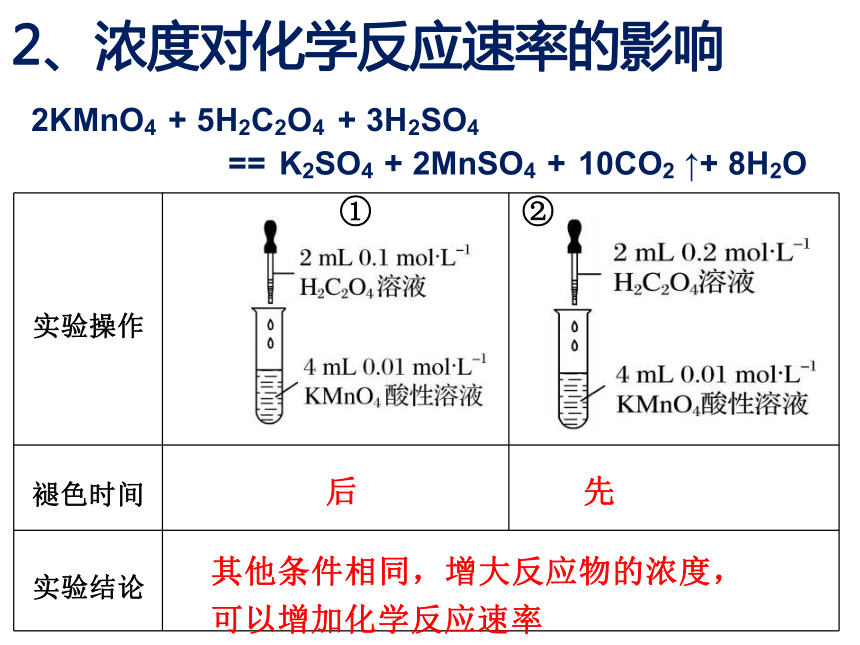
2、浓度对化学反应速率的影响
2KMnO4 + 5H2C2O4 + 3H2SO4
== K2SO4 + 2MnSO4 + 10CO2 ↑+ 8H2O
实验现象: 溶液的紫色变浅或褪去
证据寻找: 溶液的紫色褪去所需时间
思考:
如何控制变量?
三种反应物的浓度和体积如何设计?
实验操作 ①
②
褪色时间 后
先
实验结论 其他条件相同,增大反应物的浓度,
2、浓度对化学反应速率的影响
2KMnO4 + 5H2C2O4 + 3H2SO4
== K2SO4 + 2MnSO4 + 10CO2 ↑+ 8H2O
可以增加化学反应速率
单位体积内反应物的碰撞几率大
——→ 化学反应速率增加
浓度越高,反应速率越快。
原因:
增大反应物浓度
思考:
对于气态反应环 境 , 压缩体积使反应 体系的压强增大 , 是不是相当于增大 了反应物浓度呢?
结论:其他条件相同,压缩体积增大气态反
应环境的压强,可以增加化学反应速率。
3、压强对反应速率的影响
实验操作
实现现象
未加入MnO2时,带余烬的木条无明显变化;加入MnO2后,
锥形瓶内立即产生大量气泡,并且带余烬的木条复燃。
实验结论
MnO2能加快H2O2 的分解
4、催化剂对化学反应速率的影响
【P22实验探究】 2H2O2 MnO 2H2O + O2
2
加入试剂 0.1mol/L FeCl3
0.1mol/L CuSO4
产生气泡快慢 快
慢
实验结论
【P23实验探究】
实验① :
4、催化剂对化学反应速率的影响
不同催化剂对过氧化氢分解速率的影响
2H2O + O2
2H2O2
MnO2
实验 操作 产生气泡 快慢 快
气泡不明显
实验结论 Fe3+能加快H2O2 的分解
4、催化剂对化学反应速率的影响
P23:探究①的实验改进:
实验 操作 产生气 泡快慢 快 慢 不明显
无
实验 结论 Cu2+ 、Fe3+对H2O2分解都有催化作用, 且Fe3+催化作用较强
4、催化剂对化学反应速率的影响
P23:探究①的实验改进
实验操作 ①
②
褪色时间 慢
快
实验结论 硫酸锰对该反应有催化作用
P23:实验探究
实验② :
硫酸锰对草酸与高锰酸钾反应速率的影响
2KMnO4 + 5H2C2O4 + 3H2SO4
== K2SO4 + 2MnSO4 + 10CO2 ↑+ 8H2O
加入试剂 5mL淀粉溶液+ 2滴碘+1mL2mol/L 硫酸
5mL淀粉溶液+
2滴碘+1mL唾液
蓝色退去快慢
结 论
P23:实验探究
实验③ :
不同催化剂对淀粉水解速率的影响
6 、其它因素
光辐射、超声波、放射线辐射、
电磁波、电弧等。
固体反应物的表面积越大,则反应速率越快。
5 、接触面积对反应速率的影响
思考:
如何将条件对化学反应速率的影响以 图象形式展现出来呢?
如何分析实际反应过程中的速率变化 呢?
2H2O + O2
2H2O2
MnO2
二、有关反应速率的图像分析
例1 .某同学向H2SO4和H2O2 的混合溶液中滴加一 定量的KMnO4溶液,完成反应: 5H2O2+2KMnO4 + 3H2SO4===K2SO4+2MnSO4+8H2O+5O2 ↑ 。该学生 在实验前认为,反应过程溶液中c(Mn2+)与时间
做完实验后,得到的结果为
Mn2+达到一定浓度时,
的关系如图①所示, 图②所示。试分析:
ab段突然变陡的原因可能是 对上述反应起 了催化作用
浓度、
温度、 催化剂
例2 .将一块质量为5.0 g的铝片投入盛有500 mL 0.5 mol · L-1硫酸溶液的烧杯中,反应产生氢气的 速率与反应时间的关系如图所示,试回答:
(1)曲线O→a段不产生氢气的原因可能是
。
(2 的速率加快的主要原因
产生氢气
______
可能是 。
(4)曲线b点以后产生氢气的 速率逐渐下降的主要原因 可能是 。
浓度、温度、催化剂
【作业】
1、细读教材第二节内容,归纳和总结
影响化学反应速率的因素,认真分 析教材实验的设计原理;
2、认真完成课后作业,加深对本节
知识的理解。
【注意】
阅读、听课及做作业过程中出现的问题,
可以在班级群里进行讨论。
探究影响化学反应速率的因素
【学习目标】
⑴理解外界条件对反应速率的影响;
⑵会设计实验证明条件对反应速率的影响,
有证据推理能力;
⑶具备一定的识图、析图、画图能力。
一、影响化学反应速率的因素
内因: 物质本身的性质
元素的非金属性不同
物质的化学性质的强弱不同
物质的稳定性不同
H2 + F2 == 2HF (阴暗处爆炸)
H2 + I2 2HI (持续加热)
不同反应速率对比:
一、影响化学反应速率的因素
外因: 外部条件
N2 + 3H2 2NH3
Zn+H2SO4==ZnSO4+H2 ↑
反应物浓度、温度、
压强、催化剂、
接触面积等
不同条件下反应速率对比:
一、影响化学反应速率的因素
内因: 物质本身的性质
外因: 外部条件
研究影响化学反应速率的因素, 有何意义呢?
如何设计实验 、 寻找证据,探究或验证这些 因素对化学反应速率的影响呢?
反应物浓度、温度、压
强、催化剂、
接触面积等
【思考】
一、影响化学反应速率的因素
1、温度对反应速率的影响
思考:
选择什么 样的实验素材好? 如何设计实验操作?
在实验过程中如何寻找证据?
好操作、现象明显、无危险、无毒等
1、温度对化学反应速率的影响
Na2S2O3 + H2SO4==Na2SO4 + SO2 ↑+ S↓+H2O
思考:
你想通过什么现象验证温度对速率的 影响?
你准备选择多大浓度的反应物进行 实验?
如何操作能达到最佳的对比效果呢?
证据寻找:出现浑浊的时间
实验操作 ① ② 出现浑浊的时间 后
先
实验结论 其他条件相同,升高温度,
1、温度对化学反应速率的影响
Na2S2O3 + H2SO4==Na2SO4 + SO2 ↑+ S↓+H2O
可以增加化学反应速率
2、浓度对化学反应速率的影响
2KMnO4 + 5H2C2O4 + 3H2SO4
== K2SO4 + 2MnSO4 + 10CO2 ↑+ 8H2O
实验现象: 溶液的紫色变浅或褪去
证据寻找: 溶液的紫色褪去所需时间
思考:
如何控制变量?
三种反应物的浓度和体积如何设计?
实验操作 ①
②
褪色时间 后
先
实验结论 其他条件相同,增大反应物的浓度,
2、浓度对化学反应速率的影响
2KMnO4 + 5H2C2O4 + 3H2SO4
== K2SO4 + 2MnSO4 + 10CO2 ↑+ 8H2O
可以增加化学反应速率
单位体积内反应物的碰撞几率大
——→ 化学反应速率增加
浓度越高,反应速率越快。
原因:
增大反应物浓度
思考:
对于气态反应环 境 , 压缩体积使反应 体系的压强增大 , 是不是相当于增大 了反应物浓度呢?
结论:其他条件相同,压缩体积增大气态反
应环境的压强,可以增加化学反应速率。
3、压强对反应速率的影响
实验操作
实现现象
未加入MnO2时,带余烬的木条无明显变化;加入MnO2后,
锥形瓶内立即产生大量气泡,并且带余烬的木条复燃。
实验结论
MnO2能加快H2O2 的分解
4、催化剂对化学反应速率的影响
【P22实验探究】 2H2O2 MnO 2H2O + O2
2
加入试剂 0.1mol/L FeCl3
0.1mol/L CuSO4
产生气泡快慢 快
慢
实验结论
【P23实验探究】
实验① :
4、催化剂对化学反应速率的影响
不同催化剂对过氧化氢分解速率的影响
2H2O + O2
2H2O2
MnO2
实验 操作 产生气泡 快慢 快
气泡不明显
实验结论 Fe3+能加快H2O2 的分解
4、催化剂对化学反应速率的影响
P23:探究①的实验改进:
实验 操作 产生气 泡快慢 快 慢 不明显
无
实验 结论 Cu2+ 、Fe3+对H2O2分解都有催化作用, 且Fe3+催化作用较强
4、催化剂对化学反应速率的影响
P23:探究①的实验改进
实验操作 ①
②
褪色时间 慢
快
实验结论 硫酸锰对该反应有催化作用
P23:实验探究
实验② :
硫酸锰对草酸与高锰酸钾反应速率的影响
2KMnO4 + 5H2C2O4 + 3H2SO4
== K2SO4 + 2MnSO4 + 10CO2 ↑+ 8H2O
加入试剂 5mL淀粉溶液+ 2滴碘+1mL2mol/L 硫酸
5mL淀粉溶液+
2滴碘+1mL唾液
蓝色退去快慢
结 论
P23:实验探究
实验③ :
不同催化剂对淀粉水解速率的影响
6 、其它因素
光辐射、超声波、放射线辐射、
电磁波、电弧等。
固体反应物的表面积越大,则反应速率越快。
5 、接触面积对反应速率的影响
思考:
如何将条件对化学反应速率的影响以 图象形式展现出来呢?
如何分析实际反应过程中的速率变化 呢?
2H2O + O2
2H2O2
MnO2
二、有关反应速率的图像分析
例1 .某同学向H2SO4和H2O2 的混合溶液中滴加一 定量的KMnO4溶液,完成反应: 5H2O2+2KMnO4 + 3H2SO4===K2SO4+2MnSO4+8H2O+5O2 ↑ 。该学生 在实验前认为,反应过程溶液中c(Mn2+)与时间
做完实验后,得到的结果为
Mn2+达到一定浓度时,
的关系如图①所示, 图②所示。试分析:
ab段突然变陡的原因可能是 对上述反应起 了催化作用
浓度、
温度、 催化剂
例2 .将一块质量为5.0 g的铝片投入盛有500 mL 0.5 mol · L-1硫酸溶液的烧杯中,反应产生氢气的 速率与反应时间的关系如图所示,试回答:
(1)曲线O→a段不产生氢气的原因可能是
。
(2 的速率加快的主要原因
产生氢气
______
可能是 。
(4)曲线b点以后产生氢气的 速率逐渐下降的主要原因 可能是 。
浓度、温度、催化剂
【作业】
1、细读教材第二节内容,归纳和总结
影响化学反应速率的因素,认真分 析教材实验的设计原理;
2、认真完成课后作业,加深对本节
知识的理解。
【注意】
阅读、听课及做作业过程中出现的问题,
可以在班级群里进行讨论。
