福建省龙岩市一级校联考2023-2024学年高一上学期11月期中考试化学试题(含答案)
文档属性
| 名称 | 福建省龙岩市一级校联考2023-2024学年高一上学期11月期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 704.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 15:36:01 | ||
图片预览


文档简介
龙岩市一级校联考2023-2024学年高一上学期11月期中考试
化学试题
(考试时间:75分钟 总分:100分)
可能用到的相对原子质量:
第Ⅰ卷 选择题(共42分)
一、选择题(本大题共14小题,每小题3分,共42分.在每小题所列出的四个选项中,只有一项是最符合题目要求的)
1.下列说法中不正确的是( )
A.研究物质性质,常用观察、实验、分类、比较等方法
B.中国科学家合成的结晶牛胰岛素是一种蛋白质
C.拉瓦锡提出原子学说,为近代化学的发展奠定了坚实的基础
D.阿伏加德罗提出分子学说,对物质结构的认识发展到一个新的阶段
2.下列变化中需要加入氧化剂才能实现的是( )
A. B. C. D.
3.下列说法不正确的是( )
①氢气能在氯气中燃烧,生成白色烟雾 ②铜丝在氣气中燃烧,生成黄绿色的烟 ③液氯、氯水都是混合物 ④久置的氯水,溶液增大
A.②③ B.①② C.①③④ D.①②③④
4.下列物质分类的正确组合是( )
碱 酸 盐 碱性氧化物 酸性氧化物
A
B
C
D
A.A B.B C.C D.D
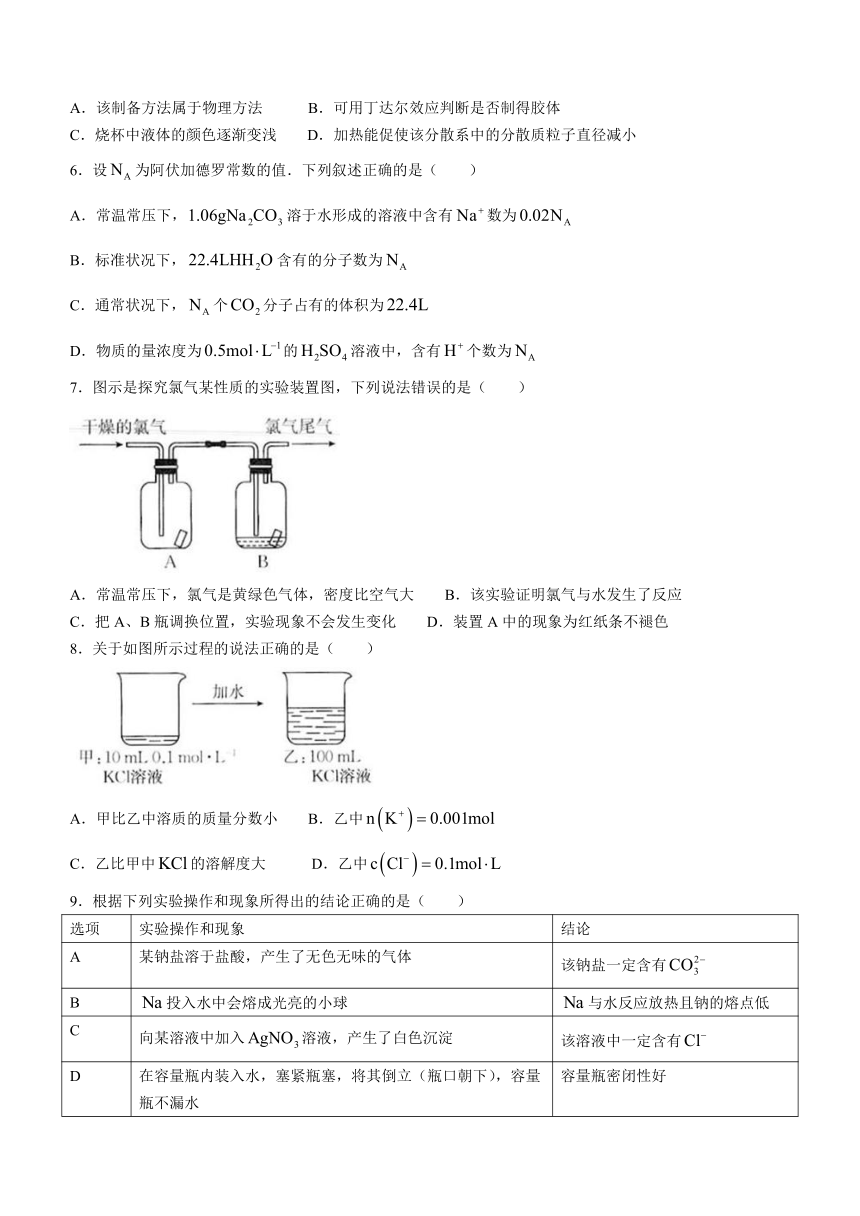
5.图示为实验室中制备胶体的一种方法.下列说法正确的是( )
A.该制备方法属于物理方法 B.可用丁达尔效应判断是否制得胶体
C.烧杯中液体的颜色逐渐变浅 D.加热能促使该分散系中的分散质粒子直径减小
6.设为阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下,溶于水形成的溶液中含有数为
B.标准状况下,含有的分子数为
C.通常状况下,个分子占有的体积为
D.物质的量浓度为的溶液中,含有个数为
7.图示是探究氯气某性质的实验装置图,下列说法错误的是( )
A.常温常压下,氯气是黄绿色气体,密度比空气大 B.该实验证明氯气与水发生了反应
C.把A、B瓶调换位置,实验现象不会发生变化 D.装置A中的现象为红纸条不褪色
8.关于如图所示过程的说法正确的是( )
A.甲比乙中溶质的质量分数小 B.乙中
C.乙比甲中的溶解度大 D.乙中
9.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A 某钠盐溶于盐酸,产生了无色无味的气体 该钠盐一定含有
B 投入水中会熔成光亮的小球 与水反应放热且钠的熔点低
C 向某溶液中加入溶液,产生了白色沉淀 该溶液中一定含有
D 在容量瓶内装入水,塞紧瓶塞,将其倒立(瓶口朝下),容量瓶不漏水 容量瓶密闭性好
A.A B.B C.C D.D
10.实验室需要配制一种仅含四种离子(忽略水电离出的离子)的无色混合溶液,且各离子的物质的量浓度均为,能配制成功的是( )
A. B.
C. D.
11.下列两种气体的分子数一定相等的是( )
A.质量相等、密度不等的和 B.等压等体积的和
C.等温等体积的和 D.不同体积等密度的和
12.是一种可用于生产颜料、木材防腐剂等的化工产品.将铜粉加入稀盐酸中,并持续通入空气,在的催化作用下可生成,过程如图所示.下列说法不正确的是( )
A.可循环使用 B.过程Ⅰ的反应为
C.过程Ⅱ中的氧化剂为 D.该过程总反应为
13.粗食盐水中常含有少量杂质离子,实验室提纯粗食盐水制取食盐的流程如下.
关于实验过程中所选用的试剂、目的及所发生反应的离子方程式均正确的是( )
选项 试剂 目的 离子方程式
A 溶液 仅除去
B 溶液 仅除去
C 溶液 仅除去
D 盐酸 除去和
A.A B.B C.C D.D
14.与一定量完全反应后,生成固体产物.则产物中与的物质的量之比为( )
A. B. C. D.无法确定
第Ⅱ卷 非选择题(共58分)
二、填空题(本大题共4小题,共58分)
15.(14分)化学与生产、生活、环境息息相关.从化学视角回答下列问题:
Ⅰ.现有中学化学中常见的几种物质:①氢氧化钠固体 ②铁丝 ③纯醋酸 ④二氧化碳气体 ⑤碳酸钠粉末 ⑥蔗糖 ⑦熔融氯化钠.
(1)上述状态下可导电的有___________,属于非电解质的是___________.(用序号填空)
(2)写出⑤在水溶液中的电离方程式:____________________________________.
(3)写出将少量④通入①溶液发生反应的离子方程式:___________________________________.
Ⅱ.我国科学家研发了一种室温下“可呼吸”的充电电池.电池的总反应为.
(4)用单线桥表示此反应中电子转移的方向和数目:.
(5)含有___________个原子.
(6)该电池中不能存在水,否则可能引起电池爆炸,用离子方程式表示其原因:_____________________________________________________.
16.(14分)配制溶液及应用.
Ⅰ.实验小组同学需要配制溶液.
(1)需要称取的质量为___________g.
(2)该实验小组同学在实验室中找到了下列仪器.
①为了完成实验,还缺少的玻璃仪器是___________.
②在操作步骤“转移”中,玻璃棒的作用是__________________________.
(3)配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是___________(填序号).
a.转移时有少量溶液洒出
b.转移后未用蒸馏水洗涤烧杯
C.定容时俯视刻度线
(4)用以上配制的溶液制备84消毒液,其原理是_______________________________________________(用离子方程式表示).
Ⅱ.分别用不同体积的溶液、溶液和水配制以下3组溶液(假设溶液体积具有加和性).
编号 溶液 溶液 水
浓度/ 浓度/
1 10.0 1.0 10.0 1.0 0
2 4.0 0.2 0.4 28.0
3 12.0 c 8.0 0.4 20.0
则___________,___________.
17.(16分)过氧化钠是一种常见的氧化物,具有强氧化性和漂白性,通常可用作漂白剂和供氧剂.现有一定量含有杂质的试样,用如图所示实验装置测定试样的纯度.(可供选用的试剂只有块状固体、盐酸、硫酸和蒸馏水)
回答下列问题:
(1)过氧化钠为___________色的固体,其阴、阳离子个数比为___________.
(2)仪器a的名称是___________,写出和反应的化学方程式:_______________________________________________________.
(3)装置A中液体试剂选用___________,装置D中碱石灰的作用是_________________________________________________________________.
(4)若开始时测得样品的质量为,反应结束后测得气体体积为(标准状况),则试样的纯度为___________%.
(5)甲同学提出,去除B装置,对测定结果无影响,请你说明甲同学的理由:______________________________________________________.
18.(14分)某实验小组欲通过加热蒸发硝酸钾溶液的方法获得固体.已知固体在一定温度下能发生反应:.为了探究加热蒸发所得固体X中是否含有亚硝酸钾,小组同学设计并完成了以下实验.
【查阅资料】
i.是微溶于水的白色(略带黄色)固体
ii.能在酸性条件下与反应,生成
【实验过程】
【分析解释】
(1)中N的化合价是___________,从化合价的角度预测,具有的性质是___________(填标号).
A.只有氧化性 B.只有还原性 C.既有氧化性,又有还原性
(2)试管①中,观察到有少量白色沉淀生成,该白色沉淀是___________(填化学式).
(3)试管②中,观察到的现象是____________________________;发生___________(填“氧化”或“还原”)反应.
(4)试管③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响.该反应的离子方程式为.该实验选择新制氯水的原因有二:一是具有强氧化性,二是___________.
【反思评价】
(5)综合上述实验,甲同学得出以下结论.你认为甲同学所得结论正确的是___________(填标号).
a.从试管②中的现象可得出酸性条件下,氧化性:
b.试管①和③中的实验现象均可以证明固体X中含有
龙岩市一级校联考2023-2024学年高一上学期11月期中考试
化学试题参考答案
1.C 2.C 3.D 4.D 5.B 6.A 7.C 8.B 9.B 10.D 11.A 12.C 13.D 14.A
15.(14分)(1)②⑦;①⑥ (2)
(3) (4)
(5)或 (6)
16.(14分)
Ⅰ.(1)8.0 (2)①容量瓶 ②引流 (3)ab (4)
Ⅱ.8.0;0.6
17.(16分)
(1)淡黄; (2)分液漏斗:
(3)盐酸;除去未反应的 (4)78 (5)气体中含有的对测量结果无影响
18.(14分)
(1);C (2) (3)溶液变成蓝色;氧化 (4)(氯水)有色或浅黄绿色 (5)b
化学试题
(考试时间:75分钟 总分:100分)
可能用到的相对原子质量:
第Ⅰ卷 选择题(共42分)
一、选择题(本大题共14小题,每小题3分,共42分.在每小题所列出的四个选项中,只有一项是最符合题目要求的)
1.下列说法中不正确的是( )
A.研究物质性质,常用观察、实验、分类、比较等方法
B.中国科学家合成的结晶牛胰岛素是一种蛋白质
C.拉瓦锡提出原子学说,为近代化学的发展奠定了坚实的基础
D.阿伏加德罗提出分子学说,对物质结构的认识发展到一个新的阶段
2.下列变化中需要加入氧化剂才能实现的是( )
A. B. C. D.
3.下列说法不正确的是( )
①氢气能在氯气中燃烧,生成白色烟雾 ②铜丝在氣气中燃烧,生成黄绿色的烟 ③液氯、氯水都是混合物 ④久置的氯水,溶液增大
A.②③ B.①② C.①③④ D.①②③④
4.下列物质分类的正确组合是( )
碱 酸 盐 碱性氧化物 酸性氧化物
A
B
C
D
A.A B.B C.C D.D
5.图示为实验室中制备胶体的一种方法.下列说法正确的是( )
A.该制备方法属于物理方法 B.可用丁达尔效应判断是否制得胶体
C.烧杯中液体的颜色逐渐变浅 D.加热能促使该分散系中的分散质粒子直径减小
6.设为阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下,溶于水形成的溶液中含有数为
B.标准状况下,含有的分子数为
C.通常状况下,个分子占有的体积为
D.物质的量浓度为的溶液中,含有个数为
7.图示是探究氯气某性质的实验装置图,下列说法错误的是( )
A.常温常压下,氯气是黄绿色气体,密度比空气大 B.该实验证明氯气与水发生了反应
C.把A、B瓶调换位置,实验现象不会发生变化 D.装置A中的现象为红纸条不褪色
8.关于如图所示过程的说法正确的是( )
A.甲比乙中溶质的质量分数小 B.乙中
C.乙比甲中的溶解度大 D.乙中
9.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A 某钠盐溶于盐酸,产生了无色无味的气体 该钠盐一定含有
B 投入水中会熔成光亮的小球 与水反应放热且钠的熔点低
C 向某溶液中加入溶液,产生了白色沉淀 该溶液中一定含有
D 在容量瓶内装入水,塞紧瓶塞,将其倒立(瓶口朝下),容量瓶不漏水 容量瓶密闭性好
A.A B.B C.C D.D
10.实验室需要配制一种仅含四种离子(忽略水电离出的离子)的无色混合溶液,且各离子的物质的量浓度均为,能配制成功的是( )
A. B.
C. D.
11.下列两种气体的分子数一定相等的是( )
A.质量相等、密度不等的和 B.等压等体积的和
C.等温等体积的和 D.不同体积等密度的和
12.是一种可用于生产颜料、木材防腐剂等的化工产品.将铜粉加入稀盐酸中,并持续通入空气,在的催化作用下可生成,过程如图所示.下列说法不正确的是( )
A.可循环使用 B.过程Ⅰ的反应为
C.过程Ⅱ中的氧化剂为 D.该过程总反应为
13.粗食盐水中常含有少量杂质离子,实验室提纯粗食盐水制取食盐的流程如下.
关于实验过程中所选用的试剂、目的及所发生反应的离子方程式均正确的是( )
选项 试剂 目的 离子方程式
A 溶液 仅除去
B 溶液 仅除去
C 溶液 仅除去
D 盐酸 除去和
A.A B.B C.C D.D
14.与一定量完全反应后,生成固体产物.则产物中与的物质的量之比为( )
A. B. C. D.无法确定
第Ⅱ卷 非选择题(共58分)
二、填空题(本大题共4小题,共58分)
15.(14分)化学与生产、生活、环境息息相关.从化学视角回答下列问题:
Ⅰ.现有中学化学中常见的几种物质:①氢氧化钠固体 ②铁丝 ③纯醋酸 ④二氧化碳气体 ⑤碳酸钠粉末 ⑥蔗糖 ⑦熔融氯化钠.
(1)上述状态下可导电的有___________,属于非电解质的是___________.(用序号填空)
(2)写出⑤在水溶液中的电离方程式:____________________________________.
(3)写出将少量④通入①溶液发生反应的离子方程式:___________________________________.
Ⅱ.我国科学家研发了一种室温下“可呼吸”的充电电池.电池的总反应为.
(4)用单线桥表示此反应中电子转移的方向和数目:.
(5)含有___________个原子.
(6)该电池中不能存在水,否则可能引起电池爆炸,用离子方程式表示其原因:_____________________________________________________.
16.(14分)配制溶液及应用.
Ⅰ.实验小组同学需要配制溶液.
(1)需要称取的质量为___________g.
(2)该实验小组同学在实验室中找到了下列仪器.
①为了完成实验,还缺少的玻璃仪器是___________.
②在操作步骤“转移”中,玻璃棒的作用是__________________________.
(3)配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是___________(填序号).
a.转移时有少量溶液洒出
b.转移后未用蒸馏水洗涤烧杯
C.定容时俯视刻度线
(4)用以上配制的溶液制备84消毒液,其原理是_______________________________________________(用离子方程式表示).
Ⅱ.分别用不同体积的溶液、溶液和水配制以下3组溶液(假设溶液体积具有加和性).
编号 溶液 溶液 水
浓度/ 浓度/
1 10.0 1.0 10.0 1.0 0
2 4.0 0.2 0.4 28.0
3 12.0 c 8.0 0.4 20.0
则___________,___________.
17.(16分)过氧化钠是一种常见的氧化物,具有强氧化性和漂白性,通常可用作漂白剂和供氧剂.现有一定量含有杂质的试样,用如图所示实验装置测定试样的纯度.(可供选用的试剂只有块状固体、盐酸、硫酸和蒸馏水)
回答下列问题:
(1)过氧化钠为___________色的固体,其阴、阳离子个数比为___________.
(2)仪器a的名称是___________,写出和反应的化学方程式:_______________________________________________________.
(3)装置A中液体试剂选用___________,装置D中碱石灰的作用是_________________________________________________________________.
(4)若开始时测得样品的质量为,反应结束后测得气体体积为(标准状况),则试样的纯度为___________%.
(5)甲同学提出,去除B装置,对测定结果无影响,请你说明甲同学的理由:______________________________________________________.
18.(14分)某实验小组欲通过加热蒸发硝酸钾溶液的方法获得固体.已知固体在一定温度下能发生反应:.为了探究加热蒸发所得固体X中是否含有亚硝酸钾,小组同学设计并完成了以下实验.
【查阅资料】
i.是微溶于水的白色(略带黄色)固体
ii.能在酸性条件下与反应,生成
【实验过程】
【分析解释】
(1)中N的化合价是___________,从化合价的角度预测,具有的性质是___________(填标号).
A.只有氧化性 B.只有还原性 C.既有氧化性,又有还原性
(2)试管①中,观察到有少量白色沉淀生成,该白色沉淀是___________(填化学式).
(3)试管②中,观察到的现象是____________________________;发生___________(填“氧化”或“还原”)反应.
(4)试管③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响.该反应的离子方程式为.该实验选择新制氯水的原因有二:一是具有强氧化性,二是___________.
【反思评价】
(5)综合上述实验,甲同学得出以下结论.你认为甲同学所得结论正确的是___________(填标号).
a.从试管②中的现象可得出酸性条件下,氧化性:
b.试管①和③中的实验现象均可以证明固体X中含有
龙岩市一级校联考2023-2024学年高一上学期11月期中考试
化学试题参考答案
1.C 2.C 3.D 4.D 5.B 6.A 7.C 8.B 9.B 10.D 11.A 12.C 13.D 14.A
15.(14分)(1)②⑦;①⑥ (2)
(3) (4)
(5)或 (6)
16.(14分)
Ⅰ.(1)8.0 (2)①容量瓶 ②引流 (3)ab (4)
Ⅱ.8.0;0.6
17.(16分)
(1)淡黄; (2)分液漏斗:
(3)盐酸;除去未反应的 (4)78 (5)气体中含有的对测量结果无影响
18.(14分)
(1);C (2) (3)溶液变成蓝色;氧化 (4)(氯水)有色或浅黄绿色 (5)b
同课章节目录
