广东省茂名市电白区2023-2024学年高一上学期期中考试化学试题(含答案)
文档属性
| 名称 | 广东省茂名市电白区2023-2024学年高一上学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-02 12:53:46 | ||
图片预览


文档简介
茂名市电白区2023-2024学年高一上学期期中考试
化学
本试卷共7页,20 小题,满分 100 分。考试用时75 分钟。
1.答卷前。考生务必用用黑色字迹的钢笔或签字笔将自己的的姓名、考生号、考场号和座位号填写在答题卡上。用2B铅笔将试卷类型填涂在答题卡相应位置上。将条形码横贴在答题卡右上角“条形码粘贴处”。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位習上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。考试结束后,将试卷和笞题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 1-127Na-23 Al-23 Fe-56 Cu-64 Zn-65
一、选择题:本题共 10 小题,每题2分共 20 分,每小题只有一个答案正确。
1.新型冠状病毒可通过咳嗽、打喷嚏、说话等形成的飞沫传播,飞沫直径在1—100mm之间,进入到空气中形成的分散系属于气溶胶,口罩可以预防和降低感染的风险性。对此说法,下列叙述正确的是
A.胶体的本质特征是具有丁达尔效应
B.依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液
C.向饱和 溶液中滴加过量的NaOH溶液可以制备 胶体
D.酒精用于消毒时,浓度越高,消毒效果越好
2.下列关于物质分类的举例正确的是
选项 酸 碱 盐 酸性氧化物
A HClO NaOH NaAlO SO
B NaHSO NH ·H O FeSO CO
C CH COOH Na CO AlCl CO
D HCl CH CH OH BaCO NO
A. A B. B C. C D. D
3.下列操作过程中一定有氧化还原反应发生的是
4.下列叙述中不正确的是
A.热稳定性: 比 更稳定
B.同温度下的溶解度: 比 更易溶于水
溶液和 溶液分别滴加少量稀盐酸, 溶液产生气泡速率较快
溶液和 溶液分别滴加澄清石灰水,溶液中都产生白色沉淀
5.下列化学反应中电子转移的表示方法正确的是
6.下列用品的有效成分及用途对应不正确的是
A B C D
用品
有效成分 NaCl Na CO Na O NaClO
用途 调味品 发酵粉 制氧剂 消毒剂
A. A B. B C. C D. D
7.下列各组离子在溶液中能大量共存的是
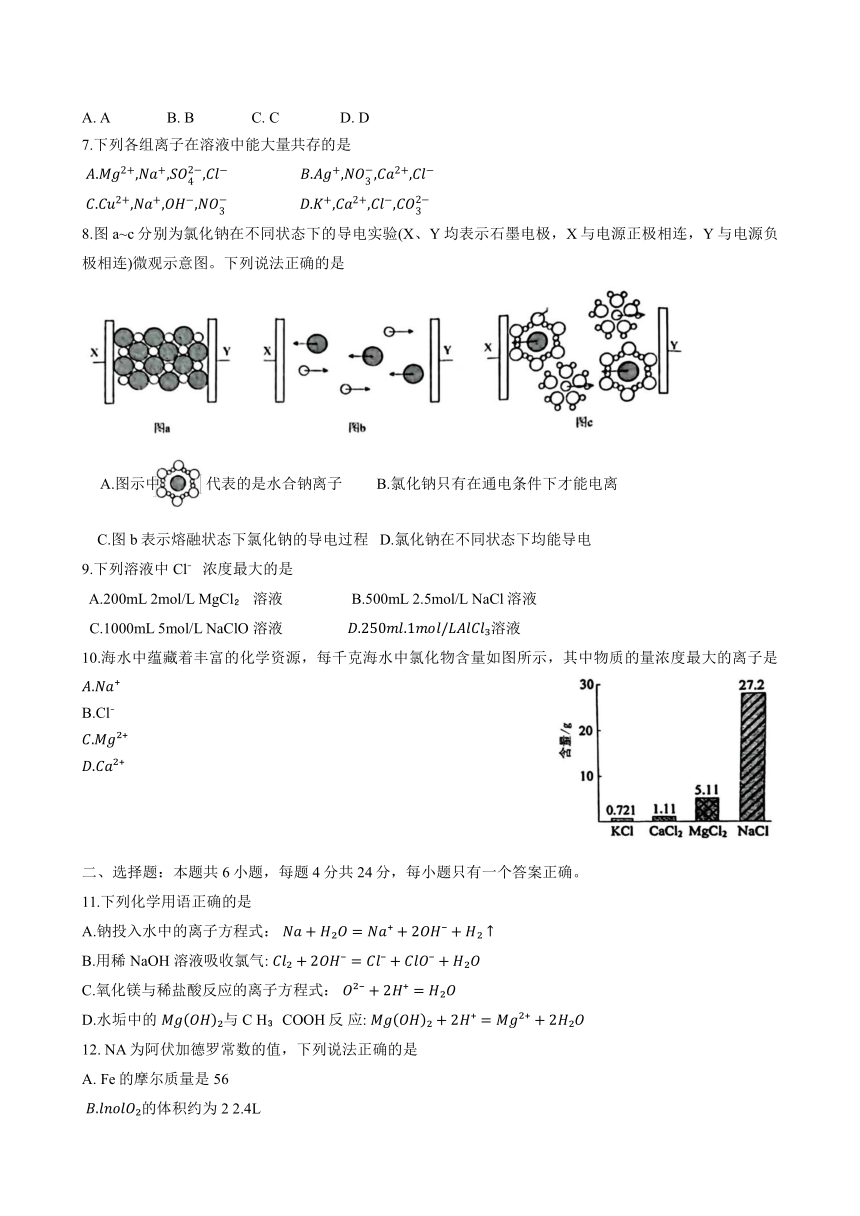
8.图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y 与电源负极相连)微观示意图。下列说法正确的是
A.图示中 代表的是水合钠离子 B.氯化钠只有在通电条件下才能电离
C.图 b表示熔融状态下氯化钠的导电过程 D.氯化钠在不同状态下均能导电
9.下列溶液中 Cl 浓度最大的是
A.200mL 2mol/L MgCl 溶液 B.500mL 2.5mol/L NaCl溶液
C.1000mL 5mol/L NaClO 溶液 溶液
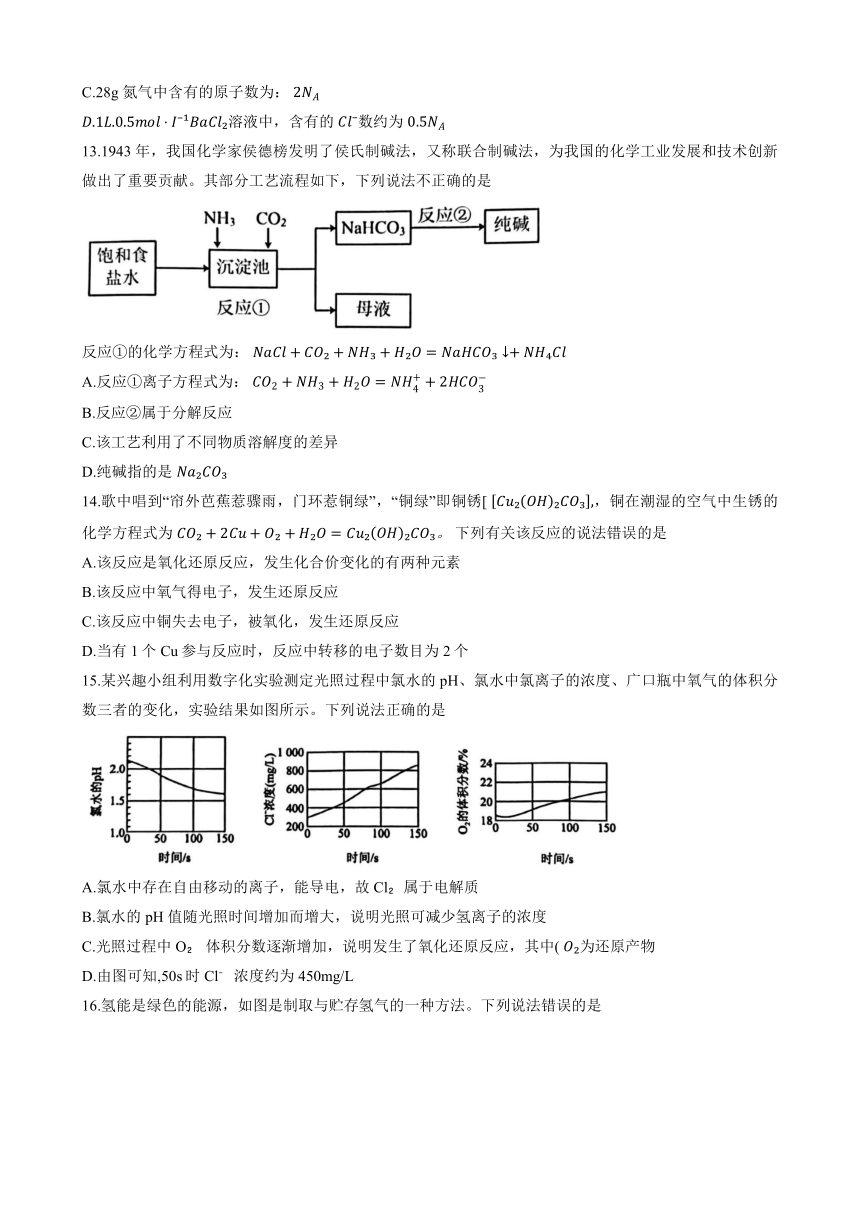
10.海水中蕴藏着丰富的化学资源,每千克海水中氯化物含量如图所示,其中物质的量浓度最大的离子是
B.Cl
二、选择题:本题共6小题,每题4分共24分,每小题只有一个答案正确。
11.下列化学用语正确的是
A.钠投入水中的离子方程式:
B.用稀 NaOH 溶液吸收氯气:
C.氧化镁与稀盐酸反应的离子方程式:
D.水垢中的 与C H COOH反 应:
12. NA 为阿伏加德罗常数的值,下列说法正确的是
A. Fe的摩尔质量是 56
的体积约为2 2.4L
C.28g 氮气中含有的原子数为:
溶液中,含有的 数约为
13.1943 年,我国化学家侯德榜发明了侯氏制碱法,又称联合制碱法,为我国的化学工业发展和技术创新做出了重要贡献。其部分工艺流程如下,下列说法不正确的是
反应①的化学方程式为:
A.反应①离子方程式为:
B.反应②属于分解反应
C.该工艺利用了不同物质溶解度的差异
D.纯碱指的是
14.歌中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,“铜绿”即铜锈[ ,铜在潮湿的空气中生锈的化学方程式为 下列有关该反应的说法错误的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.该反应中氧气得电子,发生还原反应
C.该反应中铜失去电子,被氧化,发生还原反应
D.当有1个Cu参与反应时,反应中转移的电子数目为2个
15.某兴趣小组利用数字化实验测定光照过程中氯水的 pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数三者的变化,实验结果如图所示。下列说法正确的是
A.氯水中存在自由移动的离子,能导电,故 Cl 属于电解质
B.氯水的 pH 值随光照时间增加而增大,说明光照可减少氢离子的浓度
C.光照过程中 O 体积分数逐渐增加,说明发生了氧化还原反应,其中( 为还原产物
D.由图可知,50s时Cl 浓度约为 450mg/L
16.氢能是绿色的能源,如图是制取与贮存氢气的一种方法。下列说法错误的是
资料: 是一种贮氢合金,吸氢后生成 和 合金;
和H Cl反 应的化学方程式为
A.反应1的基本反应类型是分解反应
B.制氢反应中 ZnO和 可循环使用
C.反应3中氩气作保护气,防止金属镁、铜在高温下与氧气反应
D.反应3的产物与足量稀盐酸反应生成的氢气和反应2产生的氢气质量相等
三、非选择题:本题共4小题,共56分。
17.(14 分)设 表示阿伏加德罗常数的值,请回答下列问题:
(1) O 的摩尔质量为 g/mol。
个 Na 约含有 mol Na ,其质量为 g。
约含有 个 ,其标准状况的气体体积 L。
(4)0.2molAl含有 个铝原子,质量是 g。
18.(12分)物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价一类”二维图,请回答下列问题:
(1)物质①与水反应的离子方程式为 ,通常把物质①保存在 中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式: 。
(3)纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。
图Ⅰ、Ⅱ中 能更好说明二者的稳定性。 Ⅱ中受热处发生反应的化学方程式为 。
(4)下列关于 和 的说法不正确的是 。
A.相同条件下的溶解度;
B.可以用澄清石灰水区别 溶液和 溶液
C.可以用加热的方法除去 固体中的 杂质
D.等质量的碳酸钠和碳酸氢钠与足量盐酸反应, 放出的气体多
溶液和 溶液均显碱性
19.(16分)实验室需要 0.1mol/L NaOH 溶液 450mL和0.5mol/L 硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D. 量取一定体积的液体
(3)在配制 NaOH 溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度 0.1mol/L(填“大于”“等于”或“小于”,下同);若 NaOH 溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 0.1mol/L。
(4)根据计算得知,所需物质的量浓度为 18.4mol/L的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有 10mL、25mL、50mL量筒,应选用 mL规格的量筒最好。
20.(14分)利用下图可从不同角度研究含氯物质的性质及其转化关系。回答下列问题:
(1)图中a物质是否为电解质 (填“是”或“否”),b物质的化学式为 。
(2)实验室用二氧化锰与浓盐酸在加热条件下制取氯气,写出该反应的离子方程式:————— 。
(3)“84 消毒液”是常用含氯消毒剂,其有效成分是图中c物质,“84 消毒液”不可与洁厕灵(主要成分稀盐酸)混合使用的原因是 。(用离子方程式说明)
(4)工业漂白粉中的有效成分能与空气中的水蒸气和二氧化碳发生如下反应: 久置于空气中的漂白粉易失效,请用化学方程式解释漂白粉失效的原因: 。
(5)高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理,工业上制备 有多种方法,其中一种制备的化学原理是在碱性条件下用 NaClO 氧化氯化铁,请完成离子方程式的配平:
,反应中消耗 数与转移的电子数之比是 。
茂名市电白区2023-2024学年高一上学期期中考试
化学参考答案
一、选择题:本题共10小题,每题2分共20分, 每小题只有一个答案正确。
1 2 3 4 5 6 7 8 9 10
B A D C B B A C A B
二、选择题:本题共6小题,每题4分共24分,每小题只有一个答案正确。
11 12 13 14 15 16
B C A C D D
三、非选择题: 本题共4小题, 共56分。
(每空2分,化学方程式,反应物生成物对1分,全对2分。)
17. (14分) (1) 32 (2) 1 23 (3) 3.01×10 11.2 (4) 1.204×10 5.4
18. (12分)( 煤油(或石蜡油)
(3)II
(4)BD(对1个1分,全对2分)
19. (16分)(1) AC (对1个1分,全对2分) 分液漏斗 500
(2) BCD(对1个1分,全对2分) (3)小于 大于 (4)13.6 25
20. (14分)(1) 是 HClO
(本题每条方程式全对各 1分)
(配对两剂两产1分,全对2分)
化学
本试卷共7页,20 小题,满分 100 分。考试用时75 分钟。
1.答卷前。考生务必用用黑色字迹的钢笔或签字笔将自己的的姓名、考生号、考场号和座位号填写在答题卡上。用2B铅笔将试卷类型填涂在答题卡相应位置上。将条形码横贴在答题卡右上角“条形码粘贴处”。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案。答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位習上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。考试结束后,将试卷和笞题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 1-127Na-23 Al-23 Fe-56 Cu-64 Zn-65
一、选择题:本题共 10 小题,每题2分共 20 分,每小题只有一个答案正确。
1.新型冠状病毒可通过咳嗽、打喷嚏、说话等形成的飞沫传播,飞沫直径在1—100mm之间,进入到空气中形成的分散系属于气溶胶,口罩可以预防和降低感染的风险性。对此说法,下列叙述正确的是
A.胶体的本质特征是具有丁达尔效应
B.依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液
C.向饱和 溶液中滴加过量的NaOH溶液可以制备 胶体
D.酒精用于消毒时,浓度越高,消毒效果越好
2.下列关于物质分类的举例正确的是
选项 酸 碱 盐 酸性氧化物
A HClO NaOH NaAlO SO
B NaHSO NH ·H O FeSO CO
C CH COOH Na CO AlCl CO
D HCl CH CH OH BaCO NO
A. A B. B C. C D. D
3.下列操作过程中一定有氧化还原反应发生的是
4.下列叙述中不正确的是
A.热稳定性: 比 更稳定
B.同温度下的溶解度: 比 更易溶于水
溶液和 溶液分别滴加少量稀盐酸, 溶液产生气泡速率较快
溶液和 溶液分别滴加澄清石灰水,溶液中都产生白色沉淀
5.下列化学反应中电子转移的表示方法正确的是
6.下列用品的有效成分及用途对应不正确的是
A B C D
用品
有效成分 NaCl Na CO Na O NaClO
用途 调味品 发酵粉 制氧剂 消毒剂
A. A B. B C. C D. D
7.下列各组离子在溶液中能大量共存的是
8.图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y 与电源负极相连)微观示意图。下列说法正确的是
A.图示中 代表的是水合钠离子 B.氯化钠只有在通电条件下才能电离
C.图 b表示熔融状态下氯化钠的导电过程 D.氯化钠在不同状态下均能导电
9.下列溶液中 Cl 浓度最大的是
A.200mL 2mol/L MgCl 溶液 B.500mL 2.5mol/L NaCl溶液
C.1000mL 5mol/L NaClO 溶液 溶液
10.海水中蕴藏着丰富的化学资源,每千克海水中氯化物含量如图所示,其中物质的量浓度最大的离子是
B.Cl
二、选择题:本题共6小题,每题4分共24分,每小题只有一个答案正确。
11.下列化学用语正确的是
A.钠投入水中的离子方程式:
B.用稀 NaOH 溶液吸收氯气:
C.氧化镁与稀盐酸反应的离子方程式:
D.水垢中的 与C H COOH反 应:
12. NA 为阿伏加德罗常数的值,下列说法正确的是
A. Fe的摩尔质量是 56
的体积约为2 2.4L
C.28g 氮气中含有的原子数为:
溶液中,含有的 数约为
13.1943 年,我国化学家侯德榜发明了侯氏制碱法,又称联合制碱法,为我国的化学工业发展和技术创新做出了重要贡献。其部分工艺流程如下,下列说法不正确的是
反应①的化学方程式为:
A.反应①离子方程式为:
B.反应②属于分解反应
C.该工艺利用了不同物质溶解度的差异
D.纯碱指的是
14.歌中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,“铜绿”即铜锈[ ,铜在潮湿的空气中生锈的化学方程式为 下列有关该反应的说法错误的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.该反应中氧气得电子,发生还原反应
C.该反应中铜失去电子,被氧化,发生还原反应
D.当有1个Cu参与反应时,反应中转移的电子数目为2个
15.某兴趣小组利用数字化实验测定光照过程中氯水的 pH、氯水中氯离子的浓度、广口瓶中氧气的体积分数三者的变化,实验结果如图所示。下列说法正确的是
A.氯水中存在自由移动的离子,能导电,故 Cl 属于电解质
B.氯水的 pH 值随光照时间增加而增大,说明光照可减少氢离子的浓度
C.光照过程中 O 体积分数逐渐增加,说明发生了氧化还原反应,其中( 为还原产物
D.由图可知,50s时Cl 浓度约为 450mg/L
16.氢能是绿色的能源,如图是制取与贮存氢气的一种方法。下列说法错误的是
资料: 是一种贮氢合金,吸氢后生成 和 合金;
和H Cl反 应的化学方程式为
A.反应1的基本反应类型是分解反应
B.制氢反应中 ZnO和 可循环使用
C.反应3中氩气作保护气,防止金属镁、铜在高温下与氧气反应
D.反应3的产物与足量稀盐酸反应生成的氢气和反应2产生的氢气质量相等
三、非选择题:本题共4小题,共56分。
17.(14 分)设 表示阿伏加德罗常数的值,请回答下列问题:
(1) O 的摩尔质量为 g/mol。
个 Na 约含有 mol Na ,其质量为 g。
约含有 个 ,其标准状况的气体体积 L。
(4)0.2molAl含有 个铝原子,质量是 g。
18.(12分)物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价一类”二维图,请回答下列问题:
(1)物质①与水反应的离子方程式为 ,通常把物质①保存在 中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式: 。
(3)纯碱和小苏打都是重要的化工原料,在生产和生活中有若广泛的应用。
图Ⅰ、Ⅱ中 能更好说明二者的稳定性。 Ⅱ中受热处发生反应的化学方程式为 。
(4)下列关于 和 的说法不正确的是 。
A.相同条件下的溶解度;
B.可以用澄清石灰水区别 溶液和 溶液
C.可以用加热的方法除去 固体中的 杂质
D.等质量的碳酸钠和碳酸氢钠与足量盐酸反应, 放出的气体多
溶液和 溶液均显碱性
19.(16分)实验室需要 0.1mol/L NaOH 溶液 450mL和0.5mol/L 硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,本实验所需玻璃仪器E规格为 mL。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D. 量取一定体积的液体
(3)在配制 NaOH 溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度 0.1mol/L(填“大于”“等于”或“小于”,下同);若 NaOH 溶液未冷却即转移至容量瓶定容,则所配制溶液浓度 0.1mol/L。
(4)根据计算得知,所需物质的量浓度为 18.4mol/L的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有 10mL、25mL、50mL量筒,应选用 mL规格的量筒最好。
20.(14分)利用下图可从不同角度研究含氯物质的性质及其转化关系。回答下列问题:
(1)图中a物质是否为电解质 (填“是”或“否”),b物质的化学式为 。
(2)实验室用二氧化锰与浓盐酸在加热条件下制取氯气,写出该反应的离子方程式:————— 。
(3)“84 消毒液”是常用含氯消毒剂,其有效成分是图中c物质,“84 消毒液”不可与洁厕灵(主要成分稀盐酸)混合使用的原因是 。(用离子方程式说明)
(4)工业漂白粉中的有效成分能与空气中的水蒸气和二氧化碳发生如下反应: 久置于空气中的漂白粉易失效,请用化学方程式解释漂白粉失效的原因: 。
(5)高铁酸钠是一种新型绿色消毒剂,主要用于饮用水处理,工业上制备 有多种方法,其中一种制备的化学原理是在碱性条件下用 NaClO 氧化氯化铁,请完成离子方程式的配平:
,反应中消耗 数与转移的电子数之比是 。
茂名市电白区2023-2024学年高一上学期期中考试
化学参考答案
一、选择题:本题共10小题,每题2分共20分, 每小题只有一个答案正确。
1 2 3 4 5 6 7 8 9 10
B A D C B B A C A B
二、选择题:本题共6小题,每题4分共24分,每小题只有一个答案正确。
11 12 13 14 15 16
B C A C D D
三、非选择题: 本题共4小题, 共56分。
(每空2分,化学方程式,反应物生成物对1分,全对2分。)
17. (14分) (1) 32 (2) 1 23 (3) 3.01×10 11.2 (4) 1.204×10 5.4
18. (12分)( 煤油(或石蜡油)
(3)II
(4)BD(对1个1分,全对2分)
19. (16分)(1) AC (对1个1分,全对2分) 分液漏斗 500
(2) BCD(对1个1分,全对2分) (3)小于 大于 (4)13.6 25
20. (14分)(1) 是 HClO
(本题每条方程式全对各 1分)
(配对两剂两产1分,全对2分)
同课章节目录
