海南省海口市两校2023-2024学年高二上学期11月学业水平测试期中联考化学试题(含答案)
文档属性
| 名称 | 海南省海口市两校2023-2024学年高二上学期11月学业水平测试期中联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 862.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-02 12:59:05 | ||
图片预览



文档简介
海口市两校2023-2024学年高二上学期11月学业水平测试期中联考
化学
1.本试卷满分100分,测试时间90分钟,共8页。
2.考查范围:选择性必修1第一章、第二章。
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.成都第31届世界大学生运动会期间主要使用新能源汽车。这里“新能源”主要指( )
A.天然气、煤油、汽油 B.太阳能、煤炭、核能
C.太阳能、风能、氢能 D.水煤气、液化气、沼气
2.下列属于吸热的氧化还原反应的是( )
A.合成氨反应 B.中和反应
C.碳和水蒸气反应 D.石灰石高温分解
3.化学与生活息息相关。下列说法正确的是( )
A.使用加酶洗衣粉洗涤衣物时,水温越高效果越好
B.作腌制品的保鲜剂,能减缓食物腐败变质的速率
C.使用催化剂消除汽车尾气污染物时,催化剂颗粒大小对其反应速率无影响
D.打开啤酒瓶盖后冒出大量气泡,压强减小,二氧化碳的溶解度增大
4.人们设想用热分解法来有效处理:。下列分析与判断正确的是( )
选项 项目 A B C D
小于0 小于0 大于0 大于0
大于0 小于0 大于0 小于0
判断 能自发进行 低温时能自发进行 高温时能自发进行 不能自发进行
A.A B.B C.C D.D
5.还原的反应原理为,下列反应速率的关系正确的是( )
A. B.
C. D.
6.某恒温恒容密闭容器中发生反应:。下列叙述正确的是( )
A.充入氩气,反应速率减小 B.增大的质量,平衡常数增大
C.充入,反应速率不变 D.加入催化剂,平衡不移动
7.向某恒容密闭容器中充入和一定量,发生反应:,在不同温度下测得的物质的量分数随时间变化如表所示:
时间 0 20 40 60 80 100
0 0.50 0.72 0.75 0.75 0.75
0 0.48 0.68 0.76 0.80 0.80
下列说法正确的是( )
A.
B.
C.该反应的平衡常数表达式为
D.增大的浓度和使用催化剂均可提高的平衡转化率
8.在某密闭容器中发生反应:。下列情况不能说明反应达到平衡状态的是( )
A.溶液颜色不再变化 B.不再变化
C.不再变化 D.不再变化
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.已知:气态分子中化学键解离成气态原子所吸收的能量叫键能。在催化剂作用下,发生反应:。有关数据如下:
化学键
键能 436 391 946
下列叙述正确的是( )
A.
B.
C.合成氨反应必须是在高温下才能自发进行
D.平衡后,增大浓度,增大
10.在密闭容器中发生反应:,改变下列条件一定可以提高活化分子百分数的是( )
A.升高温度 B.增大压强 C.增大反应物浓度 D.加入催化剂
11.测定中和反应反应热的实验中,若选择下列物质进行测定,所得中和热()结果偏小的是( )
A.浓硫酸和溶液 B.盐酸和固体
C.醋酸和溶液 D.盐酸和氨水
12.氢气是一种清洁能源,工业上常通过水煤气法制备氢气,发生反应:①、②。在恒温恒容条件下,向密闭容器中充入足量炭粉和,发生上述反应。下列叙述正确的是( )
A.达到平衡时,的体积分数大于
B.当混合气体总压强不随时间变化时达到平衡状态
C.平衡后,增大炭粉质量,的产率增大
D.平衡后,及时分离出,能提高的产率
13.根据下列操作及现象得出的结论正确的是( )
选项 操作及现象 结论
A 向烧碱样品溶液中滴加溶液,产生白色沉淀 烧碱已完全变质
B 向滴有酚酞的溶液中通入,溶液红色褪去 具有漂白性
C 将装有的试管插入盛有醋酸的烧杯中,向试管中加入盐酸,观察到烧杯中醋酸结冰 和盐酸反应可能为吸热反应
D 将装有等量气体的两只烧瓶分别浸入盛有水的甲、乙烧杯中,一段时间后,甲中烧瓶内气体颜色比乙深 甲烧杯中为冷水,乙烧杯中为热水
A.A B.B C.C D.D
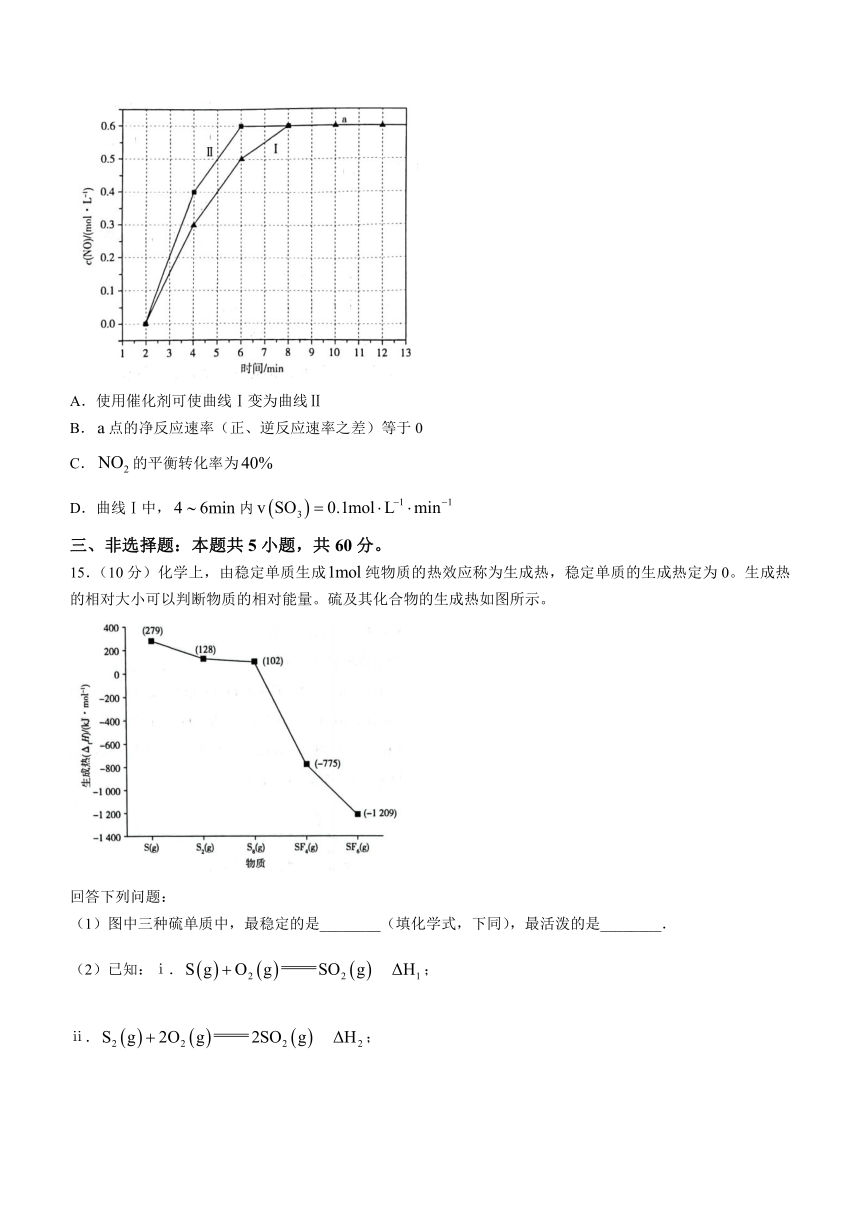
14.某温度下,在体积为的恒容密闭容器中充入和,发生反应:,测得与时间的关系如图所示。下列叙述错误的是( )
A.使用催化剂可使曲线Ⅰ变为曲线Ⅱ
B.点的净反应速率(正、逆反应速率之差)等于0
C.的平衡转化率为
D.曲线Ⅰ中,内
三、非选择题:本题共5小题,共60分。
15.(10分)化学上,由稳定单质生成纯物质的热效应称为生成热,稳定单质的生成热定为0。生成热的相对大小可以判断物质的相对能量。硫及其化合物的生成热如图所示。
回答下列问题:
(1)图中三种硫单质中,最稳定的是________(填化学式,下同),最活泼的是________.
(2)已知:ⅰ.;
ⅱ.;
ⅲ.。
①________。
②________0(填“>”“<”或“=”),判断依据是________________.
(3)根据图像,计算反应的________.
16.(10分)氢气是清洁能源,工业上用天然气为原料制备氢气的有关反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)在恒温恒容密闭容器中充入和,发生上述反应。下列叙述正确的是________(填字母)。
A.平衡后,增大压强,反应Ⅰ的平衡常数减小
B.平衡后,升高温度,两个反应都向左移动
C.平衡后,充入惰性气体,的平衡转化率增大
D.其他条件不变,增大浓度,两个反应的正反应速率均增大
(2)写出和反应生成和的热化学方程式:________________(用的关系式表示)。
(3)和水蒸气反应的能量变化如图所示。
已知:ⅰ.。
ⅱ.的燃烧热分别为。
①启动该反应需要加热,其主要作用是________(填字母)。
A.降低活化能 B.改变反应历程
C.增大反应物能量 D.增大产物能量
②图中代表加入催化剂的曲线是________(填“a”或“b”)。
③________。
17.(14分)亚硝酰氯()是一种常用的氯化剂,广泛用于有机合成中。在体积相同的甲、乙密闭容器中均充入和,分别在“恒温恒容”“绝热恒容”条件下发生反应:.两个反应体系的压强与时间关系如图所示:
回答下列问题:
(1)________0(填“>”或“<”)。
(2)气体总物质的量:________(填“>”“<”或“=”,下同),判断依据是________________.
(3)转化率:________。
(4)反应速率:________。
(5)乙容器中,内的分压变化率为________。
(6)a点时,________。甲容器中平衡常数________a点时的(填“大于”“小于”或“等于”)。提示:用分压计算的平衡常数为,分压总压物质的量分数,点时也用分压计算。
18.(14分)是中学化学实验中常用的试剂。回答下列问题:
(1)溶液中存在:.
①实验室配制溶液的操作是取一定量固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是________.
②对溶液进行加热,溶液变为红褐色,由此判断,________0(填“>”或“<”),判断理由是________________.
(2)在稀溶液中滴加几滴溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
序号 操作 现象
Ⅰ 向乙中加入少量铁粉,振荡 溶液颜色比甲浅
Ⅱ 向丙中加入少量粉末,振荡 溶液颜色与甲无明显变化
Ⅲ 向丁中滴加足量的新制氯水,振荡 溶液颜色变为黄色
①参照组甲溶液颜色为________.
②解释产生实验Ⅰ中现象的原因:________________.
③实验Ⅲ中产生异常现象的原因可能是________________,为了验证该猜想,请设计简单实验:________________.
19.(12分)已知正丁烷和异丁烷可以相互转化:(g,正丁烷)(,异丁烷)。在恒容密闭容器中充入正丁烷发生异构化反应,正丁烷浓度随时间的变化曲线如图所示(图中为温度)。已知:速率方程式为(为速率常数,与温度、催化剂等有关,与浓度无关),点反应速率相等,即。
回答下列问题:
(1)bf段平均反应速率________。
(2)________(填“>”“<”或“=”),判断依据是________________.
(3)活化分子总数:________(填“>”“<”或“=”),判断依据是________________.
(4)________.
(5)速率常数:________(填“>”“<”或“=”)。
海口市两校2023-2024学年高二上学期11月学业水平测试期中联考
化学·答案
1.C 2.C 3.B 4.D 5.D 6.D 7.A 8.B 9.B 10.AD 11.AB 12.BD 13.C 14.C
15.(1) S
(2)①
②> 同种物质由固态变为气态时吸收热量
(3)
16.(1)D
(2)(2分)
(3)①C ②b ③
17.(1)<
(2)> 甲容器温度高于乙,则点温度小于点,点压强、体积均相等,气体总物质的量:
(3)<
(4)>
(5)5
(6) 大于
18.(1)①抑制铁离子生成(或其他合理说法,2分)
(2)> 升高温度,平衡向吸热方向移动,溶液由黄色变为红褐色,说明正反应是吸热反应
(2)①红色
②消耗了浓度减小,的平衡向左移动
③新制氯水氧化了 取少量黄色溶液,滴加溶液,若溶液变为红色,则猜想正确
19.(1)
(2)< ,由及知,,故
(3)> 温度相同,活化分子百分数相等,浓度越大,活化分子总数越大
(4)
(5)=
化学
1.本试卷满分100分,测试时间90分钟,共8页。
2.考查范围:选择性必修1第一章、第二章。
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.成都第31届世界大学生运动会期间主要使用新能源汽车。这里“新能源”主要指( )
A.天然气、煤油、汽油 B.太阳能、煤炭、核能
C.太阳能、风能、氢能 D.水煤气、液化气、沼气
2.下列属于吸热的氧化还原反应的是( )
A.合成氨反应 B.中和反应
C.碳和水蒸气反应 D.石灰石高温分解
3.化学与生活息息相关。下列说法正确的是( )
A.使用加酶洗衣粉洗涤衣物时,水温越高效果越好
B.作腌制品的保鲜剂,能减缓食物腐败变质的速率
C.使用催化剂消除汽车尾气污染物时,催化剂颗粒大小对其反应速率无影响
D.打开啤酒瓶盖后冒出大量气泡,压强减小,二氧化碳的溶解度增大
4.人们设想用热分解法来有效处理:。下列分析与判断正确的是( )
选项 项目 A B C D
小于0 小于0 大于0 大于0
大于0 小于0 大于0 小于0
判断 能自发进行 低温时能自发进行 高温时能自发进行 不能自发进行
A.A B.B C.C D.D
5.还原的反应原理为,下列反应速率的关系正确的是( )
A. B.
C. D.
6.某恒温恒容密闭容器中发生反应:。下列叙述正确的是( )
A.充入氩气,反应速率减小 B.增大的质量,平衡常数增大
C.充入,反应速率不变 D.加入催化剂,平衡不移动
7.向某恒容密闭容器中充入和一定量,发生反应:,在不同温度下测得的物质的量分数随时间变化如表所示:
时间 0 20 40 60 80 100
0 0.50 0.72 0.75 0.75 0.75
0 0.48 0.68 0.76 0.80 0.80
下列说法正确的是( )
A.
B.
C.该反应的平衡常数表达式为
D.增大的浓度和使用催化剂均可提高的平衡转化率
8.在某密闭容器中发生反应:。下列情况不能说明反应达到平衡状态的是( )
A.溶液颜色不再变化 B.不再变化
C.不再变化 D.不再变化
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9.已知:气态分子中化学键解离成气态原子所吸收的能量叫键能。在催化剂作用下,发生反应:。有关数据如下:
化学键
键能 436 391 946
下列叙述正确的是( )
A.
B.
C.合成氨反应必须是在高温下才能自发进行
D.平衡后,增大浓度,增大
10.在密闭容器中发生反应:,改变下列条件一定可以提高活化分子百分数的是( )
A.升高温度 B.增大压强 C.增大反应物浓度 D.加入催化剂
11.测定中和反应反应热的实验中,若选择下列物质进行测定,所得中和热()结果偏小的是( )
A.浓硫酸和溶液 B.盐酸和固体
C.醋酸和溶液 D.盐酸和氨水
12.氢气是一种清洁能源,工业上常通过水煤气法制备氢气,发生反应:①、②。在恒温恒容条件下,向密闭容器中充入足量炭粉和,发生上述反应。下列叙述正确的是( )
A.达到平衡时,的体积分数大于
B.当混合气体总压强不随时间变化时达到平衡状态
C.平衡后,增大炭粉质量,的产率增大
D.平衡后,及时分离出,能提高的产率
13.根据下列操作及现象得出的结论正确的是( )
选项 操作及现象 结论
A 向烧碱样品溶液中滴加溶液,产生白色沉淀 烧碱已完全变质
B 向滴有酚酞的溶液中通入,溶液红色褪去 具有漂白性
C 将装有的试管插入盛有醋酸的烧杯中,向试管中加入盐酸,观察到烧杯中醋酸结冰 和盐酸反应可能为吸热反应
D 将装有等量气体的两只烧瓶分别浸入盛有水的甲、乙烧杯中,一段时间后,甲中烧瓶内气体颜色比乙深 甲烧杯中为冷水,乙烧杯中为热水
A.A B.B C.C D.D
14.某温度下,在体积为的恒容密闭容器中充入和,发生反应:,测得与时间的关系如图所示。下列叙述错误的是( )
A.使用催化剂可使曲线Ⅰ变为曲线Ⅱ
B.点的净反应速率(正、逆反应速率之差)等于0
C.的平衡转化率为
D.曲线Ⅰ中,内
三、非选择题:本题共5小题,共60分。
15.(10分)化学上,由稳定单质生成纯物质的热效应称为生成热,稳定单质的生成热定为0。生成热的相对大小可以判断物质的相对能量。硫及其化合物的生成热如图所示。
回答下列问题:
(1)图中三种硫单质中,最稳定的是________(填化学式,下同),最活泼的是________.
(2)已知:ⅰ.;
ⅱ.;
ⅲ.。
①________。
②________0(填“>”“<”或“=”),判断依据是________________.
(3)根据图像,计算反应的________.
16.(10分)氢气是清洁能源,工业上用天然气为原料制备氢气的有关反应如下:
Ⅰ.
Ⅱ.
回答下列问题:
(1)在恒温恒容密闭容器中充入和,发生上述反应。下列叙述正确的是________(填字母)。
A.平衡后,增大压强,反应Ⅰ的平衡常数减小
B.平衡后,升高温度,两个反应都向左移动
C.平衡后,充入惰性气体,的平衡转化率增大
D.其他条件不变,增大浓度,两个反应的正反应速率均增大
(2)写出和反应生成和的热化学方程式:________________(用的关系式表示)。
(3)和水蒸气反应的能量变化如图所示。
已知:ⅰ.。
ⅱ.的燃烧热分别为。
①启动该反应需要加热,其主要作用是________(填字母)。
A.降低活化能 B.改变反应历程
C.增大反应物能量 D.增大产物能量
②图中代表加入催化剂的曲线是________(填“a”或“b”)。
③________。
17.(14分)亚硝酰氯()是一种常用的氯化剂,广泛用于有机合成中。在体积相同的甲、乙密闭容器中均充入和,分别在“恒温恒容”“绝热恒容”条件下发生反应:.两个反应体系的压强与时间关系如图所示:
回答下列问题:
(1)________0(填“>”或“<”)。
(2)气体总物质的量:________(填“>”“<”或“=”,下同),判断依据是________________.
(3)转化率:________。
(4)反应速率:________。
(5)乙容器中,内的分压变化率为________。
(6)a点时,________。甲容器中平衡常数________a点时的(填“大于”“小于”或“等于”)。提示:用分压计算的平衡常数为,分压总压物质的量分数,点时也用分压计算。
18.(14分)是中学化学实验中常用的试剂。回答下列问题:
(1)溶液中存在:.
①实验室配制溶液的操作是取一定量固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是________.
②对溶液进行加热,溶液变为红褐色,由此判断,________0(填“>”或“<”),判断理由是________________.
(2)在稀溶液中滴加几滴溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
序号 操作 现象
Ⅰ 向乙中加入少量铁粉,振荡 溶液颜色比甲浅
Ⅱ 向丙中加入少量粉末,振荡 溶液颜色与甲无明显变化
Ⅲ 向丁中滴加足量的新制氯水,振荡 溶液颜色变为黄色
①参照组甲溶液颜色为________.
②解释产生实验Ⅰ中现象的原因:________________.
③实验Ⅲ中产生异常现象的原因可能是________________,为了验证该猜想,请设计简单实验:________________.
19.(12分)已知正丁烷和异丁烷可以相互转化:(g,正丁烷)(,异丁烷)。在恒容密闭容器中充入正丁烷发生异构化反应,正丁烷浓度随时间的变化曲线如图所示(图中为温度)。已知:速率方程式为(为速率常数,与温度、催化剂等有关,与浓度无关),点反应速率相等,即。
回答下列问题:
(1)bf段平均反应速率________。
(2)________(填“>”“<”或“=”),判断依据是________________.
(3)活化分子总数:________(填“>”“<”或“=”),判断依据是________________.
(4)________.
(5)速率常数:________(填“>”“<”或“=”)。
海口市两校2023-2024学年高二上学期11月学业水平测试期中联考
化学·答案
1.C 2.C 3.B 4.D 5.D 6.D 7.A 8.B 9.B 10.AD 11.AB 12.BD 13.C 14.C
15.(1) S
(2)①
②> 同种物质由固态变为气态时吸收热量
(3)
16.(1)D
(2)(2分)
(3)①C ②b ③
17.(1)<
(2)> 甲容器温度高于乙,则点温度小于点,点压强、体积均相等,气体总物质的量:
(3)<
(4)>
(5)5
(6) 大于
18.(1)①抑制铁离子生成(或其他合理说法,2分)
(2)> 升高温度,平衡向吸热方向移动,溶液由黄色变为红褐色,说明正反应是吸热反应
(2)①红色
②消耗了浓度减小,的平衡向左移动
③新制氯水氧化了 取少量黄色溶液,滴加溶液,若溶液变为红色,则猜想正确
19.(1)
(2)< ,由及知,,故
(3)> 温度相同,活化分子百分数相等,浓度越大,活化分子总数越大
(4)
(5)=
同课章节目录
