高中化学苏教版必修第一册专题3 第1单元 第2课时 氯气的性质与应用 同步练习(含解析)
文档属性
| 名称 | 高中化学苏教版必修第一册专题3 第1单元 第2课时 氯气的性质与应用 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 691.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-02 13:01:12 | ||
图片预览



文档简介
第2课时 氯气的性质与应用
1.下列有关氯气的叙述中不正确的是( )。
A.氯气是一种黄绿色、有刺激性气味的气体
B.氯气、液氯、氯水是同一种物质
C.氯气能溶于水
D.氯气是一种有毒气体
2.下列氯化物中,既能由金属与氯气直接反应制得,又能由金属与盐酸反应制得的是( )。
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
3.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )。
①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液 ⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液
A.①②③ B.①②⑥
C.③⑥ D.③④⑤
4.由于氯气不便于保存,生活中常用的含氯消毒剂是“84”消毒液或漂白粉。下列关于工业生产的说法正确的是( )。
A.工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
B.工业上以氯气和澄清石灰水为原料制造漂白粉
C.工业上将氯气溶于NaOH溶液中制造漂白粉
D.漂白粉要干燥和密封保存
5.0.2 mol某单质直接与氯气完全反应,固体质量增大14.2 g,该单质可能是( )。
A.钠 B.铜
C.铝 D.铁
6.下列说法正确的是( )。
A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色
B.含氯漂白剂不能与洁厕剂(含有盐酸)混合使用
C.漂白粉的有效成分是CaCl2和Ca(ClO)2
D.氯水的成分为Cl2和Ca(ClO)2,应密封保存
7.在氯水中存在许多分子和离子,它们在不同的反应中表现各自的性质,下列的实验和结论一致的是( )。
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2的存在
B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有Cl2的存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明氯水中有Cl-的存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明溶液中有HClO分子的存在
8.(双选)下图为氯气及氯的化合物的“价—类”二维图,下列叙述错误的是( )。
A.常温下,a的稀溶液与二氧化锰反应可制取b
B.除去b中混有的a气体的方法是将混合气体通入饱和NaHCO3溶液
C.c和f均可用于环境杀菌消毒
D.d与e的钾盐都能在一定条件下分解生成一种相同的气体单质
9.ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是( )。
A.通入的空气可将发生器中产生的ClO2全部吹入吸收器中
B.吸收器中反应的化学方程式为2ClO2+H2O22HClO2+O2↑
C.步骤a的操作包括过滤、洗涤和干燥
D.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
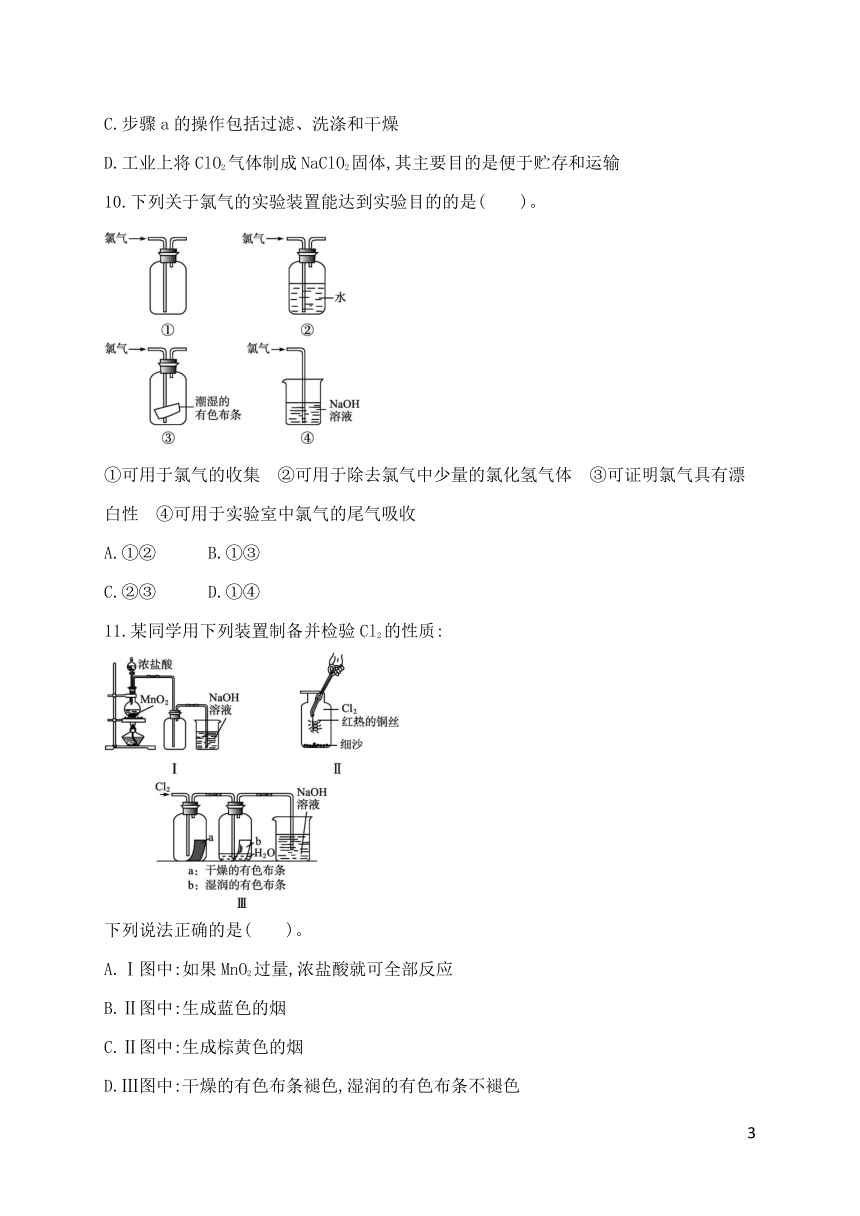
10.下列关于氯气的实验装置能达到实验目的的是( )。
①可用于氯气的收集 ②可用于除去氯气中少量的氯化氢气体 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A.①② B.①③
C.②③ D.①④
11.某同学用下列装置制备并检验Cl2的性质:
下列说法正确的是( )。
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B.Ⅱ图中:生成蓝色的烟
C.Ⅱ图中:生成棕黄色的烟
D.Ⅲ图中:干燥的有色布条褪色,湿润的有色布条不褪色
12.
某兴趣小组设计如图所示装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气,下列叙述中错误的是(Cl2能与KI反应生成I2,淀粉溶液遇I2变蓝)( )
A.钠在氯气中燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
13.现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式:
①纯净的A在B中安静地燃烧生成C ;
②将气体B通入水中 ;
③将气体B通入NaOH溶液中 ;
④将气体B通入适量石灰乳中 。
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是 (用字母表示)。
(3)白色浑浊物D因具有漂白性又称为 ,该物质在空气中容易变质的原因为(用化学方程式表示) 。
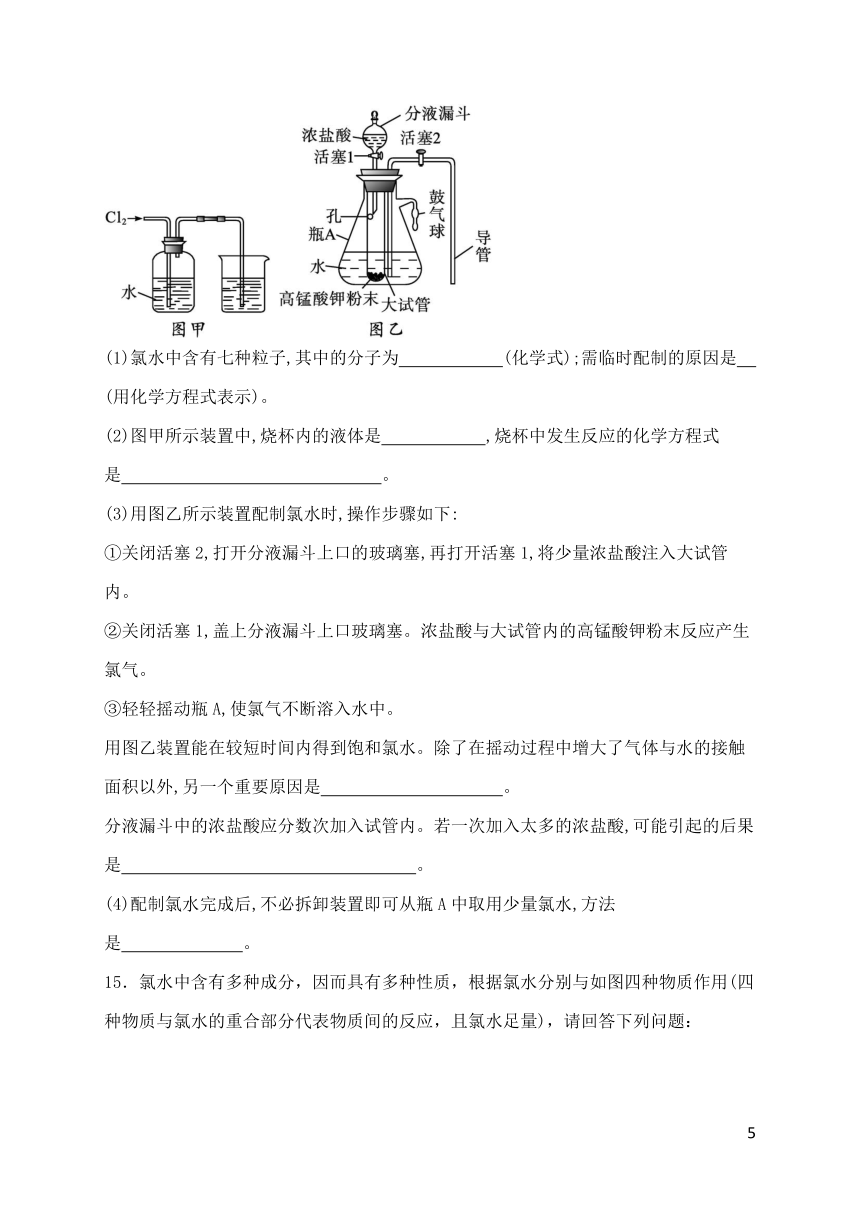
14.氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。
(1)氯水中含有七种粒子,其中的分子为 (化学式);需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 ,烧杯中发生反应的化学方程式是 。
(3)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸与大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体与水的接触面积以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是 。
15.氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:
(1)反应d中,将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中错误的是________。
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色,外环呈红色或浅红色
C.内外环上颜色的差异表明此变化过程中,酸使指示剂的颜色变化比氧化还原反应慢
D.氯气与水反应中氧化产物是HClO
(2)反应c的现象是________________________________________________________________________。
(3)反应b有气体产生,生成该气体反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(4)久置的氯水最终会变成_________(填名称),则反应a的化学方程式表示为________________________________________________________________________
________________________________________________________________________。
1.答案:B
解析:氯气和液氯是同一种物质,只是状态不同,而氯水则是Cl2的水溶液,是混合物,B项错误。
2.答案:D
解析:铜与盐酸不反应,A项不符合题意;铁与氯气反应生成FeCl3,与盐酸反应生成FeCl2,故B、C项不符合题意。
3.答案:C
解析:能使干燥的蓝色石蕊试纸先变红后褪色,要求该物质具有酸性和漂白性。①和②中只有Cl2分子;③中Cl2与水反应生成HCl和HClO;④中Cl2分子与CCl4溶剂之间不反应,不能产生H+和HClO;⑤中盐酸只有酸性无漂白性;⑥中发生反应:Ca(ClO)2+2HClCaCl2+2HClO,且盐酸过量。
4.答案:D
解析:H2和Cl2的混合气体在光照下易发生爆炸,工业上利用H2在Cl2中燃烧来制取盐酸,A项错误;工业上以氯气和石灰乳为原料制造漂白粉,B项错误、C项错误;如果漂白粉露置在潮湿的空气中,会缓慢变质而失效,发生反应的化学方程式为Ca(ClO)2+CO2+H2OCaCO3+2HClO,2HClO2HCl+O2↑,D项正确。
5.答案:B
解析:氯气与金属反应时生成金属氯化物,固体增大的质量,即为参加反应的氯气的质量,且氯气与变价金属反应时,都生成高价态金属氯化物。根据金属单质0.2 mol与氯气完全反应消耗氯气0.2 mol(14.2 g)可知该金属表现+2价,B项正确。
6.答案:B
解析:HClO易分解,久置氯水实际是盐酸,因此只能使紫色石蕊试液变红,而不能使其褪色,A项错误;含氯漂白剂与洁厕剂会发生氧化还原反应,不仅会失效,还会产生有毒气体氯气,B项正确;漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,C项错误;新制氯水的成分有Cl2、H+、ClO-、OH-、Cl-、HClO、H2O,不含有Ca(ClO)2,D项错误。
7.答案:B
解析:A项,使有色布条褪色的物质是HClO;B项,氯水呈浅黄绿色是因为溶有Cl2;C项,因为先加盐酸酸化,已经引入了Cl-,不能确定氯水中是否含有Cl-;D项,Cl2与NaOH发生反应。
8.答案:AB
解析:a是HCl,b是Cl2,c是ClO2,d是HClO,e可能是NaClO3,f可能是NaClO。加热条件下,浓盐酸与二氧化锰反应制取Cl2,A项错误;Cl2能与NaHCO3反应,除去Cl2中混有的HCl气体不能将混合气体通入饱和NaHCO3溶液,应将混合气体通入饱和NaCl溶液,B项错误;ClO2和NaClO均具有强氧化性,可用于环境杀菌消毒,C项正确;HClO、KClO3分解都能生成O2,D项正确。
9.答案:B
解析:在ClO2发生器中产生ClO2气体,通入空气,可以将生成的ClO2气体吹入吸收器中进行吸收,A项正确;吸收器中加入了浓氢氧化钠溶液,显然不可能得到HClO2,B项错误;冷却结晶得到NaClO2固体后,应该经过过滤、洗涤、干燥得到产品,C项正确;气体的贮存和运输都远比固体困难,将ClO2气体制成NaClO2固体的主要目的是便于贮存和运输,D项正确。
10.答案:D
解析:①氯气密度比空气大,可用向上排空气法收集氯气,正确;②氯气能溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,错误;③氯气不具有漂白性,错误;④氯气可与氢氧化钠反应,可用于实验室中氯气的尾气吸收,正确。
11.答案:C
解析:稀盐酸与MnO2不反应,A项不正确;无水CuCl2不为蓝色,形成的是棕黄色的烟,B项不正确,C项正确;干燥的有色布条不褪色,湿润的有色布条褪色,D项不正确。
12.答案:D
解析:棉球②变蓝色则证明碱液已经反应完全,有过量Cl2通过棉球①与棉球②中KI反应,故D项错误
13.答案:(1)①H2+Cl22HCl
②Cl2+H2OHCl+HClO
③Cl2+2NaOHNaCl+NaClO+H2O
④2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
(2)BC
(3)漂白粉 Ca(ClO)2+H2O+CO2CaCO3+2HClO,2HClO2HCl+O2↑
解析:A是密度最小的气体,为氢气;B在通常情况下呈黄绿色,为氯气;纯净的A可以在B中安静地燃烧生成C,则C为氯化氢。把氯气通入适量石灰乳中可以得到白色浑浊物
为氯化钙和次氯酸钙的混合物。
(2)HCl和Cl2通入酸性硝酸银溶液中,都生成AgCl白色沉淀。
(3)白色浑浊物D因具有漂白性又称为漂白粉,该物质在空气中容易变质的原因为Ca(ClO)2+H2O+CO2CaCO3+2HClO,2HClO2HCl+O2↑。
14.答案:(1)Cl2、H2O、HClO 2HClO2HCl+O2↑
(2)NaOH溶液 Cl2+2NaOHNaCl+NaClO+H2O
(3)氯气在瓶内产生较大压强,增大了氯气的溶解度 瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡胶塞弹开
(4)打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气
解析:(1)在氯水中的分子有Cl2、H2O、HClO;因为次氯酸能见光分解生成氧气和HCl,所以需要临时配制,化学方程式为2HClO2HCl+O2↑。
(2)烧杯中的液体是为了吸收氯气的,所以使用NaOH溶液;氯气与氢氧化钠反应的化学方程式为Cl2+2NaOHNaCl+NaClO+H2O。
15.答案: (1)C (2)有白色沉淀生成
(3)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(4)盐酸 2HClO2HCl+O2↑
解析:(1)氯水滴到试纸中央,会从中间向四周慢慢扩散,因此刚接触氯水的部分会因其酸性而变红,接触时间久的部位因其氧化性而被漂白,A正确;内环被漂白,呈白色,外环是红色或浅红色,B正确;内环接触时间久,外环接触时间短尚未被漂白,因此证明变色反应的速率比氧化还原反应的速率快,C错误;氯气与水反应歧化,得到的氧化产物为次氯酸,D正确。(2)氯水中含有Cl-,与硝酸银溶液反应生成AgCl的白色沉淀。(3)反应b实际上就是盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑。(4)久置氯水实际上就是稀盐酸,反应a是次氯酸遇光发生分解反应生成氯化氢和氧气,反应的化学方程式为2HClO2HCl+O2↑。
7
1.下列有关氯气的叙述中不正确的是( )。
A.氯气是一种黄绿色、有刺激性气味的气体
B.氯气、液氯、氯水是同一种物质
C.氯气能溶于水
D.氯气是一种有毒气体
2.下列氯化物中,既能由金属与氯气直接反应制得,又能由金属与盐酸反应制得的是( )。
A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3
3.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )。
①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液 ⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液
A.①②③ B.①②⑥
C.③⑥ D.③④⑤
4.由于氯气不便于保存,生活中常用的含氯消毒剂是“84”消毒液或漂白粉。下列关于工业生产的说法正确的是( )。
A.工业上利用H2和Cl2的混合气体在光照下反应来制取盐酸
B.工业上以氯气和澄清石灰水为原料制造漂白粉
C.工业上将氯气溶于NaOH溶液中制造漂白粉
D.漂白粉要干燥和密封保存
5.0.2 mol某单质直接与氯气完全反应,固体质量增大14.2 g,该单质可能是( )。
A.钠 B.铜
C.铝 D.铁
6.下列说法正确的是( )。
A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色
B.含氯漂白剂不能与洁厕剂(含有盐酸)混合使用
C.漂白粉的有效成分是CaCl2和Ca(ClO)2
D.氯水的成分为Cl2和Ca(ClO)2,应密封保存
7.在氯水中存在许多分子和离子,它们在不同的反应中表现各自的性质,下列的实验和结论一致的是( )。
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2的存在
B.溶液呈浅黄绿色,且有刺激性气味,说明溶液中有Cl2的存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明氯水中有Cl-的存在
D.加入NaOH溶液,氯水浅黄绿色消失,说明溶液中有HClO分子的存在
8.(双选)下图为氯气及氯的化合物的“价—类”二维图,下列叙述错误的是( )。
A.常温下,a的稀溶液与二氧化锰反应可制取b
B.除去b中混有的a气体的方法是将混合气体通入饱和NaHCO3溶液
C.c和f均可用于环境杀菌消毒
D.d与e的钾盐都能在一定条件下分解生成一种相同的气体单质
9.ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是( )。
A.通入的空气可将发生器中产生的ClO2全部吹入吸收器中
B.吸收器中反应的化学方程式为2ClO2+H2O22HClO2+O2↑
C.步骤a的操作包括过滤、洗涤和干燥
D.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
10.下列关于氯气的实验装置能达到实验目的的是( )。
①可用于氯气的收集 ②可用于除去氯气中少量的氯化氢气体 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A.①② B.①③
C.②③ D.①④
11.某同学用下列装置制备并检验Cl2的性质:
下列说法正确的是( )。
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B.Ⅱ图中:生成蓝色的烟
C.Ⅱ图中:生成棕黄色的烟
D.Ⅲ图中:干燥的有色布条褪色,湿润的有色布条不褪色
12.
某兴趣小组设计如图所示装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气,下列叙述中错误的是(Cl2能与KI反应生成I2,淀粉溶液遇I2变蓝)( )
A.钠在氯气中燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
13.现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式:
①纯净的A在B中安静地燃烧生成C ;
②将气体B通入水中 ;
③将气体B通入NaOH溶液中 ;
④将气体B通入适量石灰乳中 。
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是 (用字母表示)。
(3)白色浑浊物D因具有漂白性又称为 ,该物质在空气中容易变质的原因为(用化学方程式表示) 。
14.氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。
(1)氯水中含有七种粒子,其中的分子为 (化学式);需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 ,烧杯中发生反应的化学方程式是 。
(3)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸与大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体与水的接触面积以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是 。
15.氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:
(1)反应d中,将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中错误的是________。
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色,外环呈红色或浅红色
C.内外环上颜色的差异表明此变化过程中,酸使指示剂的颜色变化比氧化还原反应慢
D.氯气与水反应中氧化产物是HClO
(2)反应c的现象是________________________________________________________________________。
(3)反应b有气体产生,生成该气体反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(4)久置的氯水最终会变成_________(填名称),则反应a的化学方程式表示为________________________________________________________________________
________________________________________________________________________。
1.答案:B
解析:氯气和液氯是同一种物质,只是状态不同,而氯水则是Cl2的水溶液,是混合物,B项错误。
2.答案:D
解析:铜与盐酸不反应,A项不符合题意;铁与氯气反应生成FeCl3,与盐酸反应生成FeCl2,故B、C项不符合题意。
3.答案:C
解析:能使干燥的蓝色石蕊试纸先变红后褪色,要求该物质具有酸性和漂白性。①和②中只有Cl2分子;③中Cl2与水反应生成HCl和HClO;④中Cl2分子与CCl4溶剂之间不反应,不能产生H+和HClO;⑤中盐酸只有酸性无漂白性;⑥中发生反应:Ca(ClO)2+2HClCaCl2+2HClO,且盐酸过量。
4.答案:D
解析:H2和Cl2的混合气体在光照下易发生爆炸,工业上利用H2在Cl2中燃烧来制取盐酸,A项错误;工业上以氯气和石灰乳为原料制造漂白粉,B项错误、C项错误;如果漂白粉露置在潮湿的空气中,会缓慢变质而失效,发生反应的化学方程式为Ca(ClO)2+CO2+H2OCaCO3+2HClO,2HClO2HCl+O2↑,D项正确。
5.答案:B
解析:氯气与金属反应时生成金属氯化物,固体增大的质量,即为参加反应的氯气的质量,且氯气与变价金属反应时,都生成高价态金属氯化物。根据金属单质0.2 mol与氯气完全反应消耗氯气0.2 mol(14.2 g)可知该金属表现+2价,B项正确。
6.答案:B
解析:HClO易分解,久置氯水实际是盐酸,因此只能使紫色石蕊试液变红,而不能使其褪色,A项错误;含氯漂白剂与洁厕剂会发生氧化还原反应,不仅会失效,还会产生有毒气体氯气,B项正确;漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,C项错误;新制氯水的成分有Cl2、H+、ClO-、OH-、Cl-、HClO、H2O,不含有Ca(ClO)2,D项错误。
7.答案:B
解析:A项,使有色布条褪色的物质是HClO;B项,氯水呈浅黄绿色是因为溶有Cl2;C项,因为先加盐酸酸化,已经引入了Cl-,不能确定氯水中是否含有Cl-;D项,Cl2与NaOH发生反应。
8.答案:AB
解析:a是HCl,b是Cl2,c是ClO2,d是HClO,e可能是NaClO3,f可能是NaClO。加热条件下,浓盐酸与二氧化锰反应制取Cl2,A项错误;Cl2能与NaHCO3反应,除去Cl2中混有的HCl气体不能将混合气体通入饱和NaHCO3溶液,应将混合气体通入饱和NaCl溶液,B项错误;ClO2和NaClO均具有强氧化性,可用于环境杀菌消毒,C项正确;HClO、KClO3分解都能生成O2,D项正确。
9.答案:B
解析:在ClO2发生器中产生ClO2气体,通入空气,可以将生成的ClO2气体吹入吸收器中进行吸收,A项正确;吸收器中加入了浓氢氧化钠溶液,显然不可能得到HClO2,B项错误;冷却结晶得到NaClO2固体后,应该经过过滤、洗涤、干燥得到产品,C项正确;气体的贮存和运输都远比固体困难,将ClO2气体制成NaClO2固体的主要目的是便于贮存和运输,D项正确。
10.答案:D
解析:①氯气密度比空气大,可用向上排空气法收集氯气,正确;②氯气能溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体,错误;③氯气不具有漂白性,错误;④氯气可与氢氧化钠反应,可用于实验室中氯气的尾气吸收,正确。
11.答案:C
解析:稀盐酸与MnO2不反应,A项不正确;无水CuCl2不为蓝色,形成的是棕黄色的烟,B项不正确,C项正确;干燥的有色布条不褪色,湿润的有色布条褪色,D项不正确。
12.答案:D
解析:棉球②变蓝色则证明碱液已经反应完全,有过量Cl2通过棉球①与棉球②中KI反应,故D项错误
13.答案:(1)①H2+Cl22HCl
②Cl2+H2OHCl+HClO
③Cl2+2NaOHNaCl+NaClO+H2O
④2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
(2)BC
(3)漂白粉 Ca(ClO)2+H2O+CO2CaCO3+2HClO,2HClO2HCl+O2↑
解析:A是密度最小的气体,为氢气;B在通常情况下呈黄绿色,为氯气;纯净的A可以在B中安静地燃烧生成C,则C为氯化氢。把氯气通入适量石灰乳中可以得到白色浑浊物
为氯化钙和次氯酸钙的混合物。
(2)HCl和Cl2通入酸性硝酸银溶液中,都生成AgCl白色沉淀。
(3)白色浑浊物D因具有漂白性又称为漂白粉,该物质在空气中容易变质的原因为Ca(ClO)2+H2O+CO2CaCO3+2HClO,2HClO2HCl+O2↑。
14.答案:(1)Cl2、H2O、HClO 2HClO2HCl+O2↑
(2)NaOH溶液 Cl2+2NaOHNaCl+NaClO+H2O
(3)氯气在瓶内产生较大压强,增大了氯气的溶解度 瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡胶塞弹开
(4)打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气
解析:(1)在氯水中的分子有Cl2、H2O、HClO;因为次氯酸能见光分解生成氧气和HCl,所以需要临时配制,化学方程式为2HClO2HCl+O2↑。
(2)烧杯中的液体是为了吸收氯气的,所以使用NaOH溶液;氯气与氢氧化钠反应的化学方程式为Cl2+2NaOHNaCl+NaClO+H2O。
15.答案: (1)C (2)有白色沉淀生成
(3)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(4)盐酸 2HClO2HCl+O2↑
解析:(1)氯水滴到试纸中央,会从中间向四周慢慢扩散,因此刚接触氯水的部分会因其酸性而变红,接触时间久的部位因其氧化性而被漂白,A正确;内环被漂白,呈白色,外环是红色或浅红色,B正确;内环接触时间久,外环接触时间短尚未被漂白,因此证明变色反应的速率比氧化还原反应的速率快,C错误;氯气与水反应歧化,得到的氧化产物为次氯酸,D正确。(2)氯水中含有Cl-,与硝酸银溶液反应生成AgCl的白色沉淀。(3)反应b实际上就是盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为Na2CO3+2HCl===2NaCl+H2O+CO2↑。(4)久置氯水实际上就是稀盐酸,反应a是次氯酸遇光发生分解反应生成氯化氢和氧气,反应的化学方程式为2HClO2HCl+O2↑。
7
