1.3 电能转化为化学能——电解 同步练习题(含解析)2023-2024学年高二上学期鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.3 电能转化为化学能——电解 同步练习题(含解析)2023-2024学年高二上学期鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 749.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-02 13:02:59 | ||
图片预览


文档简介
1.3 电能转化为化学能——电解 同步练习题
一、单选题
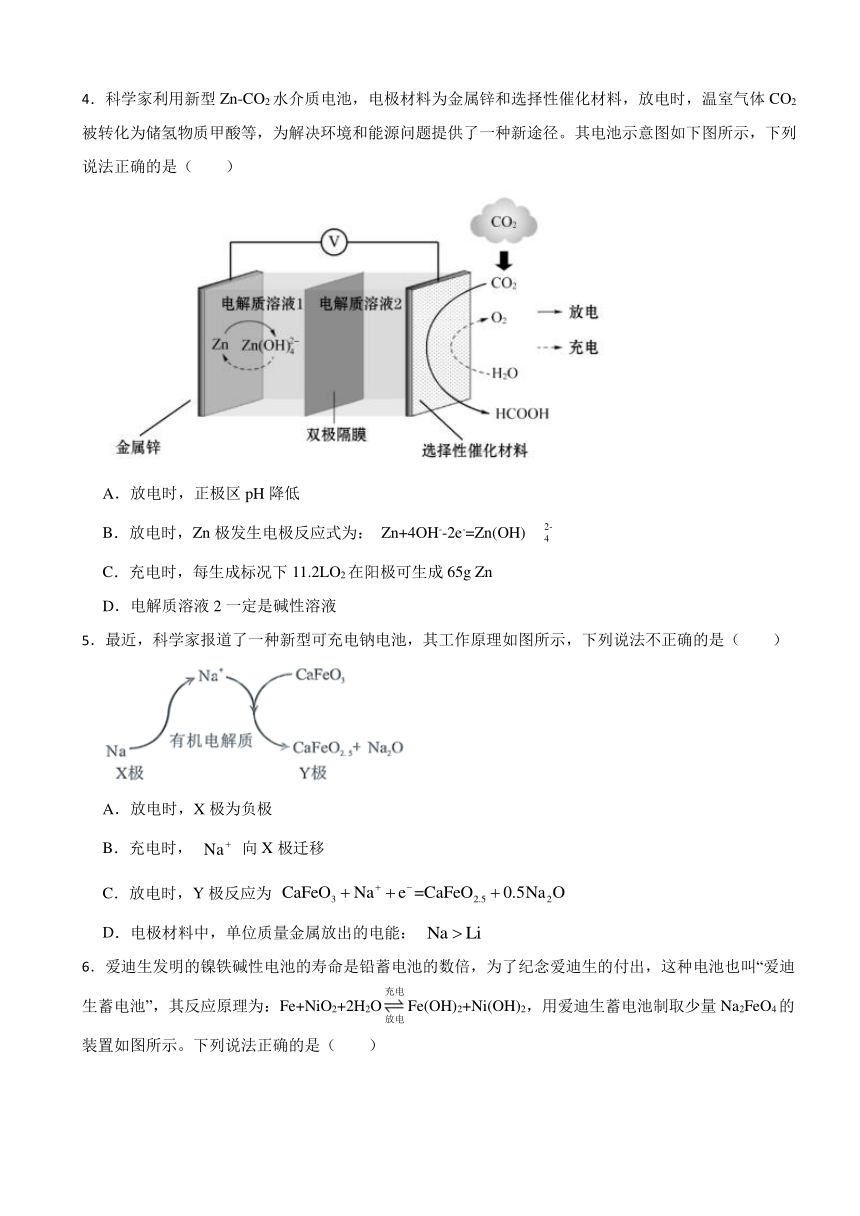
1.某学生设计了一种家用消毒液发生器,装置如图所示。下列说法错误的是( )
A.该消毒液发生器的原理与氯碱工业一致
B.通电时阳极反应式为:
C.通电时电子从阳极经食盐溶液流向阴极
D.该装置的优点是随制随用,防止消毒液久置失效
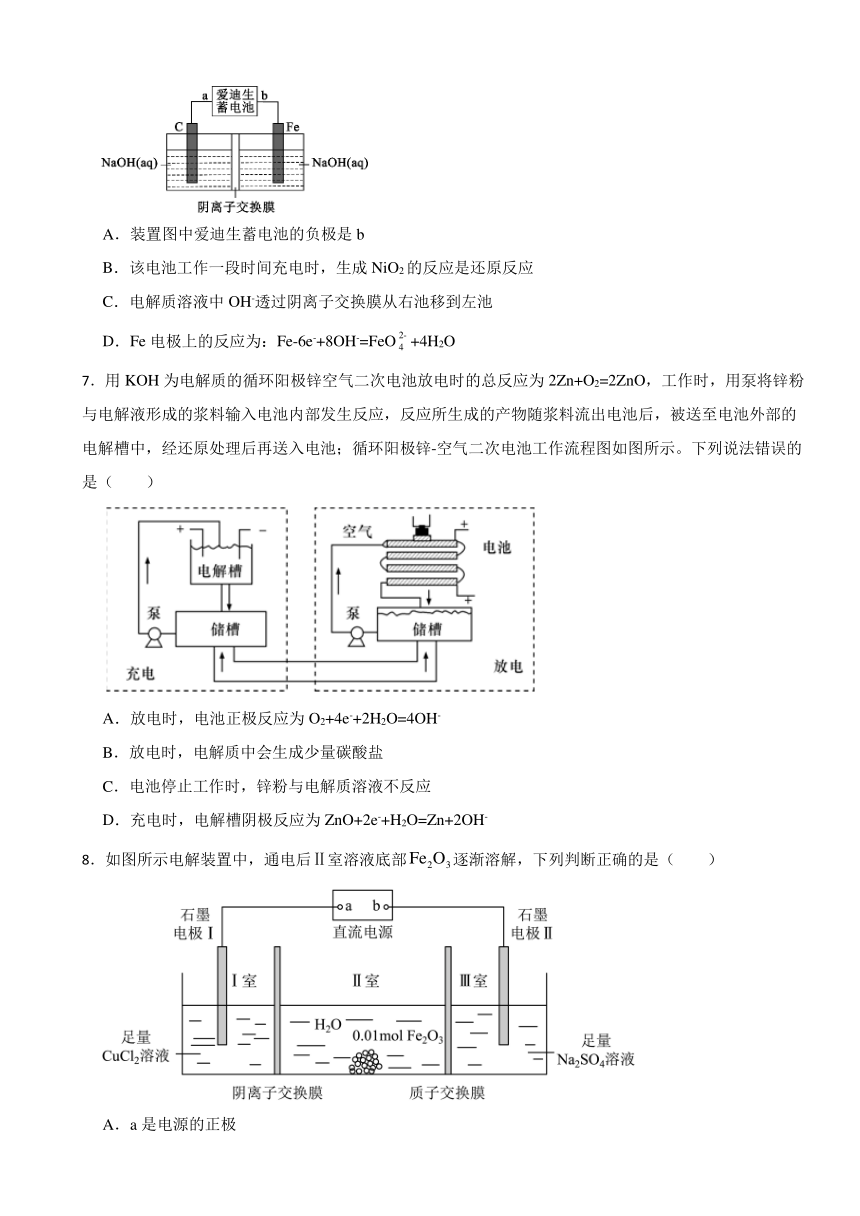
2.工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF=KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是( )
A.钢电极与电源的负极相连 B.电解过程中需不断补充的X是KF
C.阴极室与阳极室必须隔开 D.氟氢化钾在氟化氢中可以电离
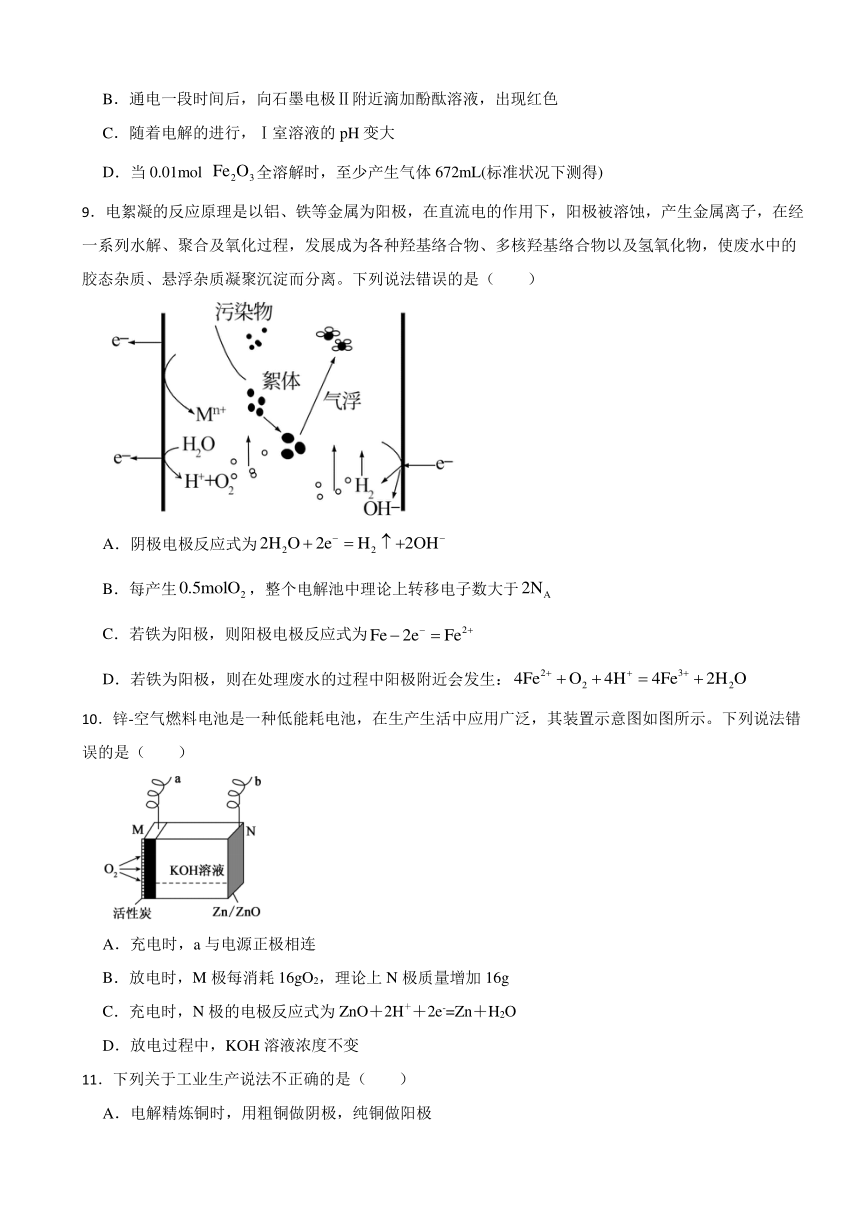
3.关于下列各装置图的叙述中,不正确的是( )
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用装置①进行电镀,镀件接在b极上
C.装置②的总反应:Cu+2Fe3+=Cu2++2Fe2+
D.装置③中的铁钉几乎没有被腐蚀
4.科学家利用新型Zn-CO2水介质电池,电极材料为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。其电池示意图如下图所示,下列说法正确的是( )
A.放电时,正极区pH降低
B.放电时,Zn极发生电极反应式为: Zn+4OH--2e-=Zn(OH)
C.充电时,每生成标况下11.2LO2在阳极可生成65g Zn
D.电解质溶液2一定是碱性溶液
5.最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,下列说法不正确的是( )
A.放电时,X极为负极
B.充电时, 向X极迁移
C.放电时,Y极反应为
D.电极材料中,单位质量金属放出的电能:
6.爱迪生发明的镍铁碱性电池的寿命是铅蓄电池的数倍,为了纪念爱迪生的付出,这种电池也叫“爱迪生蓄电池”,其反应原理为:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2,用爱迪生蓄电池制取少量Na2FeO4的装置如图所示。下列说法正确的是( )
A.装置图中爱迪生蓄电池的负极是b
B.该电池工作一段时间充电时,生成NiO2的反应是还原反应
C.电解质溶液中OH-透过阴离子交换膜从右池移到左池
D.Fe电极上的反应为:Fe-6e-+8OH-=FeO+4H2O
7.用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
8.如图所示电解装置中,通电后Ⅱ室溶液底部逐渐溶解,下列判断正确的是( )
A.a是电源的正极
B.通电一段时间后,向石墨电极Ⅱ附近滴加酚酞溶液,出现红色
C.随着电解的进行,Ⅰ室溶液的pH变大
D.当0.01mol 全溶解时,至少产生气体672mL(标准状况下测得)
9.电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法错误的是( )
A.阴极电极反应式为
B.每产生,整个电解池中理论上转移电子数大于
C.若铁为阳极,则阳极电极反应式为
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:
10.锌-空气燃料电池是一种低能耗电池,在生产生活中应用广泛,其装置示意图如图所示。下列说法错误的是( )
A.充电时,a与电源正极相连
B.放电时,M极每消耗16gO2,理论上N极质量增加16g
C.充电时,N极的电极反应式为ZnO+2H++2e-=Zn+H2O
D.放电过程中,KOH溶液浓度不变
11.下列关于工业生产说法不正确的是( )
A.电解精炼铜时,用粗铜做阴极,纯铜做阳极
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在炼铁工业,需要的原料有铁矿石、焦炭、空气、石灰石等
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
12.下列有关化工生产的叙述中,正确的是( )
A.工业上可用氯化钠制备化肥NH4Cl
B.氯碱工业中,电解槽的阳极区产生NaOH
C.在接触室被氧化成SO3,SO3在吸收塔内被水吸收制成浓硫酸
D.工业上用石英制太阳能电池,在高温下用铝热法炼铁制备钢材
13.具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH- FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是( )
A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
14.中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示。充电过程中,石墨电极发生阴离子插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
A.放电时,电解质中的Li+向左端电极移动
B.充电时,与外加电源负极相连一端电极反应为:AlLi-e-=Li++Al
C.放电时,正极反应式为Cn(PF6)+e-=PF6-+Cn
D.充电时,若转移0.2mol电子,则铝电极上增重5.4g
15.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1 mol·L-1NaClO溶液中含有的ClO-数目为NA
B.在电解精炼粗铜的过程中,当阴极质量增重32g时转移的电子数为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中含有C-O键的数目为NA
D.氢氧燃料电池正极消耗22.4 L气体时,负极消耗气体的分子数为2NA
16.通过电解废旧锂电池中的可获得难溶性的和,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过,电解过程中溶液的体积变化忽略不计)。下列说法错误的是( )
A.电极B区的通过滤布向电极A迁移
B.电极A的电极发应:
C.电解一段时间后溶液中浓度保持不变
D.电解结束,可通过调节pH除去,再加入溶液以获得
二、综合题
17.NaClO广泛用作消杀剂、水处理剂及漂白剂等。
已知:NaClO溶液中物种分布分数与溶液pH的关系如图1所示。
(1)向NaClO溶液中通入CO2,发生反应的离子方程式为 (H2CO3的lgKa1、lgKa2依次为-6.38、-10.21);反应ClO-+H2O HClO+OH-的lgK= 。
(2)用Na+导体陶瓷膜电解法生产次氯酸钠溶液的装置如图2所示。
①阳极产生Cl2的电极反应式为 。
②其他条件不变,若撤去“Na+导体陶瓷膜”,NaClO的产率则会降低,其主要原因是 。
(3)NaClO溶液中ClO-与H2O产生更强氧化性的HClO,可将水体中氨氮氧化为N2(NH3比NH 更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
①NaClO氧化NH3的化学方程式为 。
②pH在3~7时,随pH增大氨氮去除率升高的原因是 。
③pH在7~9时,随pH增大氨氮去除率降低的原因是 。
18.1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家都创立了要为先进的侯德邦制碱法,也叫联合制碱法,两种制碱的生产流程可需要表示如图1:
图1 图2
(1)向沉淀池中通入CO2和氮气时,应先通入氮气的原因是 ;
(2)沉淀池中发生反应的化学反应方程式是 ;
(3)氨碱法生产流程示意图的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ;
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确的是 (选填编号)
A.常温时氯化铵的溶解度比氯化钠小
B.通入氨气能增大NH4+的浓度,使氯化铵更多析出
C.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
D.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合剂碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环I.联合制碱法的另一项优点是 .
(6)从沉淀地析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液确定(用甲基酸提示剂),测定值记录如下:
滴定次数 待测液(mL) 0.6000mol/L盐酸溶液的体积(mL)
初读数 终读数
第一次 20.00 1.00 21.00
第二次 20.00 如图2Ⅰ 如图2Ⅱ
①第二次滴定,从图Ⅰ图Ⅱ显示消耗的盐酸溶液体积为 ;
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)= .
19.以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)已知:2C(s)+O2(g)=2CO(g) H1= a kJ/mol
N2(g)+O2(g)=2NO(g) H2= b kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g) H3= c kJ/mol
则2NO(g)+C(s) = CO2(g)+N2(g) H= kJ/mol
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。
已知2NO(g)+2CO(g) N2(g)+2CO2(g) H<0。
①在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是 。
A.v(CO)正 = 2v(N2)逆 B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变 D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
②向1L密闭容器中通入1mol的NO和1mol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:
T1 T2(填“>”、“<”),理由是 。M点时混合气体中CO的体积分数为 。
③一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min 0 1 2 3 4 5
p/kPa 200 185 173 165 160 160
该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),该反应中的v正=k正·p2(NO)p2(CO),v逆=k逆·p(N2)p2(CO2),则该反应达到平衡时,k正 k逆(填“>”、“<”或“=”)。
(3)间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过)。电极Ⅰ接电源负极,其电极反应式为: 。标准状况下,每处理2 mol NO,得到 LO2
20.如图是一个化学过程的示意图.请回答下列问题:
(1)甲池是 装置(填“原电池”或“电解池”),B(石墨)电极的名称 是 .
(2)写出电极反应式:
通入CH4的电极 ;A(Fe)电极 .
(3)甲池中反应的离子方程式为 .
(4)乙池中反应的化学方程式为 .
(5)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中 A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= .
21.电化学原理有着重要的应用。
(1)探究电化学反应的规律
某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验装置如图所示。
①甲烷燃料电池工作时,负极上通入的气体为 (填化学式);闭合开关K后a、b电极上均有气体产生,其中a电极上得到的气体为 (填化学式)。
②若每个电池甲烷通入量均为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为 L(标准状况)。
(2)探究氧化还原反应的规律
为探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响,设计如图实验。
编号 甲 乙
实验
现象 电流计发生较小偏转,3min时无明显现象 电流计发生明显偏转,30s时,左边烧杯石墨电极上产生气体;右边烧杯石墨电极上产生白色沉淀(经检验为CuCl)
①实验乙中右边烧杯电极的反应式为 。
②已知E为电池电动势【又称理论电压,为两个电极电位之差,即E=E(+)-E(-)】,根据实验可知,甲电池与乙电池相比较,E甲 E乙(填“>”、“<”或“=”)。
③从氧化还原反应的角度分析,Cl-对反应的影响为 (填选项字母)。
A.增强了Cu2+的氧化性 B.减弱了Cu2+氧化性
C.增强了HSO的还原性 D.减弱了HSO的还原性
答案解析部分
1.【答案】C
【解析】【解答】A.该装置原理为电解食盐溶液,与氯碱工业一致,A项不符合题意;
B.通电时阳极反应式为2Cl--2e-=Cl2↑,B项不符合题意;
C.溶液中只有阴阳离子没有电子,且电子不能经过电解质溶液,C项符合题意;
D.该装置的优点是随制随用,以防久置的次氯酸钠分解失效,D项不符合题意;
故答案为:C。
【分析】A.该原理为电解食盐水;
B.电解食盐水时,阳极上氯离子失去电子发生氧化反应生成氯气;
C.电子不经过电解质溶液;
D.该装置可以随制随用。
2.【答案】B
【解析】【解答】A、根据装置图,KHF2中H元素显+1价,钢电极上析出H2,表明钢电极上发生得电子的还原反应,即钢电极是电解池的阴极,钢电极与电源的负极相连,故A说法不符合题意;
B、根据装置图,逸出的气体为H2和F2,说明电解质无水溶液中减少的是氢和氟元素,因此电解过程需要不断补充的X是HF,故B说法符合题意;
C、阳极室生成氟气,阴极室产生H2,二者接触发生剧烈反应甚至爆炸,因此必须隔开防止氟气与氢气接触,故C说法不符合题意;
D、由氟氢化钾的氟化氢无水溶液可以导电,可推知氟氢化钾在氟化氢中发生电离,故D说法不符合题意。
【分析】在电解池中,阳极与电源正极相连,失去电子,化合价升高,做还原剂,阴极与电源负极相连,得到电子,化合价降低,做氧化剂。
3.【答案】C
【解析】【解答】A.①中根据电流流向可知,a为阳极,b为阴极,电解精炼铜时,阳极为粗铜,故A不符合题意
B.电镀时,镀件为阴极,故B不符合题意
C.铁和铜,铁作负极,故总反应为铁和铁离子反应,生成亚铁离子,故C符合题意
D.铁和铜,在浓硫酸中,铁在冷的浓硫酸中发生钝化,故D不符合题意
故答案为:C
【分析】C中铁比铜活泼,故发生反应的是铁,保护了铜
4.【答案】B
【解析】【解答】A.放电时,二氧化碳转化为甲酸,碳原子价态降低,故其为正极反应,反应式为: ,所以放电时正极消耗氢离子,pH升高,故A不符合题意;
B.放电时,介质为水,故负极反应为: ,故B符合题意;
C.根据上述反应式可以发现,充电时阳极失电子发生氧化反应,而Zn应在阴极生成,故C不符合题意;
D.电解质溶液2若为碱性,则甲酸应以HCOO-形式存在,故D不符合题意。
故答案为:B。
【分析】放电时,锌做负极发生的是锌失去电子结合氢氧根变为Zn(OH)42-,即发生 ,正极是二氧化碳得到电子变为变为甲酸,即,导致正极负极的pH增大,因此电解质2的溶液显酸性,充电时,阳极生的反应是2H2O-4e=4H++O2,阴极发生的是Zn(OH)42-+2e=Zn+4OH-,即可计算出锌的质量
5.【答案】D
【解析】【解答】A.放电时,该电池为原电池,X极上钠失电子形成钠离子,发生氧化反应,为原电池的负极,故A不符合题意;
B.充电时,X极是阴极, 向X极迁移,故B不符合题意;
C.放电时,该装置为原电池,Y极为原电池的正极,由图可知CaFeO3转化为CaFeO2.5,电极反应为: ,故C不符合题意;
D.锂的摩尔质量比钠小,故锂单位质量输出的电能多,单位质量金属放出的电能: Li>Na,故D符合题意;
故答案为:D。
【分析】 Na和Li都容易失去一个电子,但在做电极材料时,由于锂的摩尔质量较小,因此单位质量金属锂放出的电能更大。
6.【答案】D
【解析】【解答】 Fe+NiO2+2H2OFe(OH)2+Ni(OH)2, Fe化合价升高,Fe在负极失去电子,Ni化合价降低,在正极得到电子,制取Na2FeO4时,Fe失去电子生成FeO42-,则Fe作为阳极,C作为阴极;
A、b连接Fe,则b为正极,A错误;
B、充电时Ni化合价升高,发生氧化反应,B错误;
C、OH-为阴离子,移向阳极,即移向Fe,C错误;
D、Fe失去电子,结合氢氧根生成高铁酸根和水,即 Fe-6e-+8OH-=FeO+4H2O ,D正确;
故答案为:D
【分析】新型二次电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒;若是充电过程,则负极作为阴极,正极作为阳极,阴极电极反应式为负极的逆反应,阳极的电极反应式为正极的逆反应;
电解池要注意:
连接外接电源正极的为阳极,若阳极为活性电极则阳极失去电子,若阳极为惰性电极,则溶液中的阴离子在阳极失去电子,阳极发生氧化反应;连接外接电源负极的为阴极,溶液中的阳离子在阴极得到电子,阴极发生还原反应。
7.【答案】C
【解析】【解答】A. 放电时,电池正极通入空气中的O2,在碱性溶液中得电子生成OH-,A不符合题意;
B. 放电时,正极通入空气中的CO2,会与KOH反应生成少量K2CO3,B不符合题意;
C. 电池停止工作时,锌粉仍会与KOH溶液发生缓慢反应,C符合题意;
D. 充电时,电解槽阴极(放电时,Zn转化为ZnO)Zn表面的ZnO得电子,生成Zn和OH-,电极反应式为ZnO+2e-+H2O=Zn+2OH-,D不符合题意;
故答案为:C。
【分析】锌和铝的性质类似,能与KOH发生反应
8.【答案】C
【解析】【解答】A.由分析可知,a是电源的负极,故A不符合题意;
B.石墨电极Ⅱ为阳极,电极反应式为2H2O-4e=O2↑+4H+,4H+向室Ⅱ移动需要一定时间,所以石墨电极Ⅱ附近显酸性,滴加酚酞溶液,不变色,故B不符合题意;
C.CuCl2溶液因水解显酸性,随着电解的进行,Ⅰ室铜离子在阴极得电子生成铜单质,所以CuCl2溶液浓度变小,酸性减弱,pH增大,故C符合题意;
D.Fe2O3溶解的反应为Fe2O3+6H+=2Fe3++3H2O,当0.01mol Fe2O3完全溶解时,消耗氢离子为0.06mol,根据阳极电极反应式2H2O - 4e =O2↑+ 4H+,产生氧气为0.015mol,体积为336mL (折合成标准状况下),故D不符合题意;
故答案为:C。
【分析】电解池的题目要注意几个问题:
1、连接外接电源正极的为阳极,若阳极为活性电极则阳极失去电子,若阳极为惰性电极,则溶液中的阴离子在阳极失去电子,阳极发生氧化反应;连接外接电源负极的为阴极,溶液中的阳离子在阴极得到电子,阴极发生还原反应;
2、溶液中的离子放电顺序:
阳离子:Ag+ > Hg2+ > Fe3+ > Cu2+ > H+(酸) > Pb2+ > Sn2+ > Fe2+ >Zn2+ > H+(水);
阴离子:S2– >I-> Br- > Cl- > OH-> (NO3-、SO42– 等)含氧酸根 > F-;
3、电极反应式的书写要结合原子守恒以及溶液形成判断,酸性条件不出现氢氧根,碱性条件下不出现氢离子。
9.【答案】C
【解析】【解答】A.阴极氢离子得电子发生还原反应,电极反应式为2H2O+2e-=H2+2OH-,故A不符合题意;
B.由装置图可知,若铁为阳极,阳极电极方程式有Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,所以每产生0.5mol O2整个电解池中理论上转移电子数为大于2NA,故B不符合题意;
C.由装置图可知,若铁为阳极,则阳极电极方程式为Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,故C符合题意;
D.若铁为阳极,阳极电极方程式为Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,在处理废水的过程中二价铁还被放出的氧气氧化成三价铁.离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故D不符合题意;
故答案为:C。
【分析】由图可知,左边电极水失去电子发生氧化反应,在左边电极为阳极,若铁为阳极,阳极电极方程式有Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,右边电极为阴极,电极反应式为2H2O+2e-=H2+2OH-。
10.【答案】C
【解析】【解答】A.充电时,Zn/ZnO电极为阴极,与外加电源负极相接,活性炭电极为阳极,外加电源正极相接,所以a与电源正极相连,故A不符合题意;
B.放电时,M极每消耗16gO2,氧气的物质的量为,由2Zn+O2=2ZnO可知,N极上生成的ZnO为1mol,则Zn增加的质量为1molO的质量,所以理论上N极质量增加16g,故B不符合题意;
C.充电时,N极上ZnO得电子生成Zn,阴极反应式为ZnO+H2O+2e-=Zn+2OH-,故C符合题意;
D.放电过程中,电池中总反应为2Zn+O2=2ZnO,溶液的体积不变,KOH的物质的量不变,所以KOH溶液浓度不变,故D不符合题意;
故答案为:C。
【分析】放电时为原电池,燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应;充电时为电解池,活性炭电极作阳极,Zn/ZnO电极作阴极。
11.【答案】A
【解析】【解答】A、电解精炼铜时,金属铜在阴极析出,粗铜作阳极不断的溶解,纯铜作阴极析出金属铜,故A错误;
B、化学反应产物的循环利用可以提高原料利用率,故B正确;
C、高炉炼铁的原理是一氧化碳还原氧化铁,一氧化碳可以由焦炭还原二氧化碳得到,原料有铁矿石、焦炭、空气、石灰石,故C正确;
D、因为氨气溶解度非常大,先通氨气后通二氧化碳,能增大二氧化碳的吸收,有利于生成纯碱,故D正确.
故选A.
【分析】A、电解精炼铜时,金属铜在阴极析出;
B、采用化学反应产物的循环利用可以提高原料利用率;
C、高炉炼铁的原理是一氧化碳还原氧化铁;
D、氨气溶解度非常大,CO2的溶解度相对于氨气来说很小.
12.【答案】A
【解析】【解答】A.NaCl溶液中通氨气和二氧化碳可制得碳酸氢钠和氯化铵,即NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故A正确;
B.氯碱工业中,氯离子在阳极失电子生成氯气,氢离子在阴极得电子,同时在阴极生成氢氧化钠,故B错误;
C.用水吸收三氧化硫易形成酸雾,影响三氧化硫的吸收,所以吸收塔中用浓硫酸吸收三氧化硫,故C错误;
D.用晶体硅制太阳能电池,石英可以用来制造光导纤维,用焦炭还原铁矿石制备铁,故D错误.
故选A.
【分析】A.NaCl溶液中通氨气和二氧化碳可制得碳酸氢钠和氯化铵;
B.氯碱工业中,氯离子在阳极失电子生成氯气;
C.吸收塔中用浓硫酸吸收三氧化硫;
D.用晶体硅制太阳能电池,用焦炭还原铁矿石制备铁.
13.【答案】C
【解析】【解答】解:
A.根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,阳极室c(OH-)降低,故A不符合题意;
B.电解池中阳离子向阴极移动,因此Na+想阴极室移动,故B不符合题意;
C.阴极发生还原反应,反应式为2H2O+2e-=H2↑+2OH-,故C符合题意;
D.根据反应Fe+2H2O+2OH- FeO42-+3H2↑,当消耗1 mol OH-时,反应生成1.5mol H2,但没说标准状况下,故Vm不一定为22.4L/mol,故D不符合题意。
故答案为:C
【分析】
电解时阳极(与电源正极相连)金属失电子;阴极溶液中阳离子得电子(H+先于Na+)
A.阳极铁电极失电子转换成FeO42-,过程中消耗氢氧根离子,因此电解一段时间后,阳极室c(OH-)降低
B.电解池中阳离子向阴极移动,因此Na+想阴极室移动
C.阴极阴极溶液中阳离子(水电离出的H+)得电子发生还原反应,反应式为2H2O+2e-=H2↑+2OH-
D.缺少标准状况,所以气体体积不能确定
14.【答案】C
【解析】【解答】A.由图中电子流动方向川知,放电时左边为负极右边为正极,原电池中阳离子向正极移动,所以电解质中的Li+向右端移动,故A不符合题意;
B.充电时阴极得电子发生还原反应,所以电极反应式为:Li++Al+e-=AlLi,故B不符合题意;
C.放电时,正极Cn(PF6)发生还原反应,据图可知生成PF6-,所以电极反应式为:Cn(PF6)+e-=PF6-+Cn,故C符合题意;
D.锂比铝活泼,充电时,铝电极的电极反应式为:Li++Al+e-=AlLi,所以若转移0.2 mol电子,增重为0.2×7=1.4g,而不是5.4 g,故D不符合题意;
故答案为C。
【分析】原电池中电子经导线由负极流向正极,电流方向与电子流向相反;电解质溶液中阳离子流向正极,阴离子流向负极。
15.【答案】B
【解析】【解答】A.1L0.1mol·L-1NaClO溶液中NaClO的物质的量为0.1mol·L-1×1L=0.1mol,ClO-要发生水解,水解后离子的浓度减小,数目小于0.1NA,故A不符合题意;
B.电解精炼粗铜时,阴极电极反应式为Cu2++2e-=Cu,阴极增重32g,即生成了0.5mol铜,故转移电子数为NA,故B符合题意;
C.C2H6O可能是甲醚也可能是乙醇,若是乙醇,1 mol分子式为C2H6O的有机物中含有C-O键的数目为NA,若是甲醚,1 mol分子式为C2H6O的有机物中含有C-O键的数目为2NA,二者含有碳氧键数目不同,故C不符合题意;
D.未指明标况,无法确定22.4L气体的物质的量,故D不符合题意;
故答案为:B。
【分析】C2H6O可能是甲醚也可能是乙醇,它们是同分异构体,为易错点。
16.【答案】C
【解析】【解答】A.由分析可知,电极A为与直流电源负极相连的阴极,电极B为阳极,则电解时,电极B区的氢离子通过滤布向电极A迁移,故A不符合题意;
B.由分析可知,电极A为与直流电源负极相连的阴极,酸性条件下,LiMn2O4在阴极得到电子发生还原反应生成锰离子,电极反应式为2LiMn2O4+6e—+16H+=2Li++4Mn2++8H2O,故B不符合题意;
C.由分析可知,电解的总反应方程式为2LiMn2O4+4H+2Li++Mn2++3MnO2+2H2O,反应生成了锰离子,溶液中锰离子浓度增大,故C符合题意;
D.由分析可知,电解的总反应方程式为2LiMn2O4+4H+2Li++Mn2++3MnO2+2H2O,电解结束后,可通过调节溶液pH将锰离子转化为沉淀除去,然后再加入碳酸钠溶液,从而获得碳酸锂,故D不符合题意;
故答案为:C。
【分析】A.与直流电源负极相连的阴极,电解时,阳离子向阴极移动;
B.阴极得到电子发生还原反应;
C.依据电解的总反应方程式判断;
D.依据沉淀生成原理分析。
17.【答案】(1)CO2+ClO-+H2O=HCO +HClO;-6.5
(2)2Cl--2e-=Cl2↑;ClO-扩散到阴极并被还原
(3)2NH3+3NaClO=N2+3H2O+3NaCl;随溶液pH增大,NH 逐渐转化为更易被氧化的NH3,且由图1知NaClO溶液的主要成分为氧化能力更强的HClO;NaClO溶液中ClO-含量增大,氧化性减弱
【解析】【解答】(1)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O=HClO+HCO3-;
根据图中信息可知当pH=7.5,Ka=c(H+)=10-7.5,反应ClO-+H2O HClO+OH-的K= = = = =10-6.5;lgK= lg10-6.5=-6.5;(2)①阳极上氯离子失电子产生Cl2,发生的电极反应式为2Cl--2e-=Cl2↑;
②其他条件不变,若撤去“Na+导体陶瓷膜”, ClO-扩散到阴极并被还原,导致NaClO的产率则会降低;
(3)①NaClO氧化NH3生成氮气,同时生成氯化钠和水,反应的化学方程式为2NH3+3NaClO=N2+3H2O+3NaCl;
②随溶液pH增大,NH 逐渐转化为更易被氧化的NH3,且由图1知NaClO溶液的主要成分为氧化能力更强的HClO,故pH在3~7时,随pH增大氨氮去除率升高;
③NaClO溶液中ClO-含量增大,氧化性减弱,故pH在7~9时,随pH增大氨氮去除率降低。
【分析】(1)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;根据水解平衡常数进行推算;
(2)①阳极上氯离子失电子产生Cl2;②ClO-扩散到阴极并被还原,导致NaClO的产率则会降低;(3)①NaClO氧化NH3生成氮气,同时生成氯化钠和水;②③根据图中信息结合曲线变化进行分析。
18.【答案】(1)因为CO2溶解度小,而NH3易溶于水,先通入氮气有利于后面CO2的吸收
(2)NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓
(3)NH3;CaCO3+2NaCl═Na2CO3+CaCl2
(4)BD
(5)避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备
(6)20.20mL;×100%
【解析】【解答】(1)二氧化碳为酸性氧化物,在水中溶解度小,氨气极易溶于水生成碱性的氨水,二氧化碳易溶于碱性溶液,先通氨气有利于吸收二氧化碳;
故答案为:因为CO2溶解度小,而NH3易溶于水,先通入NH3有利于后面CO2的吸收;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
故答案为:氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
(3)氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,
故答案为:NH3; CaCO3+2NaCl═Na2CO3+CaCl2;
(4)A.常温时氯化铵的溶解度比氯化钠大,故A错误;
B.通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故B正确;
C.加入食盐细粉目的是提高Cl﹣的浓度,促进氯化铵结晶析出,故C错误;
D.通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,故D正确;
故选BD;
(5)联合制碱法的主要原理是:①向浓氨水中通入足量的CO2后,氨气、水和CO2发生化合反应而生成NH4HCO3溶液;②然后加入食盐细粒充分搅拌,生成的碳酸氢钠和氯化铵;③将析出的碳酸氢钠加热得碳酸钠、二氧化碳和水,相对于氨碱法制碱,即向过滤后的滤液中加熟石灰以回收氨,使之循环使用能够避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备,
故答案为:避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备;
(6)①滴定管能读数到0.01mL,所以根据滴定管中液面的位置可知,初始读数是2.40mL,最终读数是22.60mL,所以实际消耗盐酸的体积是22.60mL﹣2.40mL=20.20mL;
故答案为:20.20mL;
②第一次消耗盐酸的体积是21.00mL﹣1.00mL=20.00mL,所以两次消耗盐酸的平均值是(20.20mL+20.00mL)÷2=20.10mL,所以消耗盐酸的物质的量是0.0201L×0.6000mol/L.根据方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氢钠的物质的量是0.0201L×0.6000mol/L,质量是0.0201L×0.6000mol/L×84g/mol,所以碳酸氢钠的纯度是:×100%;
故答案为:×100%.
19.【答案】(1)
(2)AC;>;当压强相同时,正反应放热,升温平衡逆向移动,NO转化率降低;23.5%;1.6kPa-1;>
(3)2HSO+2H++2e-=S2O+2H2O;22.4
【解析】【解答】(1)由盖斯定律
(反应1-反应2+反应3)可得目标方程, H=-
(a-b+c) kJ/mol;
(2)①A.v(CO)正 = 2v(N2)逆 即正逆反应速率相等,说明反应达到平衡状态,A正确;
B.恒容密闭即体积不变,参与反应的物质都是气体,密闭容器内混合气体质量不变,则密度一直保持不变,不能说明反应平衡,B不正确;
C.混合气体的总质量不变,反应前后气体分子数变化,即物质的量变化,平均相对分子质量不变,说明反应达到平衡状态,C正确;
D.体系中NO、CO的浓度相等不能说明反应达到平衡状态,D不正确;
E.单位时间内消耗nmol的NO同时消耗nmol的N2都指正反应方向的速率,不能说明反应达到平衡状态,E不正确;
故答案为:AC;
②该反应是放热反应,升高温度,平衡逆向移动,NO的平衡转化率减小,则T1>T2;
M点时NO的平衡转化率为60%, n=0.6mol,
,CO的体积分数为
;
③设起始n(NO)=n(CO)=amol,设NO转化物质的量为2xmol,
,压强之比等于物质的量之比,则
,解得x=0.4a,n(NO)=n(CO)=0.2amol,n(N2)=0.4amol,n(CO2)=0.8amol,n(总)=1.6amol,
;当反应达到平衡时,v正=k正 p2(NO)p(CO)=v逆=k逆 p(N)p2(CO2),则
=Kp=1.6,则k正>k逆;
(3)HSO
在电极I上转化为S2O
,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO
+2H++2e-=S2O
+2H2O;电极Ⅱ为阳极,H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,每处理2 mol NO,则转移电子数为2mol×2=4mol,根据电子转移守恒,则产生O2的物质的量为4mol×
=1mol,体积为V=nVm=1mol×22.4L/mol=22.4L。
【分析】(1)根据盖斯定律即可即可计算出焓变
(2)①根据方程式结合达到平衡的条件的判断
②根据方程式结合系数大小判断压强对平衡的影响,根据数据计算出分数
③根据数据结合方程式计算出平衡常数,根据平衡时的常数即可判断大小
(3)根据电极反应物和生成物即可写出电极式,结合电子转移即可计算出体积
20.【答案】(1)原电池;阳极
(2)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;Ag++e﹣═Ag
(3)CH4+2O2+2OH﹣═CO32﹣+3H2O
(4)4AgNO3+2H2O 4Ag+O2↑+4HNO3
(5)280mL;1
【解析】【解答】解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,
B(石墨)与原电池的正极相连,所以电极的名称是阳极,故答案为:原电池;阳极;(2)通入CH4的电极是原电池的负极发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;A(Fe)电极是电解池的阴极银离子发生还原反应,电极反应式为:Ag++e﹣═Ag,故答案为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;Ag++e﹣═Ag;(3)甲池中反应的离子方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,故答案为:CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)乙池相当于惰性电极电解硝酸银溶液,化学方程式为:4AgNO3+2H2O 4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O 4Ag+O2↑+4HNO3;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量= ×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积= =280mL,故答案为:280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,c= = =0.1mol/L,所以pH=1,故答案为:1.
【分析】(1)根据方程式及燃料电池的特点判断甲装置;根据甲装置判断乙装置;B(石墨)与原电池的正极相连;(2)通入CH4的电极是原电池的负极发生氧化反应;A(Fe)电极是电解池的阴极银离子发生还原反应;(3)甲池中反应的离子方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)乙池相当于惰性电极电解硝酸银溶液;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量= ×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积= =280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,根据c= 进行计算.
21.【答案】(1)CH4;Cl2;4
(2)Cu2++e-+Cl-=CuCl↓;<;A
【解析】【解答】(1)①甲烷燃料电池工作时,负极上反应类型为氧化反应,故通入的气体为甲烷CH4,甲烷中碳元素化合价升高,失去电子在碱性环境中生成碳酸根离子;
甲烷燃料电池中通入氧气一极为正极,氧气中氧元素化合价降低,得到电子发生还原反应; a电极与电源正极相连,为电解池的阳极,氯化钠溶液中氯离子在阳极放电,发生氧化反应,生成氯气Cl2;
②甲烷燃料电池工作时,负极上甲烷发生电极反应为:CH4+10OH--8e-=CO+7H2O;电解质中氯离子在阳极发生反应为:2Cl--2e-=Cl2↑;根据电子守恒可知,CH4~8e- ~4Cl2,相同条件下气体体积比等于物质的量比;因为两个甲烷燃料电池串联,每个电池甲烷通入量均为1L(标准状况)且反应完全,那么电路通过的电子为1L甲烷反应转移的电子的量,故理论上最多能产生氯气的体积为1L×4=4L(标准状况)。
(2)①实验乙中右边烧杯石墨电极上产生白色沉淀CuCl,说明溶液中铜离子化合价降低,得到电子发生还原反应生成Cu+,Cu+与Cl-生成CuCl沉淀,右边烧杯电极的反应式为Cu2++e-+Cl-=CuCl↓。
②实验中,甲电池电流计发生较小偏转,乙电池发生明显偏转,根据实验可知,甲电池与乙电池相比较,E甲<E乙。
③电池甲和电池乙的变量为氯离子,实验探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响;
A.电池乙中反应明显,乙中右侧烧杯中,铜离子发生还原反应生成CuCl沉淀,铜离子做氧化剂,说明氯离子增强了Cu2+的氧化性,A正确;|
B.由A分析可知,增强了Cu2+氧化性,B不正确;
C.电池甲、乙左侧烧杯中溶液成分完全一样,不能证明氯离子增强了HSO的还原性,C不正确;
D.由C分析可知,不能证明氯离子减弱了HSO的还原性,D不正确;
故答案为:A。
【分析】解答新型化学电源的步骤:(1)判断电池类型→确认电池原理→核实电子、离子移动方向。(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。(3)充电电池→放电时为原电池→失去电子的一极为负极。(4)电极反应→根据电荷守恒、原子守恒配平电极方程式。
一、单选题
1.某学生设计了一种家用消毒液发生器,装置如图所示。下列说法错误的是( )
A.该消毒液发生器的原理与氯碱工业一致
B.通电时阳极反应式为:
C.通电时电子从阳极经食盐溶液流向阴极
D.该装置的优点是随制随用,防止消毒液久置失效
2.工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF=KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是( )
A.钢电极与电源的负极相连 B.电解过程中需不断补充的X是KF
C.阴极室与阳极室必须隔开 D.氟氢化钾在氟化氢中可以电离
3.关于下列各装置图的叙述中,不正确的是( )
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用装置①进行电镀,镀件接在b极上
C.装置②的总反应:Cu+2Fe3+=Cu2++2Fe2+
D.装置③中的铁钉几乎没有被腐蚀
4.科学家利用新型Zn-CO2水介质电池,电极材料为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。其电池示意图如下图所示,下列说法正确的是( )
A.放电时,正极区pH降低
B.放电时,Zn极发生电极反应式为: Zn+4OH--2e-=Zn(OH)
C.充电时,每生成标况下11.2LO2在阳极可生成65g Zn
D.电解质溶液2一定是碱性溶液
5.最近,科学家报道了一种新型可充电钠电池,其工作原理如图所示,下列说法不正确的是( )
A.放电时,X极为负极
B.充电时, 向X极迁移
C.放电时,Y极反应为
D.电极材料中,单位质量金属放出的电能:
6.爱迪生发明的镍铁碱性电池的寿命是铅蓄电池的数倍,为了纪念爱迪生的付出,这种电池也叫“爱迪生蓄电池”,其反应原理为:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2,用爱迪生蓄电池制取少量Na2FeO4的装置如图所示。下列说法正确的是( )
A.装置图中爱迪生蓄电池的负极是b
B.该电池工作一段时间充电时,生成NiO2的反应是还原反应
C.电解质溶液中OH-透过阴离子交换膜从右池移到左池
D.Fe电极上的反应为:Fe-6e-+8OH-=FeO+4H2O
7.用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
8.如图所示电解装置中,通电后Ⅱ室溶液底部逐渐溶解,下列判断正确的是( )
A.a是电源的正极
B.通电一段时间后,向石墨电极Ⅱ附近滴加酚酞溶液,出现红色
C.随着电解的进行,Ⅰ室溶液的pH变大
D.当0.01mol 全溶解时,至少产生气体672mL(标准状况下测得)
9.电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法错误的是( )
A.阴极电极反应式为
B.每产生,整个电解池中理论上转移电子数大于
C.若铁为阳极,则阳极电极反应式为
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:
10.锌-空气燃料电池是一种低能耗电池,在生产生活中应用广泛,其装置示意图如图所示。下列说法错误的是( )
A.充电时,a与电源正极相连
B.放电时,M极每消耗16gO2,理论上N极质量增加16g
C.充电时,N极的电极反应式为ZnO+2H++2e-=Zn+H2O
D.放电过程中,KOH溶液浓度不变
11.下列关于工业生产说法不正确的是( )
A.电解精炼铜时,用粗铜做阴极,纯铜做阳极
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在炼铁工业,需要的原料有铁矿石、焦炭、空气、石灰石等
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
12.下列有关化工生产的叙述中,正确的是( )
A.工业上可用氯化钠制备化肥NH4Cl
B.氯碱工业中,电解槽的阳极区产生NaOH
C.在接触室被氧化成SO3,SO3在吸收塔内被水吸收制成浓硫酸
D.工业上用石英制太阳能电池,在高温下用铝热法炼铁制备钢材
13.具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH- FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是( )
A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
14.中科院深圳研究院成功开发出一种新型铝-石墨双离子电池,可大幅度提升电动汽车的使用性能,其工作原理如图所示。充电过程中,石墨电极发生阴离子插层反应,而铝电极发生铝-锂合金化反应,下列叙述正确的是( )
A.放电时,电解质中的Li+向左端电极移动
B.充电时,与外加电源负极相连一端电极反应为:AlLi-e-=Li++Al
C.放电时,正极反应式为Cn(PF6)+e-=PF6-+Cn
D.充电时,若转移0.2mol电子,则铝电极上增重5.4g
15.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1 mol·L-1NaClO溶液中含有的ClO-数目为NA
B.在电解精炼粗铜的过程中,当阴极质量增重32g时转移的电子数为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中含有C-O键的数目为NA
D.氢氧燃料电池正极消耗22.4 L气体时,负极消耗气体的分子数为2NA
16.通过电解废旧锂电池中的可获得难溶性的和,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过,电解过程中溶液的体积变化忽略不计)。下列说法错误的是( )
A.电极B区的通过滤布向电极A迁移
B.电极A的电极发应:
C.电解一段时间后溶液中浓度保持不变
D.电解结束,可通过调节pH除去,再加入溶液以获得
二、综合题
17.NaClO广泛用作消杀剂、水处理剂及漂白剂等。
已知:NaClO溶液中物种分布分数与溶液pH的关系如图1所示。
(1)向NaClO溶液中通入CO2,发生反应的离子方程式为 (H2CO3的lgKa1、lgKa2依次为-6.38、-10.21);反应ClO-+H2O HClO+OH-的lgK= 。
(2)用Na+导体陶瓷膜电解法生产次氯酸钠溶液的装置如图2所示。
①阳极产生Cl2的电极反应式为 。
②其他条件不变,若撤去“Na+导体陶瓷膜”,NaClO的产率则会降低,其主要原因是 。
(3)NaClO溶液中ClO-与H2O产生更强氧化性的HClO,可将水体中氨氮氧化为N2(NH3比NH 更易被氧化)。室温时,取氨氮废水200mL,在转速、NaClO投加量相同且均反应30min时,反应初始pH对剩余氨氮浓度及氨氮去除率的影响如图3所示。
①NaClO氧化NH3的化学方程式为 。
②pH在3~7时,随pH增大氨氮去除率升高的原因是 。
③pH在7~9时,随pH增大氨氮去除率降低的原因是 。
18.1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家都创立了要为先进的侯德邦制碱法,也叫联合制碱法,两种制碱的生产流程可需要表示如图1:
图1 图2
(1)向沉淀池中通入CO2和氮气时,应先通入氮气的原因是 ;
(2)沉淀池中发生反应的化学反应方程式是 ;
(3)氨碱法生产流程示意图的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ;
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确的是 (选填编号)
A.常温时氯化铵的溶解度比氯化钠小
B.通入氨气能增大NH4+的浓度,使氯化铵更多析出
C.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
D.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合剂碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环I.联合制碱法的另一项优点是 .
(6)从沉淀地析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液确定(用甲基酸提示剂),测定值记录如下:
滴定次数 待测液(mL) 0.6000mol/L盐酸溶液的体积(mL)
初读数 终读数
第一次 20.00 1.00 21.00
第二次 20.00 如图2Ⅰ 如图2Ⅱ
①第二次滴定,从图Ⅰ图Ⅱ显示消耗的盐酸溶液体积为 ;
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)= .
19.以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)已知:2C(s)+O2(g)=2CO(g) H1= a kJ/mol
N2(g)+O2(g)=2NO(g) H2= b kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g) H3= c kJ/mol
则2NO(g)+C(s) = CO2(g)+N2(g) H= kJ/mol
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。
已知2NO(g)+2CO(g) N2(g)+2CO2(g) H<0。
①在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是 。
A.v(CO)正 = 2v(N2)逆 B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变 D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
②向1L密闭容器中通入1mol的NO和1mol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:
T1 T2(填“>”、“<”),理由是 。M点时混合气体中CO的体积分数为 。
③一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min 0 1 2 3 4 5
p/kPa 200 185 173 165 160 160
该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),该反应中的v正=k正·p2(NO)p2(CO),v逆=k逆·p(N2)p2(CO2),则该反应达到平衡时,k正 k逆(填“>”、“<”或“=”)。
(3)间接电化学法可对NO进行无害化处理,其原理如图所示(质子膜允许H+和H2O通过)。电极Ⅰ接电源负极,其电极反应式为: 。标准状况下,每处理2 mol NO,得到 LO2
20.如图是一个化学过程的示意图.请回答下列问题:
(1)甲池是 装置(填“原电池”或“电解池”),B(石墨)电极的名称 是 .
(2)写出电极反应式:
通入CH4的电极 ;A(Fe)电极 .
(3)甲池中反应的离子方程式为 .
(4)乙池中反应的化学方程式为 .
(5)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中 A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为 (标准状况下);
②乙池中所得溶液的pH= .
21.电化学原理有着重要的应用。
(1)探究电化学反应的规律
某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和NaCl溶液的实验装置如图所示。
①甲烷燃料电池工作时,负极上通入的气体为 (填化学式);闭合开关K后a、b电极上均有气体产生,其中a电极上得到的气体为 (填化学式)。
②若每个电池甲烷通入量均为1L(标准状况),且反应完全,则理论上最多能产生氯气的体积为 L(标准状况)。
(2)探究氧化还原反应的规律
为探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响,设计如图实验。
编号 甲 乙
实验
现象 电流计发生较小偏转,3min时无明显现象 电流计发生明显偏转,30s时,左边烧杯石墨电极上产生气体;右边烧杯石墨电极上产生白色沉淀(经检验为CuCl)
①实验乙中右边烧杯电极的反应式为 。
②已知E为电池电动势【又称理论电压,为两个电极电位之差,即E=E(+)-E(-)】,根据实验可知,甲电池与乙电池相比较,E甲 E乙(填“>”、“<”或“=”)。
③从氧化还原反应的角度分析,Cl-对反应的影响为 (填选项字母)。
A.增强了Cu2+的氧化性 B.减弱了Cu2+氧化性
C.增强了HSO的还原性 D.减弱了HSO的还原性
答案解析部分
1.【答案】C
【解析】【解答】A.该装置原理为电解食盐溶液,与氯碱工业一致,A项不符合题意;
B.通电时阳极反应式为2Cl--2e-=Cl2↑,B项不符合题意;
C.溶液中只有阴阳离子没有电子,且电子不能经过电解质溶液,C项符合题意;
D.该装置的优点是随制随用,以防久置的次氯酸钠分解失效,D项不符合题意;
故答案为:C。
【分析】A.该原理为电解食盐水;
B.电解食盐水时,阳极上氯离子失去电子发生氧化反应生成氯气;
C.电子不经过电解质溶液;
D.该装置可以随制随用。
2.【答案】B
【解析】【解答】A、根据装置图,KHF2中H元素显+1价,钢电极上析出H2,表明钢电极上发生得电子的还原反应,即钢电极是电解池的阴极,钢电极与电源的负极相连,故A说法不符合题意;
B、根据装置图,逸出的气体为H2和F2,说明电解质无水溶液中减少的是氢和氟元素,因此电解过程需要不断补充的X是HF,故B说法符合题意;
C、阳极室生成氟气,阴极室产生H2,二者接触发生剧烈反应甚至爆炸,因此必须隔开防止氟气与氢气接触,故C说法不符合题意;
D、由氟氢化钾的氟化氢无水溶液可以导电,可推知氟氢化钾在氟化氢中发生电离,故D说法不符合题意。
【分析】在电解池中,阳极与电源正极相连,失去电子,化合价升高,做还原剂,阴极与电源负极相连,得到电子,化合价降低,做氧化剂。
3.【答案】C
【解析】【解答】A.①中根据电流流向可知,a为阳极,b为阴极,电解精炼铜时,阳极为粗铜,故A不符合题意
B.电镀时,镀件为阴极,故B不符合题意
C.铁和铜,铁作负极,故总反应为铁和铁离子反应,生成亚铁离子,故C符合题意
D.铁和铜,在浓硫酸中,铁在冷的浓硫酸中发生钝化,故D不符合题意
故答案为:C
【分析】C中铁比铜活泼,故发生反应的是铁,保护了铜
4.【答案】B
【解析】【解答】A.放电时,二氧化碳转化为甲酸,碳原子价态降低,故其为正极反应,反应式为: ,所以放电时正极消耗氢离子,pH升高,故A不符合题意;
B.放电时,介质为水,故负极反应为: ,故B符合题意;
C.根据上述反应式可以发现,充电时阳极失电子发生氧化反应,而Zn应在阴极生成,故C不符合题意;
D.电解质溶液2若为碱性,则甲酸应以HCOO-形式存在,故D不符合题意。
故答案为:B。
【分析】放电时,锌做负极发生的是锌失去电子结合氢氧根变为Zn(OH)42-,即发生 ,正极是二氧化碳得到电子变为变为甲酸,即,导致正极负极的pH增大,因此电解质2的溶液显酸性,充电时,阳极生的反应是2H2O-4e=4H++O2,阴极发生的是Zn(OH)42-+2e=Zn+4OH-,即可计算出锌的质量
5.【答案】D
【解析】【解答】A.放电时,该电池为原电池,X极上钠失电子形成钠离子,发生氧化反应,为原电池的负极,故A不符合题意;
B.充电时,X极是阴极, 向X极迁移,故B不符合题意;
C.放电时,该装置为原电池,Y极为原电池的正极,由图可知CaFeO3转化为CaFeO2.5,电极反应为: ,故C不符合题意;
D.锂的摩尔质量比钠小,故锂单位质量输出的电能多,单位质量金属放出的电能: Li>Na,故D符合题意;
故答案为:D。
【分析】 Na和Li都容易失去一个电子,但在做电极材料时,由于锂的摩尔质量较小,因此单位质量金属锂放出的电能更大。
6.【答案】D
【解析】【解答】 Fe+NiO2+2H2OFe(OH)2+Ni(OH)2, Fe化合价升高,Fe在负极失去电子,Ni化合价降低,在正极得到电子,制取Na2FeO4时,Fe失去电子生成FeO42-,则Fe作为阳极,C作为阴极;
A、b连接Fe,则b为正极,A错误;
B、充电时Ni化合价升高,发生氧化反应,B错误;
C、OH-为阴离子,移向阳极,即移向Fe,C错误;
D、Fe失去电子,结合氢氧根生成高铁酸根和水,即 Fe-6e-+8OH-=FeO+4H2O ,D正确;
故答案为:D
【分析】新型二次电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒;若是充电过程,则负极作为阴极,正极作为阳极,阴极电极反应式为负极的逆反应,阳极的电极反应式为正极的逆反应;
电解池要注意:
连接外接电源正极的为阳极,若阳极为活性电极则阳极失去电子,若阳极为惰性电极,则溶液中的阴离子在阳极失去电子,阳极发生氧化反应;连接外接电源负极的为阴极,溶液中的阳离子在阴极得到电子,阴极发生还原反应。
7.【答案】C
【解析】【解答】A. 放电时,电池正极通入空气中的O2,在碱性溶液中得电子生成OH-,A不符合题意;
B. 放电时,正极通入空气中的CO2,会与KOH反应生成少量K2CO3,B不符合题意;
C. 电池停止工作时,锌粉仍会与KOH溶液发生缓慢反应,C符合题意;
D. 充电时,电解槽阴极(放电时,Zn转化为ZnO)Zn表面的ZnO得电子,生成Zn和OH-,电极反应式为ZnO+2e-+H2O=Zn+2OH-,D不符合题意;
故答案为:C。
【分析】锌和铝的性质类似,能与KOH发生反应
8.【答案】C
【解析】【解答】A.由分析可知,a是电源的负极,故A不符合题意;
B.石墨电极Ⅱ为阳极,电极反应式为2H2O-4e=O2↑+4H+,4H+向室Ⅱ移动需要一定时间,所以石墨电极Ⅱ附近显酸性,滴加酚酞溶液,不变色,故B不符合题意;
C.CuCl2溶液因水解显酸性,随着电解的进行,Ⅰ室铜离子在阴极得电子生成铜单质,所以CuCl2溶液浓度变小,酸性减弱,pH增大,故C符合题意;
D.Fe2O3溶解的反应为Fe2O3+6H+=2Fe3++3H2O,当0.01mol Fe2O3完全溶解时,消耗氢离子为0.06mol,根据阳极电极反应式2H2O - 4e =O2↑+ 4H+,产生氧气为0.015mol,体积为336mL (折合成标准状况下),故D不符合题意;
故答案为:C。
【分析】电解池的题目要注意几个问题:
1、连接外接电源正极的为阳极,若阳极为活性电极则阳极失去电子,若阳极为惰性电极,则溶液中的阴离子在阳极失去电子,阳极发生氧化反应;连接外接电源负极的为阴极,溶液中的阳离子在阴极得到电子,阴极发生还原反应;
2、溶液中的离子放电顺序:
阳离子:Ag+ > Hg2+ > Fe3+ > Cu2+ > H+(酸) > Pb2+ > Sn2+ > Fe2+ >Zn2+ > H+(水);
阴离子:S2– >I-> Br- > Cl- > OH-> (NO3-、SO42– 等)含氧酸根 > F-;
3、电极反应式的书写要结合原子守恒以及溶液形成判断,酸性条件不出现氢氧根,碱性条件下不出现氢离子。
9.【答案】C
【解析】【解答】A.阴极氢离子得电子发生还原反应,电极反应式为2H2O+2e-=H2+2OH-,故A不符合题意;
B.由装置图可知,若铁为阳极,阳极电极方程式有Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,所以每产生0.5mol O2整个电解池中理论上转移电子数为大于2NA,故B不符合题意;
C.由装置图可知,若铁为阳极,则阳极电极方程式为Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,故C符合题意;
D.若铁为阳极,阳极电极方程式为Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,在处理废水的过程中二价铁还被放出的氧气氧化成三价铁.离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故D不符合题意;
故答案为:C。
【分析】由图可知,左边电极水失去电子发生氧化反应,在左边电极为阳极,若铁为阳极,阳极电极方程式有Fe-2e- =Fe2+和2H2O-4e-=O2+4H+,右边电极为阴极,电极反应式为2H2O+2e-=H2+2OH-。
10.【答案】C
【解析】【解答】A.充电时,Zn/ZnO电极为阴极,与外加电源负极相接,活性炭电极为阳极,外加电源正极相接,所以a与电源正极相连,故A不符合题意;
B.放电时,M极每消耗16gO2,氧气的物质的量为,由2Zn+O2=2ZnO可知,N极上生成的ZnO为1mol,则Zn增加的质量为1molO的质量,所以理论上N极质量增加16g,故B不符合题意;
C.充电时,N极上ZnO得电子生成Zn,阴极反应式为ZnO+H2O+2e-=Zn+2OH-,故C符合题意;
D.放电过程中,电池中总反应为2Zn+O2=2ZnO,溶液的体积不变,KOH的物质的量不变,所以KOH溶液浓度不变,故D不符合题意;
故答案为:C。
【分析】放电时为原电池,燃料电池中,通入燃料的一极为负极,负极发生氧化反应,通入氧气的一极为正极,正极发生还原反应;充电时为电解池,活性炭电极作阳极,Zn/ZnO电极作阴极。
11.【答案】A
【解析】【解答】A、电解精炼铜时,金属铜在阴极析出,粗铜作阳极不断的溶解,纯铜作阴极析出金属铜,故A错误;
B、化学反应产物的循环利用可以提高原料利用率,故B正确;
C、高炉炼铁的原理是一氧化碳还原氧化铁,一氧化碳可以由焦炭还原二氧化碳得到,原料有铁矿石、焦炭、空气、石灰石,故C正确;
D、因为氨气溶解度非常大,先通氨气后通二氧化碳,能增大二氧化碳的吸收,有利于生成纯碱,故D正确.
故选A.
【分析】A、电解精炼铜时,金属铜在阴极析出;
B、采用化学反应产物的循环利用可以提高原料利用率;
C、高炉炼铁的原理是一氧化碳还原氧化铁;
D、氨气溶解度非常大,CO2的溶解度相对于氨气来说很小.
12.【答案】A
【解析】【解答】A.NaCl溶液中通氨气和二氧化碳可制得碳酸氢钠和氯化铵,即NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,故A正确;
B.氯碱工业中,氯离子在阳极失电子生成氯气,氢离子在阴极得电子,同时在阴极生成氢氧化钠,故B错误;
C.用水吸收三氧化硫易形成酸雾,影响三氧化硫的吸收,所以吸收塔中用浓硫酸吸收三氧化硫,故C错误;
D.用晶体硅制太阳能电池,石英可以用来制造光导纤维,用焦炭还原铁矿石制备铁,故D错误.
故选A.
【分析】A.NaCl溶液中通氨气和二氧化碳可制得碳酸氢钠和氯化铵;
B.氯碱工业中,氯离子在阳极失电子生成氯气;
C.吸收塔中用浓硫酸吸收三氧化硫;
D.用晶体硅制太阳能电池,用焦炭还原铁矿石制备铁.
13.【答案】C
【解析】【解答】解:
A.根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,阳极室c(OH-)降低,故A不符合题意;
B.电解池中阳离子向阴极移动,因此Na+想阴极室移动,故B不符合题意;
C.阴极发生还原反应,反应式为2H2O+2e-=H2↑+2OH-,故C符合题意;
D.根据反应Fe+2H2O+2OH- FeO42-+3H2↑,当消耗1 mol OH-时,反应生成1.5mol H2,但没说标准状况下,故Vm不一定为22.4L/mol,故D不符合题意。
故答案为:C
【分析】
电解时阳极(与电源正极相连)金属失电子;阴极溶液中阳离子得电子(H+先于Na+)
A.阳极铁电极失电子转换成FeO42-,过程中消耗氢氧根离子,因此电解一段时间后,阳极室c(OH-)降低
B.电解池中阳离子向阴极移动,因此Na+想阴极室移动
C.阴极阴极溶液中阳离子(水电离出的H+)得电子发生还原反应,反应式为2H2O+2e-=H2↑+2OH-
D.缺少标准状况,所以气体体积不能确定
14.【答案】C
【解析】【解答】A.由图中电子流动方向川知,放电时左边为负极右边为正极,原电池中阳离子向正极移动,所以电解质中的Li+向右端移动,故A不符合题意;
B.充电时阴极得电子发生还原反应,所以电极反应式为:Li++Al+e-=AlLi,故B不符合题意;
C.放电时,正极Cn(PF6)发生还原反应,据图可知生成PF6-,所以电极反应式为:Cn(PF6)+e-=PF6-+Cn,故C符合题意;
D.锂比铝活泼,充电时,铝电极的电极反应式为:Li++Al+e-=AlLi,所以若转移0.2 mol电子,增重为0.2×7=1.4g,而不是5.4 g,故D不符合题意;
故答案为C。
【分析】原电池中电子经导线由负极流向正极,电流方向与电子流向相反;电解质溶液中阳离子流向正极,阴离子流向负极。
15.【答案】B
【解析】【解答】A.1L0.1mol·L-1NaClO溶液中NaClO的物质的量为0.1mol·L-1×1L=0.1mol,ClO-要发生水解,水解后离子的浓度减小,数目小于0.1NA,故A不符合题意;
B.电解精炼粗铜时,阴极电极反应式为Cu2++2e-=Cu,阴极增重32g,即生成了0.5mol铜,故转移电子数为NA,故B符合题意;
C.C2H6O可能是甲醚也可能是乙醇,若是乙醇,1 mol分子式为C2H6O的有机物中含有C-O键的数目为NA,若是甲醚,1 mol分子式为C2H6O的有机物中含有C-O键的数目为2NA,二者含有碳氧键数目不同,故C不符合题意;
D.未指明标况,无法确定22.4L气体的物质的量,故D不符合题意;
故答案为:B。
【分析】C2H6O可能是甲醚也可能是乙醇,它们是同分异构体,为易错点。
16.【答案】C
【解析】【解答】A.由分析可知,电极A为与直流电源负极相连的阴极,电极B为阳极,则电解时,电极B区的氢离子通过滤布向电极A迁移,故A不符合题意;
B.由分析可知,电极A为与直流电源负极相连的阴极,酸性条件下,LiMn2O4在阴极得到电子发生还原反应生成锰离子,电极反应式为2LiMn2O4+6e—+16H+=2Li++4Mn2++8H2O,故B不符合题意;
C.由分析可知,电解的总反应方程式为2LiMn2O4+4H+2Li++Mn2++3MnO2+2H2O,反应生成了锰离子,溶液中锰离子浓度增大,故C符合题意;
D.由分析可知,电解的总反应方程式为2LiMn2O4+4H+2Li++Mn2++3MnO2+2H2O,电解结束后,可通过调节溶液pH将锰离子转化为沉淀除去,然后再加入碳酸钠溶液,从而获得碳酸锂,故D不符合题意;
故答案为:C。
【分析】A.与直流电源负极相连的阴极,电解时,阳离子向阴极移动;
B.阴极得到电子发生还原反应;
C.依据电解的总反应方程式判断;
D.依据沉淀生成原理分析。
17.【答案】(1)CO2+ClO-+H2O=HCO +HClO;-6.5
(2)2Cl--2e-=Cl2↑;ClO-扩散到阴极并被还原
(3)2NH3+3NaClO=N2+3H2O+3NaCl;随溶液pH增大,NH 逐渐转化为更易被氧化的NH3,且由图1知NaClO溶液的主要成分为氧化能力更强的HClO;NaClO溶液中ClO-含量增大,氧化性减弱
【解析】【解答】(1)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O=HClO+HCO3-;
根据图中信息可知当pH=7.5,Ka=c(H+)=10-7.5,反应ClO-+H2O HClO+OH-的K= = = = =10-6.5;lgK= lg10-6.5=-6.5;(2)①阳极上氯离子失电子产生Cl2,发生的电极反应式为2Cl--2e-=Cl2↑;
②其他条件不变,若撤去“Na+导体陶瓷膜”, ClO-扩散到阴极并被还原,导致NaClO的产率则会降低;
(3)①NaClO氧化NH3生成氮气,同时生成氯化钠和水,反应的化学方程式为2NH3+3NaClO=N2+3H2O+3NaCl;
②随溶液pH增大,NH 逐渐转化为更易被氧化的NH3,且由图1知NaClO溶液的主要成分为氧化能力更强的HClO,故pH在3~7时,随pH增大氨氮去除率升高;
③NaClO溶液中ClO-含量增大,氧化性减弱,故pH在7~9时,随pH增大氨氮去除率降低。
【分析】(1)酸性强弱HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;根据水解平衡常数进行推算;
(2)①阳极上氯离子失电子产生Cl2;②ClO-扩散到阴极并被还原,导致NaClO的产率则会降低;(3)①NaClO氧化NH3生成氮气,同时生成氯化钠和水;②③根据图中信息结合曲线变化进行分析。
18.【答案】(1)因为CO2溶解度小,而NH3易溶于水,先通入氮气有利于后面CO2的吸收
(2)NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓
(3)NH3;CaCO3+2NaCl═Na2CO3+CaCl2
(4)BD
(5)避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备
(6)20.20mL;×100%
【解析】【解答】(1)二氧化碳为酸性氧化物,在水中溶解度小,氨气极易溶于水生成碱性的氨水,二氧化碳易溶于碱性溶液,先通氨气有利于吸收二氧化碳;
故答案为:因为CO2溶解度小,而NH3易溶于水,先通入NH3有利于后面CO2的吸收;
(2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
故答案为:氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
(3)氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙,氢氧化钙与铵盐反应生成的氨气可以循环使用,NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;CaCO3═CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;2NaHCO3═Na2CO3+H2O+CO2↑合并得到总化学方程式为:CaCO3+2NaCl═Na2CO3+CaCl2,
故答案为:NH3; CaCO3+2NaCl═Na2CO3+CaCl2;
(4)A.常温时氯化铵的溶解度比氯化钠大,故A错误;
B.通氨气作用有增大NH4+的浓度,使NH4Cl更多地析出和使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故B正确;
C.加入食盐细粉目的是提高Cl﹣的浓度,促进氯化铵结晶析出,故C错误;
D.通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,故D正确;
故选BD;
(5)联合制碱法的主要原理是:①向浓氨水中通入足量的CO2后,氨气、水和CO2发生化合反应而生成NH4HCO3溶液;②然后加入食盐细粒充分搅拌,生成的碳酸氢钠和氯化铵;③将析出的碳酸氢钠加热得碳酸钠、二氧化碳和水,相对于氨碱法制碱,即向过滤后的滤液中加熟石灰以回收氨,使之循环使用能够避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备,
故答案为:避免产生大量的含有CaCl2的溶液,或节省石灰窑、蒸氨塔等设备;
(6)①滴定管能读数到0.01mL,所以根据滴定管中液面的位置可知,初始读数是2.40mL,最终读数是22.60mL,所以实际消耗盐酸的体积是22.60mL﹣2.40mL=20.20mL;
故答案为:20.20mL;
②第一次消耗盐酸的体积是21.00mL﹣1.00mL=20.00mL,所以两次消耗盐酸的平均值是(20.20mL+20.00mL)÷2=20.10mL,所以消耗盐酸的物质的量是0.0201L×0.6000mol/L.根据方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氢钠的物质的量是0.0201L×0.6000mol/L,质量是0.0201L×0.6000mol/L×84g/mol,所以碳酸氢钠的纯度是:×100%;
故答案为:×100%.
19.【答案】(1)
(2)AC;>;当压强相同时,正反应放热,升温平衡逆向移动,NO转化率降低;23.5%;1.6kPa-1;>
(3)2HSO+2H++2e-=S2O+2H2O;22.4
【解析】【解答】(1)由盖斯定律
(反应1-反应2+反应3)可得目标方程, H=-
(a-b+c) kJ/mol;
(2)①A.v(CO)正 = 2v(N2)逆 即正逆反应速率相等,说明反应达到平衡状态,A正确;
B.恒容密闭即体积不变,参与反应的物质都是气体,密闭容器内混合气体质量不变,则密度一直保持不变,不能说明反应平衡,B不正确;
C.混合气体的总质量不变,反应前后气体分子数变化,即物质的量变化,平均相对分子质量不变,说明反应达到平衡状态,C正确;
D.体系中NO、CO的浓度相等不能说明反应达到平衡状态,D不正确;
E.单位时间内消耗nmol的NO同时消耗nmol的N2都指正反应方向的速率,不能说明反应达到平衡状态,E不正确;
故答案为:AC;
②该反应是放热反应,升高温度,平衡逆向移动,NO的平衡转化率减小,则T1>T2;
M点时NO的平衡转化率为60%, n=0.6mol,
,CO的体积分数为
;
③设起始n(NO)=n(CO)=amol,设NO转化物质的量为2xmol,
,压强之比等于物质的量之比,则
,解得x=0.4a,n(NO)=n(CO)=0.2amol,n(N2)=0.4amol,n(CO2)=0.8amol,n(总)=1.6amol,
;当反应达到平衡时,v正=k正 p2(NO)p(CO)=v逆=k逆 p(N)p2(CO2),则
=Kp=1.6,则k正>k逆;
(3)HSO
在电极I上转化为S2O
,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为:2HSO
+2H++2e-=S2O
+2H2O;电极Ⅱ为阳极,H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,每处理2 mol NO,则转移电子数为2mol×2=4mol,根据电子转移守恒,则产生O2的物质的量为4mol×
=1mol,体积为V=nVm=1mol×22.4L/mol=22.4L。
【分析】(1)根据盖斯定律即可即可计算出焓变
(2)①根据方程式结合达到平衡的条件的判断
②根据方程式结合系数大小判断压强对平衡的影响,根据数据计算出分数
③根据数据结合方程式计算出平衡常数,根据平衡时的常数即可判断大小
(3)根据电极反应物和生成物即可写出电极式,结合电子转移即可计算出体积
20.【答案】(1)原电池;阳极
(2)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;Ag++e﹣═Ag
(3)CH4+2O2+2OH﹣═CO32﹣+3H2O
(4)4AgNO3+2H2O 4Ag+O2↑+4HNO3
(5)280mL;1
【解析】【解答】解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,
B(石墨)与原电池的正极相连,所以电极的名称是阳极,故答案为:原电池;阳极;(2)通入CH4的电极是原电池的负极发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;A(Fe)电极是电解池的阴极银离子发生还原反应,电极反应式为:Ag++e﹣═Ag,故答案为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;Ag++e﹣═Ag;(3)甲池中反应的离子方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,故答案为:CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)乙池相当于惰性电极电解硝酸银溶液,化学方程式为:4AgNO3+2H2O 4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O 4Ag+O2↑+4HNO3;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量= ×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积= =280mL,故答案为:280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,c= = =0.1mol/L,所以pH=1,故答案为:1.
【分析】(1)根据方程式及燃料电池的特点判断甲装置;根据甲装置判断乙装置;B(石墨)与原电池的正极相连;(2)通入CH4的电极是原电池的负极发生氧化反应;A(Fe)电极是电解池的阴极银离子发生还原反应;(3)甲池中反应的离子方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)乙池相当于惰性电极电解硝酸银溶液;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量= ×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积= =280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,根据c= 进行计算.
21.【答案】(1)CH4;Cl2;4
(2)Cu2++e-+Cl-=CuCl↓;<;A
【解析】【解答】(1)①甲烷燃料电池工作时,负极上反应类型为氧化反应,故通入的气体为甲烷CH4,甲烷中碳元素化合价升高,失去电子在碱性环境中生成碳酸根离子;
甲烷燃料电池中通入氧气一极为正极,氧气中氧元素化合价降低,得到电子发生还原反应; a电极与电源正极相连,为电解池的阳极,氯化钠溶液中氯离子在阳极放电,发生氧化反应,生成氯气Cl2;
②甲烷燃料电池工作时,负极上甲烷发生电极反应为:CH4+10OH--8e-=CO+7H2O;电解质中氯离子在阳极发生反应为:2Cl--2e-=Cl2↑;根据电子守恒可知,CH4~8e- ~4Cl2,相同条件下气体体积比等于物质的量比;因为两个甲烷燃料电池串联,每个电池甲烷通入量均为1L(标准状况)且反应完全,那么电路通过的电子为1L甲烷反应转移的电子的量,故理论上最多能产生氯气的体积为1L×4=4L(标准状况)。
(2)①实验乙中右边烧杯石墨电极上产生白色沉淀CuCl,说明溶液中铜离子化合价降低,得到电子发生还原反应生成Cu+,Cu+与Cl-生成CuCl沉淀,右边烧杯电极的反应式为Cu2++e-+Cl-=CuCl↓。
②实验中,甲电池电流计发生较小偏转,乙电池发生明显偏转,根据实验可知,甲电池与乙电池相比较,E甲<E乙。
③电池甲和电池乙的变量为氯离子,实验探究NaHSO3溶液与CuSO4溶液反应时,Cl-对反应的影响;
A.电池乙中反应明显,乙中右侧烧杯中,铜离子发生还原反应生成CuCl沉淀,铜离子做氧化剂,说明氯离子增强了Cu2+的氧化性,A正确;|
B.由A分析可知,增强了Cu2+氧化性,B不正确;
C.电池甲、乙左侧烧杯中溶液成分完全一样,不能证明氯离子增强了HSO的还原性,C不正确;
D.由C分析可知,不能证明氯离子减弱了HSO的还原性,D不正确;
故答案为:A。
【分析】解答新型化学电源的步骤:(1)判断电池类型→确认电池原理→核实电子、离子移动方向。(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。(3)充电电池→放电时为原电池→失去电子的一极为负极。(4)电极反应→根据电荷守恒、原子守恒配平电极方程式。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
