1.4 金属的腐蚀与防护 同步练习题(含解析)2023-2024学年高二上学期鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.4 金属的腐蚀与防护 同步练习题(含解析)2023-2024学年高二上学期鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 266.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-02 00:00:00 | ||
图片预览


文档简介
1.4 金属的腐蚀与防护 同步练习题
一、单选题
1.在铁的吸氧腐蚀过程中,下列5种变化中可能发生的是()
①Fe由+2价转化为+3价 ②O2被还原 ③产生H2
④Fe(OH)3失水形成Fe2O3·nH2O ⑤杂质C被氧化除去
A.①②④ B.③④
C.①②③④ D.①②③⑤
2.金属腐蚀现象普遍存在。下列事实与电化学腐蚀有关的是( )
A.金属钠置于空气中变暗
B.铝片浸入浓硝酸中产生致密的氧化膜
C.黄铜(铜锌合金)制作的铜锣不易生成铜绿
D.铁在 和 的混合溶液中发蓝、发黑
3.下列现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,接触处容易生铁锈
D.银质奖牌放置久了表面变暗
4.为了防止钢铁腐蚀,下列防护方法正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的铁闸门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在电动输油管的铸铁管上接直流电源的正极
5.中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B.我国古代人民常用明矾水除去铜器上的铜锈
C.锡青铜 铜锡合金 文物在潮湿环境中的腐蚀比干燥环境中快
D.晋代炼丹家、医学家葛洪所著 抱扑子 一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
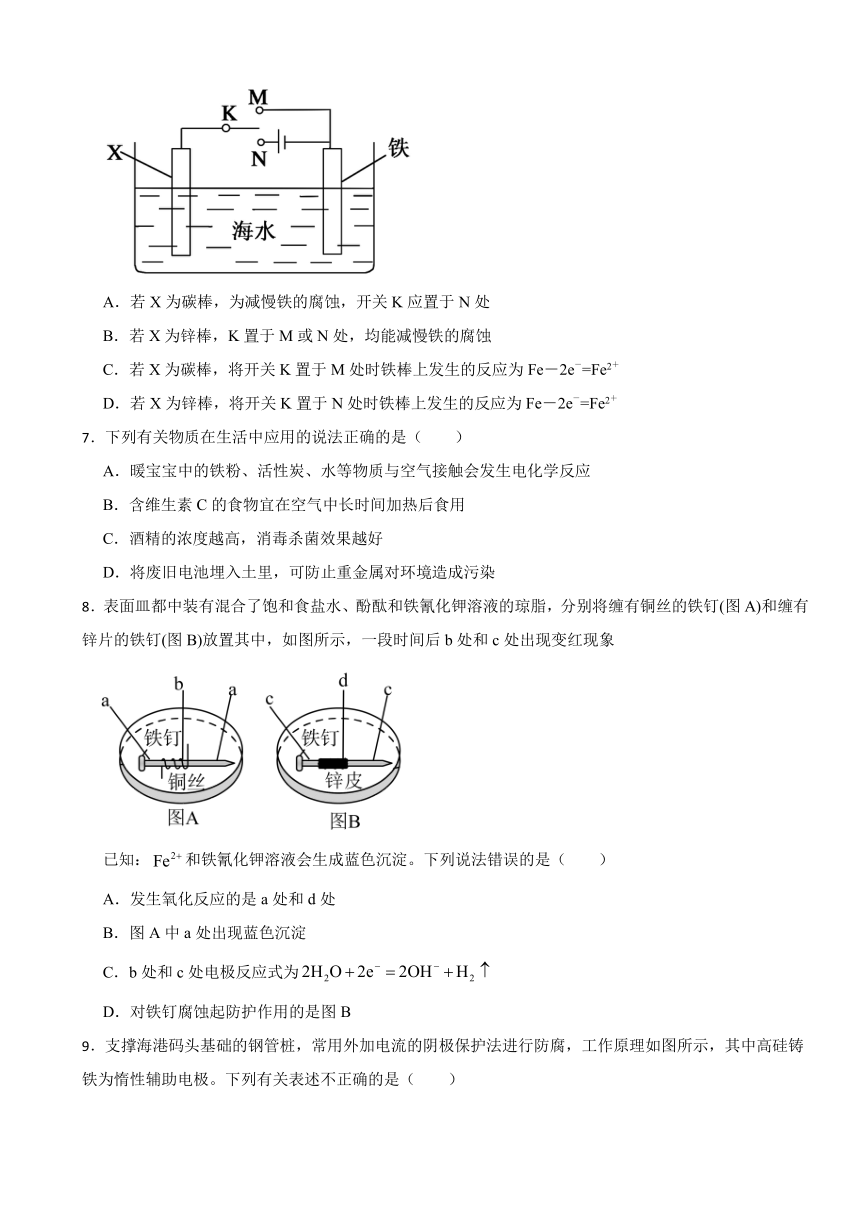
6.利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法错误的是( )
A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处
B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀
C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+
D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+
7.下列有关物质在生活中应用的说法正确的是( )
A.暖宝宝中的铁粉、活性炭、水等物质与空气接触会发生电化学反应
B.含维生素C的食物宜在空气中长时间加热后食用
C.酒精的浓度越高,消毒杀菌效果越好
D.将废旧电池埋入土里,可防止重金属对环境造成污染
8.表面皿都中装有混合了饱和食盐水、酚酞和铁氰化钾溶液的琼脂,分别将缠有铜丝的铁钉(图A)和缠有锌片的铁钉(图B)放置其中,如图所示,一段时间后b处和c处出现变红现象
已知:和铁氰化钾溶液会生成蓝色沉淀。下列说法错误的是( )
A.发生氧化反应的是a处和d处
B.图A中a处出现蓝色沉淀
C.b处和c处电极反应式为
D.对铁钉腐蚀起防护作用的是图B
9.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是( )
A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
10.下列对应的电极反应式中,正确的是( )
A.用惰性电极电解饱和食盐水时,阳极的电极反应式:
B.酸性氢氧燃料电池正极的电极反应式:
C.粗铜精炼时,与电源正极相连的电极上的电极反应式:
D.钢铁发生吸氧腐蚀时,铁电极的电极反应式:
11.下列有关金属电化学腐蚀的说法正确的是( )
A.铜既可以发生析氢腐蚀也可以发生吸氧腐蚀
B.铁只能发生析氢腐蚀
C.铜只能发生吸氧腐蚀
D.析氢腐蚀比吸氧腐蚀普遍
12.将一块金属镀层破损的铁块置于海边,一段时间后铁块如图所示。下列说法正确的是( )
A.该铁块仅发生化学腐蚀
B.镀层金属的活泼性比铁弱
C.铁块上发生的电极反应式为:
D.电子由镀层金属流向铁块
13.下列关于金属腐蚀的说法中不正确的是( )
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.金属腐蚀一般包括化学腐蚀和电化学腐蚀
C.纯的金属一般难以发生电化学腐蚀
D.钢铁在酸性环境中会发生吸氧腐蚀
14.如图,各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③>⑤>⑥ B.⑥>④>②>①>③>⑤
C.④>②>⑤>③>⑥>① D.⑥>③>②>④>①>⑤
15.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
16.在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )
A.锌块作原电池的负极
B.钢铁在海水中易发生吸氧腐蚀
C.电子由船体钢铁外壳向锌块移动
D.在海水中阳离子向船体钢铁外壳移动
二、综合题
17.化学是一门以实验为基础的学科。回答下列问题:
(1)Ⅰ.中和反应反应热的测定。
测定50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液中和反应时放出的热量。
采用稍过量的NaOH溶液的原因是 。
(2)若两种溶液的密度均为,反应后生成溶液的比热容,反应过程中测得体系温度升高3℃,则该反应放出 kJ热量。
(3)Ⅱ.温度对化学平衡的影响。
在生成的反应中,存在如下平衡:。取两个封装有和混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在 (填“热水”或“冷水”)中的颜色更深,产生这一现象的原因是 。
(4)ⅢI.简易原电池反应。
培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生 色的 (填化学式)沉淀;铜丝周围的现象是 ,发生的电极反应式为 。
18.炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:
(1)铁锅的锈蚀应属于 腐蚀。
(2)铁锅锈蚀的电极反应式为:负极: ;正极: 。正负极反应产物会继续发生反应,反应的离子方程式 ,化学方程式为 。
19.如图所示2套实验装置,分别回答下列问题。
(1)装置Ⅰ为铁的吸氧腐蚀实验。一段时间后,铁被 (填“ 氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应为 。
(2)装置Ⅱ中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到铁片电极附近首先变红。电源的M端为 (填“正”或“负”)极,甲烧杯中铁电极的电极反应为 ,停止电解,乙中 电极质量增加。
20.
(1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的 性。
②误食重金属盐会使人中毒,应口服 来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了 (化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是 。
(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤
①菜谱中富含脂肪的食物是 。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是 (填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式 。青椒、西红柿等蔬菜富含维生素C,维生素C 又称 酸,用淀粉溶液和碘水可检验维生素C的 性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的 (填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式 。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式 。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式 。
21.写出下列反应的热化学方程式.
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=﹣285.84kJ/mol 在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 (填序号)
答案解析部分
1.【答案】A
【解析】【解答】①Fe先由0价转化为+2价,进一步氧化变为+3价,故①符合题意;②O
2得电子,化合价降低被还原,故②符合题意;③吸氧腐蚀过程中,得电子的是氧气,不是氢离子,没有氢气生成,故③不符合题意;④铁锈形成过程中,Fe(OH)
3失水形成Fe
2O
3·
nH
2O故④符合题意;⑤杂质C作为原电池的正极,没有发生反应,故⑤不符合题意;
故答案为:A。
【分析】判定吸氧腐蚀,析氢腐蚀,首先要看金属所处的环境,若为强酸环境则为析氢腐蚀,若为弱酸,碱性或中性环境则为吸氧腐蚀。吸氧腐蚀过程为:
1.Fe先由0价转化为+2价
F再由+2价转化为+3价 2.O2被还原 3.Fe(OH)3失水形成Fe2O3·nH2O
2.【答案】C
【解析】【解答】A.金属钠置于空气中变暗是因为钠与空气中的氧气反应生成氧化钠,与电化学腐蚀无关,选项A不符合;
B.铝片浸入浓硝酸中产生致密的氧化膜,是铝被钝化,发生氧化还原反应,与电化学腐蚀无关,选项B不符合;
C.黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜矿,制作的铜锣不易生成铜绿,与电化学腐蚀有关,选项C符合;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁,与电化学腐蚀无关,选项D不符合;
故答案为:C。
【分析】A.金属钠在空气中生成氧化钠,与电化学腐蚀无关;
B.铝在浓硝酸中钝化与电化学腐蚀无关;
C.铜锌构成原电池,锌比铜活泼,锌被腐蚀,铜被保护;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁。
3.【答案】D
【解析】【解答】解:A、铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿;和电化学有关,故A不符合;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极发生氧化反应被腐蚀;所以容易生锈,故B不符合;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极发生氧化反应被腐蚀,故C不符合;
D、银在空气中被氧化发生化学腐蚀;和电化腐蚀无关,故D符合;
故选D.
【分析】A、铜锌合金在电解质溶液中形成原电池反应,依据原电池电极反应分析判断;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极;
D、银在空气中被氧化发生化学腐蚀.
4.【答案】C
【解析】【解答】A项中形成原电池时,铁作负极,加速铁的腐蚀;B项中形成原电池时,铁作负极,加速铁的腐蚀;D项中铸铁管作阳极,加速铁的腐蚀;C项中锌比铁活泼,铁作正极被保护。
故答案为:C
【分析】A.原电池中,铁作负极被腐蚀;
B.原电池中,铁作负极被腐蚀;
C.原电池中,铁作正极被保护;
D.电解池中,阳极被腐蚀。
5.【答案】D
【解析】【解答】A. 可燃物燃烧时放出热量,所以能量变化主要是化学能转化为热能,A项不符合题意;
B. 明矾中含有铝离子,铝离子水解使溶液显酸性,Cu2(OH)2CO3能与酸性溶液反应,所以可用明矾水除去铜器上的铜锈,B项不符合题意;
C. 锡青铜是铜锡合金,在潮湿环境中,铜锡合金会形成原电池,发生吸氧腐蚀,所以锡青铜(铜锡合金)文物在潮湿环境中的腐蚀比干燥环境中快,C项不符合题意;
D. 丹砂为硫化汞,不稳定,加热发生HgS Hg+S,温度降低时,又可发生Hg + S = HgS,二者反应条件不同,不符合可逆反应概念,D项符合题意;
故答案为:D。
【分析】 A.燃烧过程中发生化学能转化为热能;
B.明矾水解使溶液呈酸性,与碱式碳酸铜反应;
C.锡青铜是合金,在潮湿环境下可形成原电池;
D.硫化汞分解与汞与硫的反应条件不同。
6.【答案】D
【解析】【解答】A.若X为碳棒,当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故A不符合题意;
B.若 X 为锌棒,开关 K 置于 M处,形成原电池,锌比铁活泼,锌为负极,铁做正极,在原电池中正极被保护,能减缓铁的腐蚀;当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故B不符合题意;
C.若X为碳棒,开关 K 置于 M处,形成原电池,铁做负极,铁棒上发生的反应为Fe-2e-=Fe2+,故C不符合题意;
D.当X为锌时,开关K置于N处,形成电解池,铁做阴极,故阴极上的电极反应为:O2+4e-+2H2O=4OH-,故D符合题意;
故答案为:D。
【分析】若K置于N处,必须让被保护的金属接电源负极,若开关K置于M处,形成原电池,金属铁为正极,金属铁被保护,铁做负极被腐蚀。
7.【答案】A
【解析】【解答】A.暖宝宝中发生了原电池反应,实质是铁的电化学腐蚀,故A符合题意;
B.维生素C的食物在空气中长时间加热后会变质,不能长时间加热,故B不符合题意;
C.酒精的消毒杀菌效果最好的浓度是百分之七十五,不是浓度越大越好,故C不符合题意;
D.废电池埋入土里会污染土壤,故D不符合题意;
故答案为:A。
【分析】根据金属电化学腐蚀的原理判断,或者根据化学反应的实质判断是否发生电化学反应,利用维生素C具有还原性,氧气具有氧化性,根据氧化还原反应进行判断。
8.【答案】C
【解析】【解答】A.根据前面分析b、c处发生还原反应,则说明发生氧化反应的是a处和d处,故A不符合题意;
B.a处是铁失去电子变为亚铁离子,和铁氰化钾溶液会生成蓝色沉淀,因此图A中a处出现蓝色沉淀,故B不符合题意;
C.根据前面分析b、c处发生还原反应即b处和c处电极反应式为,故C符合题意;
D.A中铁为负极,铜为正极,对铁有腐蚀性,而B中铁为正极,锌为负极,因此对铁钉腐蚀起防护作用的是图B,是牺牲阳极的阴极保护法,故D不符合题意。
故答案为:C。
【分析】易错点:在中性和碱性条件发生吸氧腐蚀:在酸性条件下发生析氢腐蚀
9.【答案】B
【解析】【解答】A、被保护的钢管桩与电源的负极相连作为阴极,高硅铸铁惰性辅助电极为阳极钢管桩,阴极不参与反应,起到了保护作用,A不符合题意;
B、高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,B符合题意;
C、在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,C不符合题意;
D、被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱电化学腐蚀的发生,D不符合题意;
故答案为:B。
【分析】A、外加电流的阴极保护法,就是电解原理,保护阴极;
B、高硅铸铁为惰性辅助阳极,所以也不会被损耗;
C、结合题意,保护电流应该根据环境条件变化进行调整;
D、阴极的电子,应该尽可能使电流为零防止发生金属和电解质的电化学腐蚀;
10.【答案】A
【解析】【解答】A.电解池中阳极发生氧化反应,所以惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑,故A符合题意;
B.酸性氢氧燃料电池中,负极上燃料失电子,正极上是氧气得电子的还原反应,正极反应式为O2+4H++4e-=2H2O,故B不符合题意;
C.粗铜精炼时,与电源正极相连的是粗铜,电极反应式为Cu-2e-=Cu2+,故C不符合题意;
D.钢铁发生电化学腐蚀时,负极电极反应式为:Fe-2e-=Fe2+,故D不符合题意;
故答案为:A。
【分析】A.电解池中阳极发生氧化反应;
B.酸性氢氧燃料电池中,负极上燃料失电子,正极上是氧气得电子的还原反应;
C.粗铜精炼时,与电源正极相连的是粗铜;
D.钢铁发生电化学腐蚀时,负极Fe失电子发生氧化反应。
11.【答案】C
【解析】【解答】解:A.铜活泼性比氢弱,不能发生析氢腐蚀,故A错误;
B.铁活泼性比氢强,所以铁既可以发生析氢腐蚀也可以发生吸氧腐蚀,故B错误;
C.铜活泼性比氢弱,不能发生析氢腐蚀,只能发生吸氧腐蚀,故C正确;
D.吸氧腐蚀比析氢腐蚀普遍,故D错误;
故选:C.
【分析】铜活泼性比氢弱,而铁比氢强,所以铜不能发生析氢腐蚀只能发生吸氧腐蚀,铁既可以发生析氢腐蚀也可以发生吸氧腐蚀,据此分析.
12.【答案】B
【解析】【解答】A.镀层金属与铁块构成原电池,该铁块发生电化学腐蚀,故A不符合题意;
B.由图示可知,铁被腐蚀,镀层金属作正极,镀层金属的活泼性比铁弱,故B符合题意;
C.铁被腐蚀,铁作负极,铁块上发生的电极反应式为 ,故C不符合题意;
D.铁作负极、镀层金属作正极,电子由铁块流向镀层金属,故D不符合题意;
故答案为:B。
【分析】 A.金属镀层破损,镀层金属与铁块构成原电池,该铁块发生电化学腐蚀;
B.铁被腐蚀,说明铁作负极,活泼型比镀层金属强;
C.铁块上发生的电极反应式为 ;
D.电子由负极流向正极,由铁流向镀层金属;
13.【答案】D
【解析】【解答】解:A.金属原子最外层电子数小于4,所以在化学反应中常常容易失电子而被氧化,故A正确;
B.金属和其它物质之间直接发生化学反应的属于化学腐蚀,能形成原电池的属于电化学腐蚀,所以金属腐蚀一般包括化学腐蚀和电化学腐蚀,故B正确;
C.作原电池负极的金属易被腐蚀,纯的金属和电解质溶液不能构成原电池,所以一般难以发生电化学腐蚀,故C正确;
D.钢铁在酸性环境中易发生析氢腐蚀,在中性或碱性环境中易发生吸氧腐蚀,故D错误;
故选D.
【分析】A.金属在化学反应中易失电子而发生氧化反应;
B.金属腐蚀一般包括化学腐蚀和电化学腐蚀;
C.不能形成原电池的金属难发生电化学腐蚀;
D.钢铁在酸性环境中易发生析氢腐蚀.
14.【答案】B
【解析】【解答】解:金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,
①中Fe发生化学腐蚀;
②中Fe作负极,加速被腐蚀;
③中Fe作正极,被保护;
④Fe作负极而加速被腐蚀,但其被腐蚀速率大于②;
⑤作电解池阴极,被保护;
⑥作电解池阳极而加速被腐蚀;
所以Fe被腐蚀快慢顺序是⑥>④>②>①>③>⑤,故选B.
【分析】金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,据此分析解答.
15.【答案】D
【解析】【解答】A.该电解质溶液的酸碱性未知,无法判断铁钉发生析氢腐蚀或吸氧腐蚀,A不符合题意;
B.在铁件上镀铜,则铁件为镀件,应做阴极,与电源的负极相连,铜为镀层金属,做阳极,与电源的正极相连,B不符合题意;
C.电解精炼铜的初期,由于粗铜中含有Zn、Fe等活泼金属,阳极由Zn、Fe发生失电子的氧化反应,此时阴极由电解质溶液中的Cu2+发生得电子的还原反应,因此电解过程中,溶液中c(Cu2+)减小,C不符合题意;
D.将输油管与电源负极相连,则输油管作为阴极,由溶液中的阳离子发生得电子的还原反应,起到保护作用,可防止输油管腐蚀,D符合题意;
故答案为:D
【分析】A.根据析氢腐蚀的过程分析;
B.根据电镀过程分析;
C.根据电解精炼铜的过程分析;
D.根据外加电流的阴极保护法分析;
16.【答案】C
【解析】【解答】A.牺牲阳极法安装活泼金属做原电池负极,被保护的钢铁做正极,锌块作负极,A项不符合题意;
B.海水中pH接近中性,易发生吸氧腐蚀,B项不符合题意;
C.原电池中电子从负极经外电路流向正极,C项符合题意;
D.原电池正极得电子,电解质中阳离子向正极移动,D项不符合题意;
故答案为:C。
【分析】 钢铁外壳上镶嵌锌块 ,形成锌铁原电池,锌作负极,铁作正极,电子从锌电极流向铁电极,钢铁被保护。
17.【答案】(1)使盐酸溶液充分反应
(2)1.254
(3)热水;浸在热水中的烧瓶内该平衡逆向移动,导致浓度增大,体系颜色加深
(4)红褐色;Fe(OH)3;溶液呈蓝色;O2+2H2O+4e-=4OH-
【解析】【解答】(1)中和反应反应热的测定实验关键是准确测量温度的改变量,采用稍过量的NaOH溶液,可以使盐酸溶液充分反应,确保实际生成水的量与理论计算量相符。
(2)依题意,该反应放出热量Q===1.254kJ。
(3)是红棕色气体,是无色气体,由于平衡,,即正向放热,故片刻后,浸在热水中的烧瓶内该平衡逆向移动,导致浓度增大,体系颜色加深;而浸在冷水中的烧瓶内该平衡正向移动,导致浓度减小,体系颜色变浅;故浸在热水中的颜色更深。
(4)依题意,没有缠铜丝的铁钉在NaCl饱和溶液中发生吸氧腐蚀,附近产生红褐色的Fe(OH)3沉淀;缠铜丝的部分,铁钉与铜丝以NaCl溶液为电解质构成原电池,铁钉为负极失去电子生成Fe2+,在铜丝周围遇溶液呈蓝色,铜丝为正极,溶液中的氧气得电子,发生的电极反应式为:O2+2H2O+4e-=4OH-。
【分析】(1)中和反应反应热的测定实验关键是准确测量温度的改变量;
(2)利用Q=计算;
(3)依据化学平衡移动原理分析;
(4)利用吸氧腐蚀判断现象、书写电极反应式。
18.【答案】(1)电化学
(2)Fe-2e-=Fe2+;;Fe2++2OH-=Fe(OH)2↓;
【解析】【解答】(1)铁锅中含有铁和碳,若有氯化钠残液存在时容易形成原电池,发生原电池反应的腐蚀属于电化学腐蚀,故答案为:电化学;
(2)铁锅与电解质形成的原电池中,铁为负极,碳为正极,负极反应为:Fe-2e-=Fe2+,正极空气中氧气得电子,电极反应为: ,负极产生的亚铁离子与正极生成的氢氧根离子结合生成氢氧化铁,离子反应为:Fe2++2OH-=Fe(OH)2↓,该电池的总反应为: ,故答案为:Fe-2e-=Fe2+; ;Fe2++2OH-=Fe(OH)2↓; ;
【分析】(1)电解质溶液是氯化钠,为中性溶液,故可发生吸氧腐蚀
(2)负极是铁,铁失去电子,变成亚铁离子;正极是碳,空气中的氧气得到电子,负极产生亚铁离子和正极产生的氢氧根结合
19.【答案】(1)氧化;O2+2H2O+4e-=4OH-
(2)负;2H2O+2e-=H2↑+2OH-;石墨
【解析】【解答】(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:氧化;O2+4e-+2H2O-═4OH-;
(2)反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到铁电极附近首先变红,说明在铁电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为负极,N端为正极,阴极反应为2H2O+2e-=H2↑+2OH-,
故答案为:负;2H2O+2e-=H2↑+2OH-;
乙烧杯电解硫酸铜溶液,石墨为阴极,电极反应为Cu2++2e-═Cu,故质量增加,
故答案为:石墨。
【分析】(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH- ;
(2) M端为负极,N端为正极,乙烧杯电解硫酸铜溶液,石墨为阴极,电极反应为Cu2++2e-=Cu,据此分析。
20.【答案】(1)吸附性;牛奶或豆浆;电化学腐蚀;可回收垃圾
(2)红烧五花肉;氨基酸;(C6H10O5)n;抗坏血酸;还原性;c
(3)5CO2+16H2 C5H12+10H2O;CH4·nH2O+2 O2= CO2 + (n+2 )H2O;
【解析】【解答】(1)①活性炭的结构属于疏松多空结构,能够起到吸附作用,正确答案:吸附性。
②重金属盐会使蛋白质变性,牛奶或豆浆都属于蛋白质,应该服用牛奶或豆浆来解毒,正确答案:牛奶或豆浆。
③铁、碳构成了原电池,铁做负极,失电子,变为亚铁离子,在溶液中变为氢氧化亚铁沉淀,空气中被氧化为氢氧化铁,最终失水变为氧化铁红棕色锈斑,这主要原因为铁发生了电化学腐蚀;正确答案:电化学腐蚀。
④正确答案:可回收垃圾。
(2)①肉类中脂肪的量较多,因此菜谱中富含脂肪的食物是红烧五花肉,正确答案:红烧五花肉。
②蛋白质在人体中完全水解的产物为多种氨基酸,正确答案:氨基酸。
③淀粉的化学式(C6H10O5)n ;维生素C 又称抗坏血酸;淀粉溶液和碘水混合溶液显蓝色,维生素C具有还原性,可以把碘还原为碘离子,蓝色溶液褪色,正确答案:(C6H10O5)n;抗坏血酸;还原。
④胃酸主要成分为盐酸,需要用碱性物质来中和盐酸,复方氢氧化铝片就能够和盐酸反应,达到中和的目的,故答案为:C。
(3)①CO2与氢气发生反应生成C5H12,根据原子守恒规律,该反应的方程式5CO2 +16 H2 C5H12 +10H2O ;正确答案:5CO2 +16 H2 C5H12 +10H2O。
②可燃冰(CH4·nH2O)在空气中充分燃烧生成二氧化碳和水,根据原子守恒规律,方程式. CH4·nH2O+2 O2= CO2 + (n+2 )H2O ;正确答案:CH4·nH2O+2 O2= CO2 + (n+2 )H2O。
③乙烯发生加聚反应生成聚乙烯塑料,聚乙烯塑料的结构简式为 ;正确答案: 。
【分析】(1)②重金属主要能使蛋白质变性而失去活性,因此需要补充大量蛋白质来结合重金属离子。含蛋白质多的有牛奶,蛋清,豆浆等
(2)③碘变成碘离子化合价降低,因此做氧化剂,则维C做还原剂
(3)未知产物的化学方程式,可通过原子守恒来配平。
21.【答案】(1)S(s)+O2(g)=SO2(g)△H=﹣299.52 kJ mol﹣1
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol
(3)④②①③
【解析】【解答】解:(1)质量换算物质的量结合反应热计算得到生成1mol二氧化硫气体的焓变,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,生成1molSO2的反应放出的热量=9.36KJ×32=299.52 kJ;依据热化学方程式书写方法,标注物质聚集状态,和对应量的反应热;热化学方程式为:S(s)+O2(g)=SO2(g)△H=﹣299.52 kJ mol﹣1;
故答案为:S(s)+O2(g)=SO2(g)△H=﹣299.52 kJ mol﹣1;(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=﹣285.84kJ/mol
依据盖斯定律①+ ②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;(3)①是铁的化学腐蚀;②是原电池反应铁做负极被腐蚀;③形成原电池反应,铁做正极被保护;④电解池反应,铁做阳极被腐蚀;电解池阳极腐蚀最快,其次是原电池的负极,原电池正极被保护,所以Fe片腐蚀由快到慢的顺序是④②①③;
故答案为:④②①③;
【分析】(1)质量换算物质的量结合反应热计算得到生成1mol二氧化硫气体的焓变,依据热化学方程式书写方法,标注物质聚集状态,和对应量的反应热;(2)依据热化学方程式和盖斯定律计算得到;(3)①是铁的化学腐蚀;②是原电池反应铁做负极被腐蚀;③形成原电池反应,铁做正极被保护;④电解池反应,铁做阳极被腐蚀;
一、单选题
1.在铁的吸氧腐蚀过程中,下列5种变化中可能发生的是()
①Fe由+2价转化为+3价 ②O2被还原 ③产生H2
④Fe(OH)3失水形成Fe2O3·nH2O ⑤杂质C被氧化除去
A.①②④ B.③④
C.①②③④ D.①②③⑤
2.金属腐蚀现象普遍存在。下列事实与电化学腐蚀有关的是( )
A.金属钠置于空气中变暗
B.铝片浸入浓硝酸中产生致密的氧化膜
C.黄铜(铜锌合金)制作的铜锣不易生成铜绿
D.铁在 和 的混合溶液中发蓝、发黑
3.下列现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,接触处容易生铁锈
D.银质奖牌放置久了表面变暗
4.为了防止钢铁腐蚀,下列防护方法正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的铁闸门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在电动输油管的铸铁管上接直流电源的正极
5.中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B.我国古代人民常用明矾水除去铜器上的铜锈
C.锡青铜 铜锡合金 文物在潮湿环境中的腐蚀比干燥环境中快
D.晋代炼丹家、医学家葛洪所著 抱扑子 一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
6.利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法错误的是( )
A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处
B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀
C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+
D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+
7.下列有关物质在生活中应用的说法正确的是( )
A.暖宝宝中的铁粉、活性炭、水等物质与空气接触会发生电化学反应
B.含维生素C的食物宜在空气中长时间加热后食用
C.酒精的浓度越高,消毒杀菌效果越好
D.将废旧电池埋入土里,可防止重金属对环境造成污染
8.表面皿都中装有混合了饱和食盐水、酚酞和铁氰化钾溶液的琼脂,分别将缠有铜丝的铁钉(图A)和缠有锌片的铁钉(图B)放置其中,如图所示,一段时间后b处和c处出现变红现象
已知:和铁氰化钾溶液会生成蓝色沉淀。下列说法错误的是( )
A.发生氧化反应的是a处和d处
B.图A中a处出现蓝色沉淀
C.b处和c处电极反应式为
D.对铁钉腐蚀起防护作用的是图B
9.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是( )
A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
10.下列对应的电极反应式中,正确的是( )
A.用惰性电极电解饱和食盐水时,阳极的电极反应式:
B.酸性氢氧燃料电池正极的电极反应式:
C.粗铜精炼时,与电源正极相连的电极上的电极反应式:
D.钢铁发生吸氧腐蚀时,铁电极的电极反应式:
11.下列有关金属电化学腐蚀的说法正确的是( )
A.铜既可以发生析氢腐蚀也可以发生吸氧腐蚀
B.铁只能发生析氢腐蚀
C.铜只能发生吸氧腐蚀
D.析氢腐蚀比吸氧腐蚀普遍
12.将一块金属镀层破损的铁块置于海边,一段时间后铁块如图所示。下列说法正确的是( )
A.该铁块仅发生化学腐蚀
B.镀层金属的活泼性比铁弱
C.铁块上发生的电极反应式为:
D.电子由镀层金属流向铁块
13.下列关于金属腐蚀的说法中不正确的是( )
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.金属腐蚀一般包括化学腐蚀和电化学腐蚀
C.纯的金属一般难以发生电化学腐蚀
D.钢铁在酸性环境中会发生吸氧腐蚀
14.如图,各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③>⑤>⑥ B.⑥>④>②>①>③>⑤
C.④>②>⑤>③>⑥>① D.⑥>③>②>④>①>⑤
15.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
16.在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )
A.锌块作原电池的负极
B.钢铁在海水中易发生吸氧腐蚀
C.电子由船体钢铁外壳向锌块移动
D.在海水中阳离子向船体钢铁外壳移动
二、综合题
17.化学是一门以实验为基础的学科。回答下列问题:
(1)Ⅰ.中和反应反应热的测定。
测定50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液中和反应时放出的热量。
采用稍过量的NaOH溶液的原因是 。
(2)若两种溶液的密度均为,反应后生成溶液的比热容,反应过程中测得体系温度升高3℃,则该反应放出 kJ热量。
(3)Ⅱ.温度对化学平衡的影响。
在生成的反应中,存在如下平衡:。取两个封装有和混合气体的圆底烧瓶,将它们分别浸在盛有热水、冷水的大烧杯中。片刻后,比较两个烧瓶里气体的颜色,浸在 (填“热水”或“冷水”)中的颜色更深,产生这一现象的原因是 。
(4)ⅢI.简易原电池反应。
培养皿内装有含NaCl饱和溶液的琼脂,再滴入5~6滴酚酞溶液和溶液,混合均匀,铁钉用砂纸磨光,缠上铜丝放入培养皿中。一段时间后,可观察到没有缠铜丝的铁钉附近产生 色的 (填化学式)沉淀;铜丝周围的现象是 ,发生的电极反应式为 。
18.炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑。试回答:
(1)铁锅的锈蚀应属于 腐蚀。
(2)铁锅锈蚀的电极反应式为:负极: ;正极: 。正负极反应产物会继续发生反应,反应的离子方程式 ,化学方程式为 。
19.如图所示2套实验装置,分别回答下列问题。
(1)装置Ⅰ为铁的吸氧腐蚀实验。一段时间后,铁被 (填“ 氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应为 。
(2)装置Ⅱ中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到铁片电极附近首先变红。电源的M端为 (填“正”或“负”)极,甲烧杯中铁电极的电极反应为 ,停止电解,乙中 电极质量增加。
20.
(1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的 性。
②误食重金属盐会使人中毒,应口服 来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了 (化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是 。
(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤
①菜谱中富含脂肪的食物是 。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是 (填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式 。青椒、西红柿等蔬菜富含维生素C,维生素C 又称 酸,用淀粉溶液和碘水可检验维生素C的 性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的 (填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式 。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式 。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式 。
21.写出下列反应的热化学方程式.
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=﹣285.84kJ/mol 在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 (填序号)
答案解析部分
1.【答案】A
【解析】【解答】①Fe先由0价转化为+2价,进一步氧化变为+3价,故①符合题意;②O
2得电子,化合价降低被还原,故②符合题意;③吸氧腐蚀过程中,得电子的是氧气,不是氢离子,没有氢气生成,故③不符合题意;④铁锈形成过程中,Fe(OH)
3失水形成Fe
2O
3·
nH
2O故④符合题意;⑤杂质C作为原电池的正极,没有发生反应,故⑤不符合题意;
故答案为:A。
【分析】判定吸氧腐蚀,析氢腐蚀,首先要看金属所处的环境,若为强酸环境则为析氢腐蚀,若为弱酸,碱性或中性环境则为吸氧腐蚀。吸氧腐蚀过程为:
1.Fe先由0价转化为+2价
F再由+2价转化为+3价 2.O2被还原 3.Fe(OH)3失水形成Fe2O3·nH2O
2.【答案】C
【解析】【解答】A.金属钠置于空气中变暗是因为钠与空气中的氧气反应生成氧化钠,与电化学腐蚀无关,选项A不符合;
B.铝片浸入浓硝酸中产生致密的氧化膜,是铝被钝化,发生氧化还原反应,与电化学腐蚀无关,选项B不符合;
C.黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜矿,制作的铜锣不易生成铜绿,与电化学腐蚀有关,选项C符合;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁,与电化学腐蚀无关,选项D不符合;
故答案为:C。
【分析】A.金属钠在空气中生成氧化钠,与电化学腐蚀无关;
B.铝在浓硝酸中钝化与电化学腐蚀无关;
C.铜锌构成原电池,锌比铜活泼,锌被腐蚀,铜被保护;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁。
3.【答案】D
【解析】【解答】解:A、铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿;和电化学有关,故A不符合;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极发生氧化反应被腐蚀;所以容易生锈,故B不符合;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极发生氧化反应被腐蚀,故C不符合;
D、银在空气中被氧化发生化学腐蚀;和电化腐蚀无关,故D符合;
故选D.
【分析】A、铜锌合金在电解质溶液中形成原电池反应,依据原电池电极反应分析判断;
B、生铁中含有碳,在电解质溶液中形成原电池反应,铁做原电池的负极;
C、铁和铜接触处和电解质溶液会形成原电池反应,铁做负极;
D、银在空气中被氧化发生化学腐蚀.
4.【答案】C
【解析】【解答】A项中形成原电池时,铁作负极,加速铁的腐蚀;B项中形成原电池时,铁作负极,加速铁的腐蚀;D项中铸铁管作阳极,加速铁的腐蚀;C项中锌比铁活泼,铁作正极被保护。
故答案为:C
【分析】A.原电池中,铁作负极被腐蚀;
B.原电池中,铁作负极被腐蚀;
C.原电池中,铁作正极被保护;
D.电解池中,阳极被腐蚀。
5.【答案】D
【解析】【解答】A. 可燃物燃烧时放出热量,所以能量变化主要是化学能转化为热能,A项不符合题意;
B. 明矾中含有铝离子,铝离子水解使溶液显酸性,Cu2(OH)2CO3能与酸性溶液反应,所以可用明矾水除去铜器上的铜锈,B项不符合题意;
C. 锡青铜是铜锡合金,在潮湿环境中,铜锡合金会形成原电池,发生吸氧腐蚀,所以锡青铜(铜锡合金)文物在潮湿环境中的腐蚀比干燥环境中快,C项不符合题意;
D. 丹砂为硫化汞,不稳定,加热发生HgS Hg+S,温度降低时,又可发生Hg + S = HgS,二者反应条件不同,不符合可逆反应概念,D项符合题意;
故答案为:D。
【分析】 A.燃烧过程中发生化学能转化为热能;
B.明矾水解使溶液呈酸性,与碱式碳酸铜反应;
C.锡青铜是合金,在潮湿环境下可形成原电池;
D.硫化汞分解与汞与硫的反应条件不同。
6.【答案】D
【解析】【解答】A.若X为碳棒,当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故A不符合题意;
B.若 X 为锌棒,开关 K 置于 M处,形成原电池,锌比铁活泼,锌为负极,铁做正极,在原电池中正极被保护,能减缓铁的腐蚀;当开关K置于N处时,形成电解池,铁做阴极被保护,能减缓铁的腐蚀,故B不符合题意;
C.若X为碳棒,开关 K 置于 M处,形成原电池,铁做负极,铁棒上发生的反应为Fe-2e-=Fe2+,故C不符合题意;
D.当X为锌时,开关K置于N处,形成电解池,铁做阴极,故阴极上的电极反应为:O2+4e-+2H2O=4OH-,故D符合题意;
故答案为:D。
【分析】若K置于N处,必须让被保护的金属接电源负极,若开关K置于M处,形成原电池,金属铁为正极,金属铁被保护,铁做负极被腐蚀。
7.【答案】A
【解析】【解答】A.暖宝宝中发生了原电池反应,实质是铁的电化学腐蚀,故A符合题意;
B.维生素C的食物在空气中长时间加热后会变质,不能长时间加热,故B不符合题意;
C.酒精的消毒杀菌效果最好的浓度是百分之七十五,不是浓度越大越好,故C不符合题意;
D.废电池埋入土里会污染土壤,故D不符合题意;
故答案为:A。
【分析】根据金属电化学腐蚀的原理判断,或者根据化学反应的实质判断是否发生电化学反应,利用维生素C具有还原性,氧气具有氧化性,根据氧化还原反应进行判断。
8.【答案】C
【解析】【解答】A.根据前面分析b、c处发生还原反应,则说明发生氧化反应的是a处和d处,故A不符合题意;
B.a处是铁失去电子变为亚铁离子,和铁氰化钾溶液会生成蓝色沉淀,因此图A中a处出现蓝色沉淀,故B不符合题意;
C.根据前面分析b、c处发生还原反应即b处和c处电极反应式为,故C符合题意;
D.A中铁为负极,铜为正极,对铁有腐蚀性,而B中铁为正极,锌为负极,因此对铁钉腐蚀起防护作用的是图B,是牺牲阳极的阴极保护法,故D不符合题意。
故答案为:C。
【分析】易错点:在中性和碱性条件发生吸氧腐蚀:在酸性条件下发生析氢腐蚀
9.【答案】B
【解析】【解答】A、被保护的钢管桩与电源的负极相连作为阴极,高硅铸铁惰性辅助电极为阳极钢管桩,阴极不参与反应,起到了保护作用,A不符合题意;
B、高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗,B符合题意;
C、在保护过程中要使被保护金属结构电位低于周围环境,则通入的保护电流应该根据环境条件变化进行调整,C不符合题意;
D、被保护的钢管桩应作为阴极,从而使得金属腐蚀发生的电子迁移得到抑制,使钢管桩表面腐蚀电流接近于零,避免或减弱电化学腐蚀的发生,D不符合题意;
故答案为:B。
【分析】A、外加电流的阴极保护法,就是电解原理,保护阴极;
B、高硅铸铁为惰性辅助阳极,所以也不会被损耗;
C、结合题意,保护电流应该根据环境条件变化进行调整;
D、阴极的电子,应该尽可能使电流为零防止发生金属和电解质的电化学腐蚀;
10.【答案】A
【解析】【解答】A.电解池中阳极发生氧化反应,所以惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑,故A符合题意;
B.酸性氢氧燃料电池中,负极上燃料失电子,正极上是氧气得电子的还原反应,正极反应式为O2+4H++4e-=2H2O,故B不符合题意;
C.粗铜精炼时,与电源正极相连的是粗铜,电极反应式为Cu-2e-=Cu2+,故C不符合题意;
D.钢铁发生电化学腐蚀时,负极电极反应式为:Fe-2e-=Fe2+,故D不符合题意;
故答案为:A。
【分析】A.电解池中阳极发生氧化反应;
B.酸性氢氧燃料电池中,负极上燃料失电子,正极上是氧气得电子的还原反应;
C.粗铜精炼时,与电源正极相连的是粗铜;
D.钢铁发生电化学腐蚀时,负极Fe失电子发生氧化反应。
11.【答案】C
【解析】【解答】解:A.铜活泼性比氢弱,不能发生析氢腐蚀,故A错误;
B.铁活泼性比氢强,所以铁既可以发生析氢腐蚀也可以发生吸氧腐蚀,故B错误;
C.铜活泼性比氢弱,不能发生析氢腐蚀,只能发生吸氧腐蚀,故C正确;
D.吸氧腐蚀比析氢腐蚀普遍,故D错误;
故选:C.
【分析】铜活泼性比氢弱,而铁比氢强,所以铜不能发生析氢腐蚀只能发生吸氧腐蚀,铁既可以发生析氢腐蚀也可以发生吸氧腐蚀,据此分析.
12.【答案】B
【解析】【解答】A.镀层金属与铁块构成原电池,该铁块发生电化学腐蚀,故A不符合题意;
B.由图示可知,铁被腐蚀,镀层金属作正极,镀层金属的活泼性比铁弱,故B符合题意;
C.铁被腐蚀,铁作负极,铁块上发生的电极反应式为 ,故C不符合题意;
D.铁作负极、镀层金属作正极,电子由铁块流向镀层金属,故D不符合题意;
故答案为:B。
【分析】 A.金属镀层破损,镀层金属与铁块构成原电池,该铁块发生电化学腐蚀;
B.铁被腐蚀,说明铁作负极,活泼型比镀层金属强;
C.铁块上发生的电极反应式为 ;
D.电子由负极流向正极,由铁流向镀层金属;
13.【答案】D
【解析】【解答】解:A.金属原子最外层电子数小于4,所以在化学反应中常常容易失电子而被氧化,故A正确;
B.金属和其它物质之间直接发生化学反应的属于化学腐蚀,能形成原电池的属于电化学腐蚀,所以金属腐蚀一般包括化学腐蚀和电化学腐蚀,故B正确;
C.作原电池负极的金属易被腐蚀,纯的金属和电解质溶液不能构成原电池,所以一般难以发生电化学腐蚀,故C正确;
D.钢铁在酸性环境中易发生析氢腐蚀,在中性或碱性环境中易发生吸氧腐蚀,故D错误;
故选D.
【分析】A.金属在化学反应中易失电子而发生氧化反应;
B.金属腐蚀一般包括化学腐蚀和电化学腐蚀;
C.不能形成原电池的金属难发生电化学腐蚀;
D.钢铁在酸性环境中易发生析氢腐蚀.
14.【答案】B
【解析】【解答】解:金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,
①中Fe发生化学腐蚀;
②中Fe作负极,加速被腐蚀;
③中Fe作正极,被保护;
④Fe作负极而加速被腐蚀,但其被腐蚀速率大于②;
⑤作电解池阴极,被保护;
⑥作电解池阳极而加速被腐蚀;
所以Fe被腐蚀快慢顺序是⑥>④>②>①>③>⑤,故选B.
【分析】金属Fe发生腐蚀快慢顺序为:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,据此分析解答.
15.【答案】D
【解析】【解答】A.该电解质溶液的酸碱性未知,无法判断铁钉发生析氢腐蚀或吸氧腐蚀,A不符合题意;
B.在铁件上镀铜,则铁件为镀件,应做阴极,与电源的负极相连,铜为镀层金属,做阳极,与电源的正极相连,B不符合题意;
C.电解精炼铜的初期,由于粗铜中含有Zn、Fe等活泼金属,阳极由Zn、Fe发生失电子的氧化反应,此时阴极由电解质溶液中的Cu2+发生得电子的还原反应,因此电解过程中,溶液中c(Cu2+)减小,C不符合题意;
D.将输油管与电源负极相连,则输油管作为阴极,由溶液中的阳离子发生得电子的还原反应,起到保护作用,可防止输油管腐蚀,D符合题意;
故答案为:D
【分析】A.根据析氢腐蚀的过程分析;
B.根据电镀过程分析;
C.根据电解精炼铜的过程分析;
D.根据外加电流的阴极保护法分析;
16.【答案】C
【解析】【解答】A.牺牲阳极法安装活泼金属做原电池负极,被保护的钢铁做正极,锌块作负极,A项不符合题意;
B.海水中pH接近中性,易发生吸氧腐蚀,B项不符合题意;
C.原电池中电子从负极经外电路流向正极,C项符合题意;
D.原电池正极得电子,电解质中阳离子向正极移动,D项不符合题意;
故答案为:C。
【分析】 钢铁外壳上镶嵌锌块 ,形成锌铁原电池,锌作负极,铁作正极,电子从锌电极流向铁电极,钢铁被保护。
17.【答案】(1)使盐酸溶液充分反应
(2)1.254
(3)热水;浸在热水中的烧瓶内该平衡逆向移动,导致浓度增大,体系颜色加深
(4)红褐色;Fe(OH)3;溶液呈蓝色;O2+2H2O+4e-=4OH-
【解析】【解答】(1)中和反应反应热的测定实验关键是准确测量温度的改变量,采用稍过量的NaOH溶液,可以使盐酸溶液充分反应,确保实际生成水的量与理论计算量相符。
(2)依题意,该反应放出热量Q===1.254kJ。
(3)是红棕色气体,是无色气体,由于平衡,,即正向放热,故片刻后,浸在热水中的烧瓶内该平衡逆向移动,导致浓度增大,体系颜色加深;而浸在冷水中的烧瓶内该平衡正向移动,导致浓度减小,体系颜色变浅;故浸在热水中的颜色更深。
(4)依题意,没有缠铜丝的铁钉在NaCl饱和溶液中发生吸氧腐蚀,附近产生红褐色的Fe(OH)3沉淀;缠铜丝的部分,铁钉与铜丝以NaCl溶液为电解质构成原电池,铁钉为负极失去电子生成Fe2+,在铜丝周围遇溶液呈蓝色,铜丝为正极,溶液中的氧气得电子,发生的电极反应式为:O2+2H2O+4e-=4OH-。
【分析】(1)中和反应反应热的测定实验关键是准确测量温度的改变量;
(2)利用Q=计算;
(3)依据化学平衡移动原理分析;
(4)利用吸氧腐蚀判断现象、书写电极反应式。
18.【答案】(1)电化学
(2)Fe-2e-=Fe2+;;Fe2++2OH-=Fe(OH)2↓;
【解析】【解答】(1)铁锅中含有铁和碳,若有氯化钠残液存在时容易形成原电池,发生原电池反应的腐蚀属于电化学腐蚀,故答案为:电化学;
(2)铁锅与电解质形成的原电池中,铁为负极,碳为正极,负极反应为:Fe-2e-=Fe2+,正极空气中氧气得电子,电极反应为: ,负极产生的亚铁离子与正极生成的氢氧根离子结合生成氢氧化铁,离子反应为:Fe2++2OH-=Fe(OH)2↓,该电池的总反应为: ,故答案为:Fe-2e-=Fe2+; ;Fe2++2OH-=Fe(OH)2↓; ;
【分析】(1)电解质溶液是氯化钠,为中性溶液,故可发生吸氧腐蚀
(2)负极是铁,铁失去电子,变成亚铁离子;正极是碳,空气中的氧气得到电子,负极产生亚铁离子和正极产生的氢氧根结合
19.【答案】(1)氧化;O2+2H2O+4e-=4OH-
(2)负;2H2O+2e-=H2↑+2OH-;石墨
【解析】【解答】(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:氧化;O2+4e-+2H2O-═4OH-;
(2)反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到铁电极附近首先变红,说明在铁电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为负极,N端为正极,阴极反应为2H2O+2e-=H2↑+2OH-,
故答案为:负;2H2O+2e-=H2↑+2OH-;
乙烧杯电解硫酸铜溶液,石墨为阴极,电极反应为Cu2++2e-═Cu,故质量增加,
故答案为:石墨。
【分析】(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH- ;
(2) M端为负极,N端为正极,乙烧杯电解硫酸铜溶液,石墨为阴极,电极反应为Cu2++2e-=Cu,据此分析。
20.【答案】(1)吸附性;牛奶或豆浆;电化学腐蚀;可回收垃圾
(2)红烧五花肉;氨基酸;(C6H10O5)n;抗坏血酸;还原性;c
(3)5CO2+16H2 C5H12+10H2O;CH4·nH2O+2 O2= CO2 + (n+2 )H2O;
【解析】【解答】(1)①活性炭的结构属于疏松多空结构,能够起到吸附作用,正确答案:吸附性。
②重金属盐会使蛋白质变性,牛奶或豆浆都属于蛋白质,应该服用牛奶或豆浆来解毒,正确答案:牛奶或豆浆。
③铁、碳构成了原电池,铁做负极,失电子,变为亚铁离子,在溶液中变为氢氧化亚铁沉淀,空气中被氧化为氢氧化铁,最终失水变为氧化铁红棕色锈斑,这主要原因为铁发生了电化学腐蚀;正确答案:电化学腐蚀。
④正确答案:可回收垃圾。
(2)①肉类中脂肪的量较多,因此菜谱中富含脂肪的食物是红烧五花肉,正确答案:红烧五花肉。
②蛋白质在人体中完全水解的产物为多种氨基酸,正确答案:氨基酸。
③淀粉的化学式(C6H10O5)n ;维生素C 又称抗坏血酸;淀粉溶液和碘水混合溶液显蓝色,维生素C具有还原性,可以把碘还原为碘离子,蓝色溶液褪色,正确答案:(C6H10O5)n;抗坏血酸;还原。
④胃酸主要成分为盐酸,需要用碱性物质来中和盐酸,复方氢氧化铝片就能够和盐酸反应,达到中和的目的,故答案为:C。
(3)①CO2与氢气发生反应生成C5H12,根据原子守恒规律,该反应的方程式5CO2 +16 H2 C5H12 +10H2O ;正确答案:5CO2 +16 H2 C5H12 +10H2O。
②可燃冰(CH4·nH2O)在空气中充分燃烧生成二氧化碳和水,根据原子守恒规律,方程式. CH4·nH2O+2 O2= CO2 + (n+2 )H2O ;正确答案:CH4·nH2O+2 O2= CO2 + (n+2 )H2O。
③乙烯发生加聚反应生成聚乙烯塑料,聚乙烯塑料的结构简式为 ;正确答案: 。
【分析】(1)②重金属主要能使蛋白质变性而失去活性,因此需要补充大量蛋白质来结合重金属离子。含蛋白质多的有牛奶,蛋清,豆浆等
(2)③碘变成碘离子化合价降低,因此做氧化剂,则维C做还原剂
(3)未知产物的化学方程式,可通过原子守恒来配平。
21.【答案】(1)S(s)+O2(g)=SO2(g)△H=﹣299.52 kJ mol﹣1
(2)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol
(3)④②①③
【解析】【解答】解:(1)质量换算物质的量结合反应热计算得到生成1mol二氧化硫气体的焓变,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,生成1molSO2的反应放出的热量=9.36KJ×32=299.52 kJ;依据热化学方程式书写方法,标注物质聚集状态,和对应量的反应热;热化学方程式为:S(s)+O2(g)=SO2(g)△H=﹣299.52 kJ mol﹣1;
故答案为:S(s)+O2(g)=SO2(g)△H=﹣299.52 kJ mol﹣1;(2)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=﹣285.84kJ/mol
依据盖斯定律①+ ②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=﹣319.6KJ/mol;(3)①是铁的化学腐蚀;②是原电池反应铁做负极被腐蚀;③形成原电池反应,铁做正极被保护;④电解池反应,铁做阳极被腐蚀;电解池阳极腐蚀最快,其次是原电池的负极,原电池正极被保护,所以Fe片腐蚀由快到慢的顺序是④②①③;
故答案为:④②①③;
【分析】(1)质量换算物质的量结合反应热计算得到生成1mol二氧化硫气体的焓变,依据热化学方程式书写方法,标注物质聚集状态,和对应量的反应热;(2)依据热化学方程式和盖斯定律计算得到;(3)①是铁的化学腐蚀;②是原电池反应铁做负极被腐蚀;③形成原电池反应,铁做正极被保护;④电解池反应,铁做阳极被腐蚀;
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
