四川省眉山市仁寿县三校2023-2024学年高二上学期11月期中联考化学试题(含答案)
文档属性
| 名称 | 四川省眉山市仁寿县三校2023-2024学年高二上学期11月期中联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 712.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 15:13:58 | ||
图片预览


文档简介
仁寿县三校2023-2024学年高二上学期11月期中联考
化学试题
考试时间:75分钟 总分100分
(相对原子质量K-39,I-127,O-16)
一、单选题(每小题3分,共42分)
1. 下列有关说法不正确的是( )
A. 固体与固体反应是吸热反应
B. 化学反应中的能量变化主要由化学键变化引起
C. 放热反应不需要加热就能发生,吸热反应不加热就不能发生
D. 节约能源不是简单减少能源的使用,更重要的是要充分有效地利用能源
2.下列各组物质依次属于非电解质、强电解质、弱电解质的是( )
A.稀盐酸、、 B.酒精、、
C.、烧碱、 D.、、
3. 下列热化学方程式及其有关叙述正确的( )
A.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g)ΔH=+285.8 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应,放出92.4 kJ的热量
D.已知乙炔的燃烧热为1 299.6 kJ·mol-1,则表示乙炔燃烧热的热化学方程式为C2H2(g)+O2(g)=2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1
4. 25℃时,下列说法不正确的是( )
A. 0.10mol/L、0.010mol/L的醋酸的电离常数Ka相同
B. 中和pH和体积均相等的醋酸、HCl溶液,所需NaOH的物质的量前者多
C. 1L pH=8的CH3COONa溶液中,由水电离出总的H+的物质的量为
D. 同pH的盐酸、醋酸溶液,对水的抑制程度相等
5. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、、Cl-
B. 与Al反应能放出H2的溶液中:Fe2+、K+、、
C. =1×10-13mol/L的溶液中:、Ca2+、Cl-、
D. 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、、
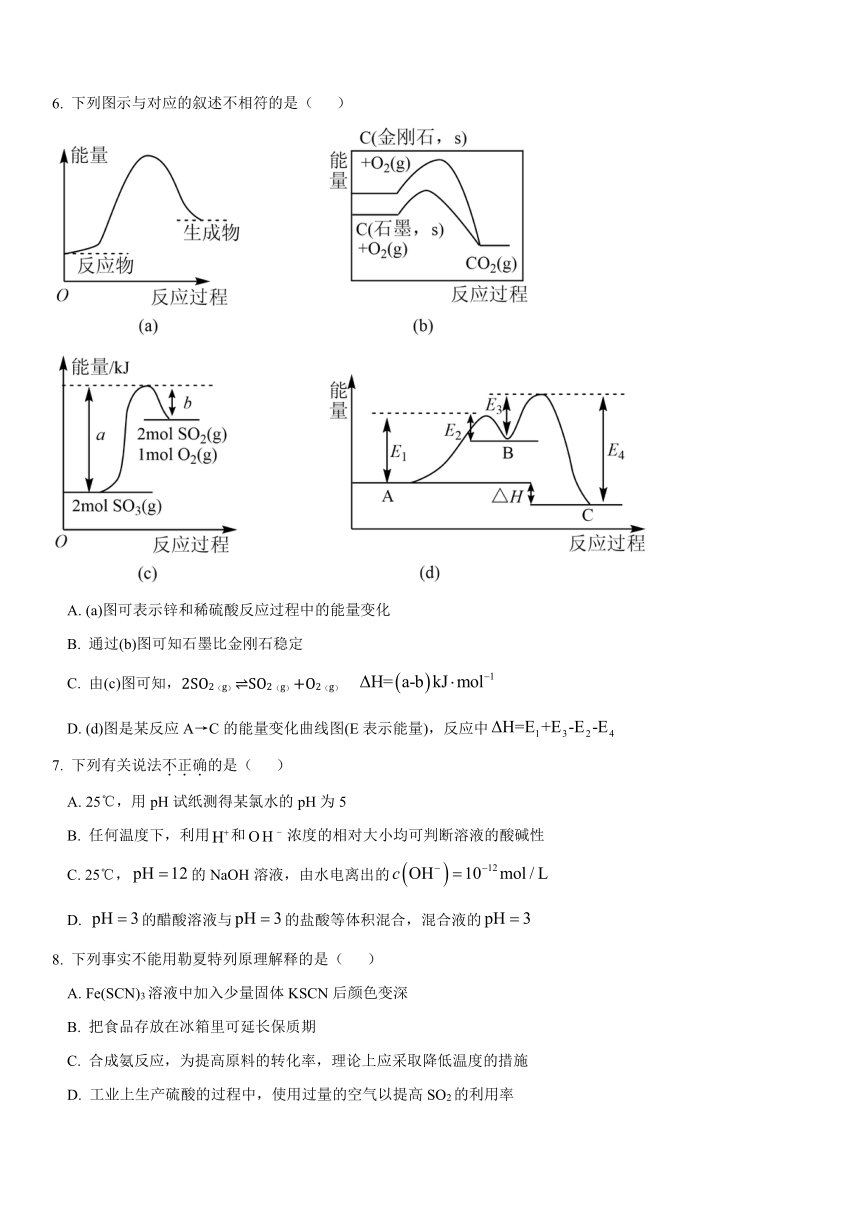
6. 下列图示与对应的叙述不相符的是( )
A. (a)图可表示锌和稀硫酸反应过程中的能量变化
B. 通过(b)图可知石墨比金刚石稳定
C. 由(c)图可知,2SO2(g) SO2(g)+O2(g)
D. (d)图是某反应A→C的能量变化曲线图(E表示能量),反应中
7. 下列有关说法不正确的是( )
A. 25℃,用pH试纸测得某氯水的pH为5
B. 任何温度下,利用和浓度的相对大小均可判断溶液的酸碱性
C. 25℃,的NaOH溶液,由水电离出的
D. 的醋酸溶液与的盐酸等体积混合,混合液的
8. 下列事实不能用勒夏特列原理解释的是( )
A. Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
B. 把食品存放在冰箱里可延长保质期
C. 合成氨反应,为提高原料的转化率,理论上应采取降低温度的措施
D. 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
9. 实验室需要配制溶液,并用其滴定未知浓度的盐酸溶液,下列装置能达到相应实验目的的是( )
A.称量 B.溶解 C.定容 D.滴定过程
10. 为阿伏加德罗常数的值。下列说法正确的是( )
A. 溶液水解生成的胶体粒子数少于
B. 溶液中,数目为
C. 的原子总数为
D. 25℃,溶液由水电离出的为
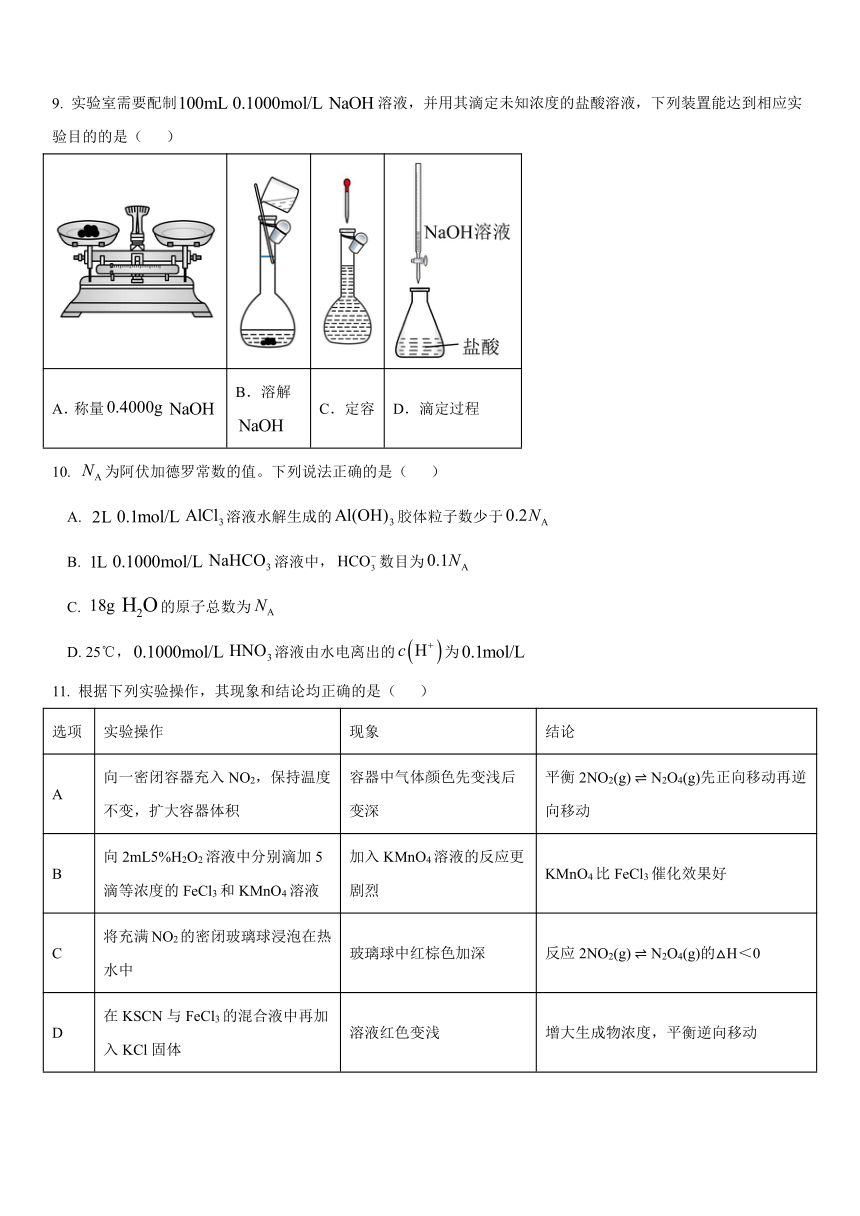
11. 根据下列实验操作,其现象和结论均正确的是( )
选项 实验操作 现象 结论
A 向一密闭容器充入NO2,保持温度不变,扩大容器体积 容器中气体颜色先变浅后变深 平衡2NO2(g) N2O4(g)先正向移动再逆向移动
B 向2mL5%H2O2溶液中分别滴加5滴等浓度的FeCl3和KMnO4溶液 加入KMnO4溶液的反应更剧烈 KMnO4比FeCl3催化效果好
C 将充满NO2的密闭玻璃球浸泡在热水中 玻璃球中红棕色加深 反应2NO2(g) N2O4(g)的△H<0
D 在KSCN与FeCl3的混合液中再加入KCl固体 溶液红色变浅 增大生成物浓度,平衡逆向移动
12. 对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响,下列判断正确的是( )
A. 由图a可知,该反应的正反应为吸热反应
B. 由图b可知,该反应m+nC. 若图c是绝热条件下速率和时间的图像,说明该反应的正反应为放热反应
D. 图d中的a曲线一定是加入了催化剂
13. 在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1。下列判断不正确的是( )
A.x=1
B.A的转化率为40%
C.2 min内B的反应速率为0.1 mol·L-1·min-1
D.若混合气体的密度不变,则表明该反应已达到平衡状态
14. 25℃时,的两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
A. 若,则NOH为强碱
B. 两种碱的物质的量浓度肯定不等
C. 均稀释100倍以后,MOH溶液中水的电离程度大于NOH溶液
D. 若两者均为弱碱,则,且NOH碱性强于MOH
二、填空题(共58分)
15. (14分)对SO2、NOx、CO2和CO进行回收利用是节能减排的重要课题。
某温度下,向恒容密闭容器中充入NO2、SO2发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是 (填序号)。
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1molNO
(2)在体积为密闭容器中充入和,发生反应,测得、的物质的量随时间变化如图所示。
反应到达3min时, (填“>”“<”或“=”)。
0~5min内, 。
反应达到平衡状态时,的体积分数为 %(保留1位小数)。
④a、b、c三点中代表达到平衡的是 ,a点的正反应速率 (填>、<或=)b点的逆反应速率
16.(10分)食醋(约含3%~5%的CH3COOH)、纯碱(Na2CO3)和84消毒液(主要成分为NaClO)是生活中常见的化学用品,回答下列问题:
(1)醋酸(CH3COOH)属于__________电解质(填“强”、“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因___________。
(2)用离子方程式表示纯碱溶液呈碱性原因___________。
(3)将少量NaOH溶液滴入醋酸溶液中,溶液中 的值变化趋势为___(填“增大”、“减小”或“不变”)。
(4)常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为___________。
17.(12分) 滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
I.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用NaOH固体配制0.1000mol/L的NaOH溶液240mL。
①本实验必须用到的仪器有天平、药匙、玻璃棒、胶头滴管、烧杯、_____。
②要完成本实验该同学应称出NaOH的质量为_____g。
(2)取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为_____;
②滴定时边滴边摇动锥形瓶,眼睛注视_____;
③三次实验数据记录如表所示:
滴定次数 滴定前碱式滴定管读数/mL 滴定后碱式滴定管读数/mL
1 1.00 30.95
2 2.03 29.23
3 0.56 30.61
根据表中数据计算出醋酸待测液的浓度为_____。(保留四位有效数字)
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_____(填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO 粗产品的纯度测定。
称取mg KIO 粗产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用标准溶液滴定至终点(),平均消耗标准溶液的体积为VmL。
(3)加入KI和稀H SO 后发生反应的离子方程式为_____。
(4)滴定终点的现象为_____,则产品中KIO3的质量分数为 %。
18.(10分)载人航天器中,可将航天员呼出的CO2转化为 H2O,再通过电解 H2O 获得 O2,实现 O2的再 生,同时还能制备 CH4。
已知: ①CO2(g)+4H2(g)=CH4(g)+2H2O(l) H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) H =+571.6kJ/mol 请回答下列问题:
(1)反应①属于_______ (填“吸热”或“放热”)反应。
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) H =_______ kJ/mol。
(3)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
化学键 H-H C=C C-C C-H
E(kJ/mol) 436 a 348 413
①已知2CH4(g)=C2H4(g)+2H2(g) ΔH =+167kJ/mol,则a=_______ 。
②已知5C2H4(g)+12 (aq)+36H+ (aq)=12Mn2+ (aq)+10CO2 (g)+28H2O(l) ΔH =-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为_______mol。
③制备合成气反应历程分两步,步骤Ⅰ:CH4(g) C(ads)+2H2(g);步骤Ⅱ:C(ads)+ CO2(g) 2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图
E4-E1表示步骤Ⅰ正反应的 _______,制备合成气反应可在_______ (填“高温” 或“低温”)下自发进行。
19.(12分)铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2 12H2O]的工艺流程如图所示:
请回答下列问题:
(1)固体a的化学式为_______。
(2)加快I的反应速率的措施有_______(任写两点即可)。
(3)写出II中加过量的烧碱涉及的反应离子方程式:_______ , 。
(4)由I中得到固体a的实验操作为_____,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_______、_______、过滤、洗涤。
(5)向铵明矾NH4Al(SO4)2中加氢氧化钡使硫酸根离子刚好完全沉淀的化学反应方程式为_______。
化学试题
考试时间:75分钟 总分100分
(相对原子质量K-39,I-127,O-16)
一、单选题(每小题3分,共42分)
1. 下列有关说法不正确的是( )
A. 固体与固体反应是吸热反应
B. 化学反应中的能量变化主要由化学键变化引起
C. 放热反应不需要加热就能发生,吸热反应不加热就不能发生
D. 节约能源不是简单减少能源的使用,更重要的是要充分有效地利用能源
2.下列各组物质依次属于非电解质、强电解质、弱电解质的是( )
A.稀盐酸、、 B.酒精、、
C.、烧碱、 D.、、
3. 下列热化学方程式及其有关叙述正确的( )
A.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g)ΔH=+285.8 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应,放出92.4 kJ的热量
D.已知乙炔的燃烧热为1 299.6 kJ·mol-1,则表示乙炔燃烧热的热化学方程式为C2H2(g)+O2(g)=2CO2(g)+H2O(l) ΔH=-1 299.6 kJ·mol-1
4. 25℃时,下列说法不正确的是( )
A. 0.10mol/L、0.010mol/L的醋酸的电离常数Ka相同
B. 中和pH和体积均相等的醋酸、HCl溶液,所需NaOH的物质的量前者多
C. 1L pH=8的CH3COONa溶液中,由水电离出总的H+的物质的量为
D. 同pH的盐酸、醋酸溶液,对水的抑制程度相等
5. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、、Cl-
B. 与Al反应能放出H2的溶液中:Fe2+、K+、、
C. =1×10-13mol/L的溶液中:、Ca2+、Cl-、
D. 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、、
6. 下列图示与对应的叙述不相符的是( )
A. (a)图可表示锌和稀硫酸反应过程中的能量变化
B. 通过(b)图可知石墨比金刚石稳定
C. 由(c)图可知,2SO2(g) SO2(g)+O2(g)
D. (d)图是某反应A→C的能量变化曲线图(E表示能量),反应中
7. 下列有关说法不正确的是( )
A. 25℃,用pH试纸测得某氯水的pH为5
B. 任何温度下,利用和浓度的相对大小均可判断溶液的酸碱性
C. 25℃,的NaOH溶液,由水电离出的
D. 的醋酸溶液与的盐酸等体积混合,混合液的
8. 下列事实不能用勒夏特列原理解释的是( )
A. Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
B. 把食品存放在冰箱里可延长保质期
C. 合成氨反应,为提高原料的转化率,理论上应采取降低温度的措施
D. 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
9. 实验室需要配制溶液,并用其滴定未知浓度的盐酸溶液,下列装置能达到相应实验目的的是( )
A.称量 B.溶解 C.定容 D.滴定过程
10. 为阿伏加德罗常数的值。下列说法正确的是( )
A. 溶液水解生成的胶体粒子数少于
B. 溶液中,数目为
C. 的原子总数为
D. 25℃,溶液由水电离出的为
11. 根据下列实验操作,其现象和结论均正确的是( )
选项 实验操作 现象 结论
A 向一密闭容器充入NO2,保持温度不变,扩大容器体积 容器中气体颜色先变浅后变深 平衡2NO2(g) N2O4(g)先正向移动再逆向移动
B 向2mL5%H2O2溶液中分别滴加5滴等浓度的FeCl3和KMnO4溶液 加入KMnO4溶液的反应更剧烈 KMnO4比FeCl3催化效果好
C 将充满NO2的密闭玻璃球浸泡在热水中 玻璃球中红棕色加深 反应2NO2(g) N2O4(g)的△H<0
D 在KSCN与FeCl3的混合液中再加入KCl固体 溶液红色变浅 增大生成物浓度,平衡逆向移动
12. 对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响,下列判断正确的是( )
A. 由图a可知,该反应的正反应为吸热反应
B. 由图b可知,该反应m+n
D. 图d中的a曲线一定是加入了催化剂
13. 在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L-1。下列判断不正确的是( )
A.x=1
B.A的转化率为40%
C.2 min内B的反应速率为0.1 mol·L-1·min-1
D.若混合气体的密度不变,则表明该反应已达到平衡状态
14. 25℃时,的两种碱溶液各10mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
A. 若,则NOH为强碱
B. 两种碱的物质的量浓度肯定不等
C. 均稀释100倍以后,MOH溶液中水的电离程度大于NOH溶液
D. 若两者均为弱碱,则,且NOH碱性强于MOH
二、填空题(共58分)
15. (14分)对SO2、NOx、CO2和CO进行回收利用是节能减排的重要课题。
某温度下,向恒容密闭容器中充入NO2、SO2发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是 (填序号)。
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是 (填字母)。
a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1molNO
(2)在体积为密闭容器中充入和,发生反应,测得、的物质的量随时间变化如图所示。
反应到达3min时, (填“>”“<”或“=”)。
0~5min内, 。
反应达到平衡状态时,的体积分数为 %(保留1位小数)。
④a、b、c三点中代表达到平衡的是 ,a点的正反应速率 (填>、<或=)b点的逆反应速率
16.(10分)食醋(约含3%~5%的CH3COOH)、纯碱(Na2CO3)和84消毒液(主要成分为NaClO)是生活中常见的化学用品,回答下列问题:
(1)醋酸(CH3COOH)属于__________电解质(填“强”、“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因___________。
(2)用离子方程式表示纯碱溶液呈碱性原因___________。
(3)将少量NaOH溶液滴入醋酸溶液中,溶液中 的值变化趋势为___(填“增大”、“减小”或“不变”)。
(4)常温下,pH=4的醋酸溶液与pH=10的纯碱溶液中,水电离出的c(OH-)之比为___________。
17.(12分) 滴定法是化学分析常用方法,是一种简便、快速和应用广泛的定量分析方法。
I.某实验小组用已知浓度的NaOH标准液来滴定未知浓度的醋酸溶液。
(1)实验室先用NaOH固体配制0.1000mol/L的NaOH溶液240mL。
①本实验必须用到的仪器有天平、药匙、玻璃棒、胶头滴管、烧杯、_____。
②要完成本实验该同学应称出NaOH的质量为_____g。
(2)取25.00mL待测液于250mL锥形瓶中,加入2~3滴指示剂,用0.1000mol/LNaOH标准溶液滴定至终点,按上述操作重复3次。回答下列问题。
①滴定过程中加入的指示剂为_____;
②滴定时边滴边摇动锥形瓶,眼睛注视_____;
③三次实验数据记录如表所示:
滴定次数 滴定前碱式滴定管读数/mL 滴定后碱式滴定管读数/mL
1 1.00 30.95
2 2.03 29.23
3 0.56 30.61
根据表中数据计算出醋酸待测液的浓度为_____。(保留四位有效数字)
④在上述实验过程中,出现下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有_____(填序号)。
a.量取标准液的碱式滴定管未用标准液润洗
b.取醋酸的酸式滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失
c.锥形瓶用蒸馏水洗涤后,水未倒尽,仍残留一定量水
d.当滴定结束时,俯视碱式滴定管读数
II.氧化还原滴定与酸碱中和滴定类似,可用于KIO 粗产品的纯度测定。
称取mg KIO 粗产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀硫酸,充分反应后加入淀粉溶液作指示剂,用标准溶液滴定至终点(),平均消耗标准溶液的体积为VmL。
(3)加入KI和稀H SO 后发生反应的离子方程式为_____。
(4)滴定终点的现象为_____,则产品中KIO3的质量分数为 %。
18.(10分)载人航天器中,可将航天员呼出的CO2转化为 H2O,再通过电解 H2O 获得 O2,实现 O2的再 生,同时还能制备 CH4。
已知: ①CO2(g)+4H2(g)=CH4(g)+2H2O(l) H =-252.9kJ/mol
②2H2O(l)=2H2(g)+O2(g) H =+571.6kJ/mol 请回答下列问题:
(1)反应①属于_______ (填“吸热”或“放热”)反应。
(2)反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) H =_______ kJ/mol。
(3)利用 CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如表:
化学键 H-H C=C C-C C-H
E(kJ/mol) 436 a 348 413
①已知2CH4(g)=C2H4(g)+2H2(g) ΔH =+167kJ/mol,则a=_______ 。
②已知5C2H4(g)+12 (aq)+36H+ (aq)=12Mn2+ (aq)+10CO2 (g)+28H2O(l) ΔH =-m kJ·mol-1,当放出的热量为m kJ时,该反应转移电子的物质的量为_______mol。
③制备合成气反应历程分两步,步骤Ⅰ:CH4(g) C(ads)+2H2(g);步骤Ⅱ:C(ads)+ CO2(g) 2CO(g)。上述反应中 C(ads)为吸附性活性炭,反应历程的能量变化如图
E4-E1表示步骤Ⅰ正反应的 _______,制备合成气反应可在_______ (填“高温” 或“低温”)下自发进行。
19.(12分)铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2 12H2O]的工艺流程如图所示:
请回答下列问题:
(1)固体a的化学式为_______。
(2)加快I的反应速率的措施有_______(任写两点即可)。
(3)写出II中加过量的烧碱涉及的反应离子方程式:_______ , 。
(4)由I中得到固体a的实验操作为_____,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)_______、_______、过滤、洗涤。
(5)向铵明矾NH4Al(SO4)2中加氢氧化钡使硫酸根离子刚好完全沉淀的化学反应方程式为_______。
同课章节目录
