黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题(含答案)
文档属性
| 名称 | 黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 999.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 00:00:00 | ||
图片预览


文档简介
龙西北名校联合体2023-2024学年高三上学期期中考试
化学试题
考试时间:75分钟 试卷总分:100分
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。将条形码横贴在答题卡右上角“条形码粘贴处”..
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题答案必须写在答题卡各题目指定区域内相应位置上:如需改动,先划掉原来的答案,然后再写上新的答案:不准使用铅笔、修正带和涂改液,不按以上要求作答的答案无效。写在试卷上无效。
4.考生必须保持答题卡的整洁。答题卡不要折叠。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Co 59 Cu 64
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.北京冬奥会被称为“绿色冬奥”“科技冬奥”,下列关于冬奥会所使用高科技的说法中正确的是( )
A.使用了碲化镉发电玻璃,碲元素位于元素周期表中的第四周期第VA族
B.颁奖礼服内胆里添加的导热系数高的柔性石墨烯发热材料属于新型无机非金属材料
C.应用了跨临界制冷制冰技术,的形成过程可表示为:
D.使用了氢能大巴,氢气的同素异形体有H、D、T
2.南海是一个巨大的资源宝库,海水开发利用的部分过程如图所示,下列说法错误的是( )
A.物质X可以选用CaO
B.操作Ⅰ中玻璃棒的作用是引流
C.第①步中,蒸发结晶、高温烘干可以得到干燥的固体
D.第②步反应的离子方程式为:
3.下列离子方程式书写正确的是( )
A.氧化铁溶于氢碘酸:
B.向含0.2mol 的溶液中通入0.15mol :
C.向溶液中加入含等物质的量溶质的溶液:
D.碳酸氢钠溶液与少量石灰水反应:
4.是一种食品添加剂,但食用过量可能致癌。酸性溶液与反应的离子方程式为(未配平)。下列叙述中正确的是( )
A.该反应中被还原
B.反应过程中溶液的pH减小
C.生成1mol 需消耗0.4mol
D.中的粒子是
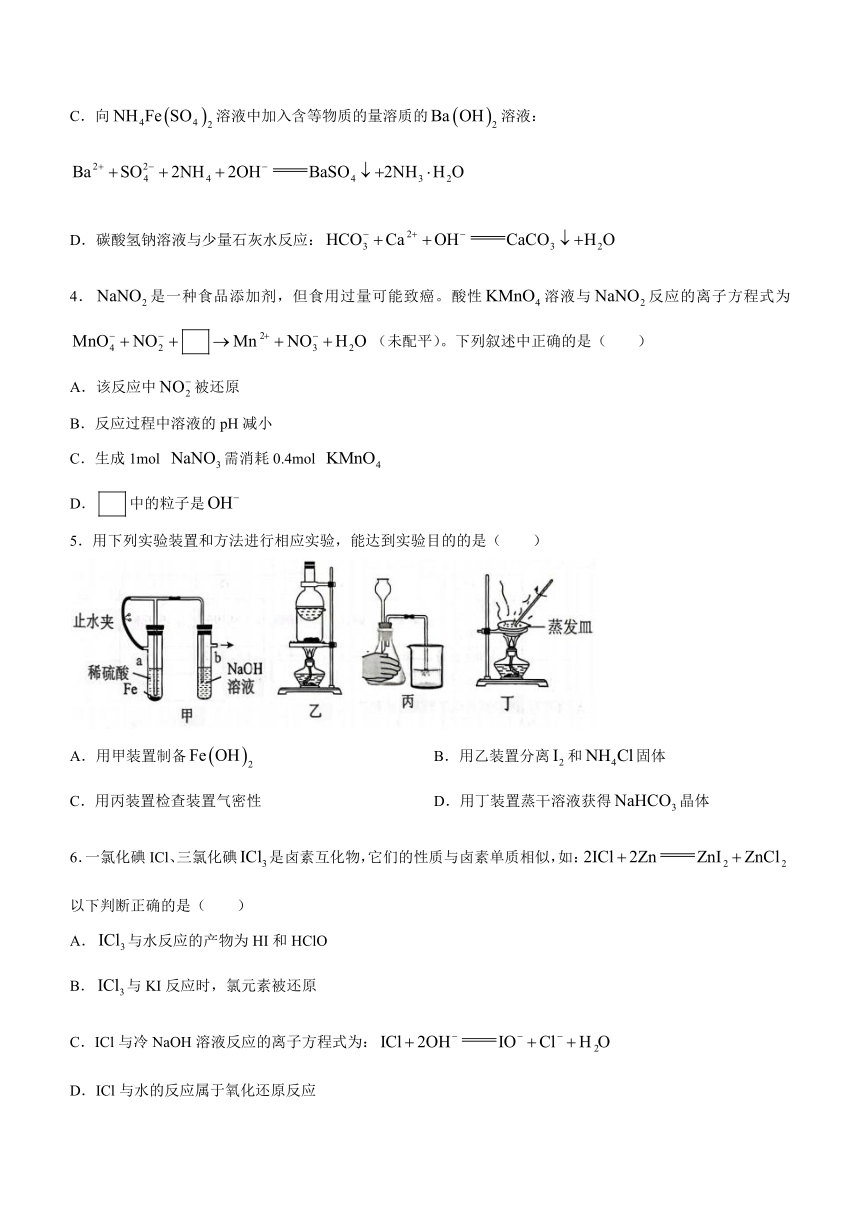
5.用下列实验装置和方法进行相应实验,能达到实验目的的是( )
A.用甲装置制备 B.用乙装置分离和固体
C.用丙装置检查装置气密性 D.用丁装置蒸干溶液获得晶体
6.一氯化碘ICl、三氯化碘是卤素互化物,它们的性质与卤素单质相似,如:以下判断正确的是( )
A.与水反应的产物为HI和HClO
B.与KI反应时,氯元素被还原
C.ICl与冷NaOH溶液反应的离子方程式为:
D.ICl与水的反应属于氧化还原反应
7.下列离子组中加(或通)入相应试剂后,判断和分析均正确的是( )
选项 离子组 加(或通)入试剂 判断和分析
A 、、、 足量 能大量共存
B 、、、 足量NaOH溶液 不能大量共存,只发生下列反应
C 、、、 足量溶液 不能大量共存,因和之间会发生完全双水解生成气体和沉淀
D 、、、 少量 不能大量共存,只发生下列反应
8.根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
元素代号 A B C D E
原子半径/nm 0.186 0.143 0.089 0.104 0.074
主要化合价 +1 +3 +2 +6、-2 -2
A.与的核外电子数不可能相等 B.离子半径:
C.最高价氧化物对应水化物的碱性:AE
9.下列物质既能与盐酸反应,又能与NaOH溶液反应的是( )
① ②Al ③ ④MgO ⑤ ⑥ ⑦ ⑧
A.②③④⑥⑦ B.①②③⑥⑦⑧ C.②③④⑤⑥⑦ D.②③⑥⑦⑧
10.某工厂采用如下工艺制备,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是( )
A.“焙烧”中产生 B.滤渣的主要成分为
C.滤液①中Cr元素的主要存在形式为 D.淀粉水解液中的葡萄糖起还原作用
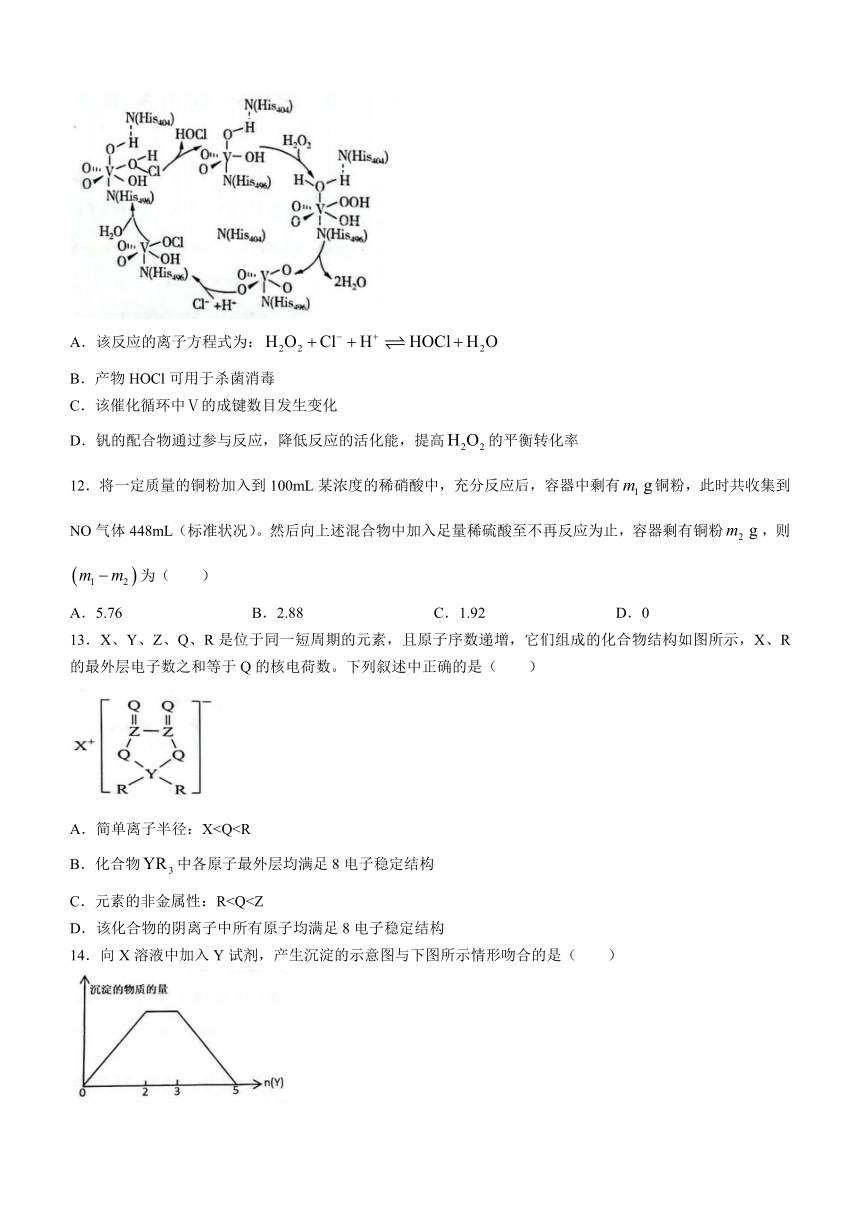
11.钒的配合物催化某可逆反应的一种反应机理如图所示。下列说法错误的是( )
A.该反应的离子方程式为:
B.产物HOCl可用于杀菌消毒
C.该催化循环中Ⅴ的成键数目发生变化
D.钒的配合物通过参与反应,降低反应的活化能,提高的平衡转化率
12.将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉,则为( )
A.5.76 B.2.88 C.1.92 D.0
13.X、Y、Z、Q、R是位于同一短周期的元素,且原子序数递增,它们组成的化合物结构如图所示,X、R的最外层电子数之和等于Q的核电荷数。下列叙述中正确的是( )
A.简单离子半径:XB.化合物中各原子最外层均满足8电子稳定结构
C.元素的非金属性:RD.该化合物的阴离子中所有原子均满足8电子稳定结构
14.向X溶液中加入Y试剂,产生沉淀的示意图与下图所示情形吻合的是( )
A.向和的混合溶液中滴加NaOH B.向HCl和的混合溶液中滴加NaOH
C.向向溶液中滴加NaOH D.向NaOH和的混合溶液中通入
15.部分氧化的Fe-Cu合金样品(氧化产物为、CuO)共5.76g,经如下处理:
下列说法不正确的是( )
A.滤液A中的阳离子为、 B.样品中铁元素的质量为2.24g
C.样品中CuO的质量为4.0g D.V=448mL
二、非选择题(本题包括4小题,共55分)
16.(15分)钴是生产多种合金和钴盐的重要原料,水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:
已知:①;
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
沉淀物
开始沉淀时的pH 7.0 2.7 7.6 7.7 4.0
沉淀完全时的pH 9.6 3.7 9.2 9.8 5.2
请回答下列问题:
(1)CoOOH中Co的化合价为_____,溶液的作用是______,请写出“还原酸浸”中发生的主要氧化还原反应的化学方程式:______。
(2)浸出过程中加入溶液调pH的范围是______≤pH<______
(3)当加入过量NaF后,所得滤液Ⅱ中与之比为______。
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是______,其使用的最佳pH范围是______(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是______。
17.(14分)实验室模拟拉希法用氨和次氯酸钠反应制备腓(),并探究肼的性质。制备装置如下图所示。
回答下列问题:
(1)肼的电子式为______。
(2)装置A试管中的化学反应方程式为______。仪器a的作用是______,仪器b的名称是______。
(3)装置B中氨和次氯酸钠制备肼的化学反应方程式为______。
(4)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是______。
(5)①已知是一种二元弱碱,在水中的电离与相似,请写出肼第二步电离的电离方程式:______。
②测定产品中肼的质量分数。
称取装置B中溶液m g,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点平均消耗标准溶液V mL,产品中肼质量分数的表达式为_______。
18.(16分)有a、b、c、d、e,f、g七种元素,原子序数依次增大,前5种为短周期主族元素,f、g为第四周期的元素。有关信息如下,请回答以下问题:
a a能形成一种硬度最大的固体单质
c c元素基态原子的电子排布式为
d 基态d原子的、、、
e 基态e原子核外3p轨道半满
f f在周期表中第11纵列
g 基态g原子最外层电子数为2
(1)a元素位于元素周期表的______分区。
(2)e的基态原子中能量最高的电子所占的轨道形状是______,其电子云在空间有______个伸展方向。
(3)基态d原子的价层电子的轨道表示式为一,某X元素在元素周期表中位置处于d元素的左上角对角线处,它们具有部分相似的性质,请写出该X元素组成的单质与氢氧化钠溶液反应的化学反应方程式______。
(4)b、c两种元素基态原子的第一电离能由大到小的顺序为______(用元素符号表示)。
(5)基态g原子的简化电子排布式为______。
(6)基态f原子的第二电离能______基态g原子的第二电离能(填“>”、“<”或“=”)。
19.(10分)某工厂采用如下工艺处理镍钴矿硫酸浸取液(含、、、、和)。实现镍、钴、镁元素的回收。
已知:
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(),1mol 中过氧键的物质的量为______。
(3)“氧化”中,用石灰乳调节pH=4,被氧化为,该反应的离子方程式为______(的电离第一步完全,第二步微弱)。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅰ)氧化率与时间的关系如下。体积分数为______时,Mn(Ⅱ)氧化速率最大;继续增大体积分数时,Mn(Ⅰ)氧化速率减小的原因是______。
龙西北名校联合体2023-2024学年高三上学期期中考试
化学答案
1-15 BCBCA CABDB DADDC
16.(共15分,除了标注,其余空每个空2分)
(1)+3价(或正三价)(1分) 还原CoOOH(三价Co)成
(2)5.(1分) 7.6(1分) (3)2 (4)除去溶液中的 B (5)
17.(共14分,除了标注,其余空每个空2分)
(1)
(2) 防止倒吸(1分) 恒压滴液漏斗(1分)
(3)
(4)在装置B、C之间加装盛有饱和食盐水的洗气瓶
(5)
18.(共16分,每个空2分)
(1)p (2)哑铃形 3
(3)
(4)N>O (5) (6)>
19.(共10分,每个空2分)
(1)适当增大硫酸浓度或适当升高温度或将镍钴矿粉碎增大接触面积
(2)1mol
(3)
(4)9.0% 有还原性,过多将会降低的浓度,降低Mn(Ⅱ)氧化速率
化学试题
考试时间:75分钟 试卷总分:100分
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。将条形码横贴在答题卡右上角“条形码粘贴处”..
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题答案必须写在答题卡各题目指定区域内相应位置上:如需改动,先划掉原来的答案,然后再写上新的答案:不准使用铅笔、修正带和涂改液,不按以上要求作答的答案无效。写在试卷上无效。
4.考生必须保持答题卡的整洁。答题卡不要折叠。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Co 59 Cu 64
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.北京冬奥会被称为“绿色冬奥”“科技冬奥”,下列关于冬奥会所使用高科技的说法中正确的是( )
A.使用了碲化镉发电玻璃,碲元素位于元素周期表中的第四周期第VA族
B.颁奖礼服内胆里添加的导热系数高的柔性石墨烯发热材料属于新型无机非金属材料
C.应用了跨临界制冷制冰技术,的形成过程可表示为:
D.使用了氢能大巴,氢气的同素异形体有H、D、T
2.南海是一个巨大的资源宝库,海水开发利用的部分过程如图所示,下列说法错误的是( )
A.物质X可以选用CaO
B.操作Ⅰ中玻璃棒的作用是引流
C.第①步中,蒸发结晶、高温烘干可以得到干燥的固体
D.第②步反应的离子方程式为:
3.下列离子方程式书写正确的是( )
A.氧化铁溶于氢碘酸:
B.向含0.2mol 的溶液中通入0.15mol :
C.向溶液中加入含等物质的量溶质的溶液:
D.碳酸氢钠溶液与少量石灰水反应:
4.是一种食品添加剂,但食用过量可能致癌。酸性溶液与反应的离子方程式为(未配平)。下列叙述中正确的是( )
A.该反应中被还原
B.反应过程中溶液的pH减小
C.生成1mol 需消耗0.4mol
D.中的粒子是
5.用下列实验装置和方法进行相应实验,能达到实验目的的是( )
A.用甲装置制备 B.用乙装置分离和固体
C.用丙装置检查装置气密性 D.用丁装置蒸干溶液获得晶体
6.一氯化碘ICl、三氯化碘是卤素互化物,它们的性质与卤素单质相似,如:以下判断正确的是( )
A.与水反应的产物为HI和HClO
B.与KI反应时,氯元素被还原
C.ICl与冷NaOH溶液反应的离子方程式为:
D.ICl与水的反应属于氧化还原反应
7.下列离子组中加(或通)入相应试剂后,判断和分析均正确的是( )
选项 离子组 加(或通)入试剂 判断和分析
A 、、、 足量 能大量共存
B 、、、 足量NaOH溶液 不能大量共存,只发生下列反应
C 、、、 足量溶液 不能大量共存,因和之间会发生完全双水解生成气体和沉淀
D 、、、 少量 不能大量共存,只发生下列反应
8.根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
元素代号 A B C D E
原子半径/nm 0.186 0.143 0.089 0.104 0.074
主要化合价 +1 +3 +2 +6、-2 -2
A.与的核外电子数不可能相等 B.离子半径:
C.最高价氧化物对应水化物的碱性:A
9.下列物质既能与盐酸反应,又能与NaOH溶液反应的是( )
① ②Al ③ ④MgO ⑤ ⑥ ⑦ ⑧
A.②③④⑥⑦ B.①②③⑥⑦⑧ C.②③④⑤⑥⑦ D.②③⑥⑦⑧
10.某工厂采用如下工艺制备,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是( )
A.“焙烧”中产生 B.滤渣的主要成分为
C.滤液①中Cr元素的主要存在形式为 D.淀粉水解液中的葡萄糖起还原作用
11.钒的配合物催化某可逆反应的一种反应机理如图所示。下列说法错误的是( )
A.该反应的离子方程式为:
B.产物HOCl可用于杀菌消毒
C.该催化循环中Ⅴ的成键数目发生变化
D.钒的配合物通过参与反应,降低反应的活化能,提高的平衡转化率
12.将一定质量的铜粉加入到100mL某浓度的稀硝酸中,充分反应后,容器中剩有铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉,则为( )
A.5.76 B.2.88 C.1.92 D.0
13.X、Y、Z、Q、R是位于同一短周期的元素,且原子序数递增,它们组成的化合物结构如图所示,X、R的最外层电子数之和等于Q的核电荷数。下列叙述中正确的是( )
A.简单离子半径:X
C.元素的非金属性:R
14.向X溶液中加入Y试剂,产生沉淀的示意图与下图所示情形吻合的是( )
A.向和的混合溶液中滴加NaOH B.向HCl和的混合溶液中滴加NaOH
C.向向溶液中滴加NaOH D.向NaOH和的混合溶液中通入
15.部分氧化的Fe-Cu合金样品(氧化产物为、CuO)共5.76g,经如下处理:
下列说法不正确的是( )
A.滤液A中的阳离子为、 B.样品中铁元素的质量为2.24g
C.样品中CuO的质量为4.0g D.V=448mL
二、非选择题(本题包括4小题,共55分)
16.(15分)钴是生产多种合金和钴盐的重要原料,水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:
已知:①;
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
沉淀物
开始沉淀时的pH 7.0 2.7 7.6 7.7 4.0
沉淀完全时的pH 9.6 3.7 9.2 9.8 5.2
请回答下列问题:
(1)CoOOH中Co的化合价为_____,溶液的作用是______,请写出“还原酸浸”中发生的主要氧化还原反应的化学方程式:______。
(2)浸出过程中加入溶液调pH的范围是______≤pH<______
(3)当加入过量NaF后,所得滤液Ⅱ中与之比为______。
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是______,其使用的最佳pH范围是______(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是______。
17.(14分)实验室模拟拉希法用氨和次氯酸钠反应制备腓(),并探究肼的性质。制备装置如下图所示。
回答下列问题:
(1)肼的电子式为______。
(2)装置A试管中的化学反应方程式为______。仪器a的作用是______,仪器b的名称是______。
(3)装置B中氨和次氯酸钠制备肼的化学反应方程式为______。
(4)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是______。
(5)①已知是一种二元弱碱,在水中的电离与相似,请写出肼第二步电离的电离方程式:______。
②测定产品中肼的质量分数。
称取装置B中溶液m g,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴指示剂,用的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点平均消耗标准溶液V mL,产品中肼质量分数的表达式为_______。
18.(16分)有a、b、c、d、e,f、g七种元素,原子序数依次增大,前5种为短周期主族元素,f、g为第四周期的元素。有关信息如下,请回答以下问题:
a a能形成一种硬度最大的固体单质
c c元素基态原子的电子排布式为
d 基态d原子的、、、
e 基态e原子核外3p轨道半满
f f在周期表中第11纵列
g 基态g原子最外层电子数为2
(1)a元素位于元素周期表的______分区。
(2)e的基态原子中能量最高的电子所占的轨道形状是______,其电子云在空间有______个伸展方向。
(3)基态d原子的价层电子的轨道表示式为一,某X元素在元素周期表中位置处于d元素的左上角对角线处,它们具有部分相似的性质,请写出该X元素组成的单质与氢氧化钠溶液反应的化学反应方程式______。
(4)b、c两种元素基态原子的第一电离能由大到小的顺序为______(用元素符号表示)。
(5)基态g原子的简化电子排布式为______。
(6)基态f原子的第二电离能______基态g原子的第二电离能(填“>”、“<”或“=”)。
19.(10分)某工厂采用如下工艺处理镍钴矿硫酸浸取液(含、、、、和)。实现镍、钴、镁元素的回收。
已知:
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(),1mol 中过氧键的物质的量为______。
(3)“氧化”中,用石灰乳调节pH=4,被氧化为,该反应的离子方程式为______(的电离第一步完全,第二步微弱)。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅰ)氧化率与时间的关系如下。体积分数为______时,Mn(Ⅱ)氧化速率最大;继续增大体积分数时,Mn(Ⅰ)氧化速率减小的原因是______。
龙西北名校联合体2023-2024学年高三上学期期中考试
化学答案
1-15 BCBCA CABDB DADDC
16.(共15分,除了标注,其余空每个空2分)
(1)+3价(或正三价)(1分) 还原CoOOH(三价Co)成
(2)5.(1分) 7.6(1分) (3)2 (4)除去溶液中的 B (5)
17.(共14分,除了标注,其余空每个空2分)
(1)
(2) 防止倒吸(1分) 恒压滴液漏斗(1分)
(3)
(4)在装置B、C之间加装盛有饱和食盐水的洗气瓶
(5)
18.(共16分,每个空2分)
(1)p (2)哑铃形 3
(3)
(4)N>O (5) (6)>
19.(共10分,每个空2分)
(1)适当增大硫酸浓度或适当升高温度或将镍钴矿粉碎增大接触面积
(2)1mol
(3)
(4)9.0% 有还原性,过多将会降低的浓度,降低Mn(Ⅱ)氧化速率
同课章节目录
