陕西省渭南市韩城市2023-2024学年高二上学期期中质量检测化学试题(含答案)
文档属性
| 名称 | 陕西省渭南市韩城市2023-2024学年高二上学期期中质量检测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 624.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 12:22:14 | ||
图片预览



文档简介
韩城市2023-2024学年高二上学期期中质量检测
化学
(满分:100分考试时间:75分钟)
注意事项:
1.本试题分为选择题和非选择题两部分。选择题用2B铅笔将答案涂在答题卡相应的位置;非选择题,用0.5mm黑色签字笔将答案写在答题卡规定的区域内。
2.答卷时,先将答题卡首有关项目填写清楚。
可能用到的原子量:C-12 N-14 O-16
一、选择题(共20小题,每题2.5分,共计50分,每小题只有一个正确选项符合题意。)
1.热化学方程式中,物质的化学计量数代表的意义是( )
A.体积 B.物质的量 C.浓度 D.个数
2.对于可逆反应: ,下列说法正确的是( )
A.平衡移动,反应的平衡常数必改变 B.增大压强平衡必移动
C.升高温度平衡必移动 D.加入催化剂平衡必移动
3.在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末
A.①②③ B.①②④ C.①③④ D.①②③④
4.下列有关叙述错误的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍 B.用铝质铆钉焊接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀 D.温度对化学腐蚀的影响很大
5.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.电解饱和食盐水时,阳极的电极反应为
B.氢氧燃料电池的正极反应:
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为
D.钢铁发生电化学腐蚀的负极反应:
6.氢气和氧气发生反应的过程用如下模型表示(“-”表示化学键),下列说法正确的是( )
A.过程Ⅰ是放热过程 B.过程Ⅲ一定是吸热过程
C.a的总能量大于d的总能量 D.该反应的能量转化形式只能以热能的形式进行
7.下列反应属于吸热反应的是( )
A.高温时碳与的反应 B.高温时Al与的反应
C.加热时铁粉与硫粉的反应 D.铝粉与稀硫酸的反应
8.下列与电池相关的说法不正确的是( )
A.电池的使用可有效减少碳的排放
B.新能源电车在充电时实现的是化学能→电能→机械能的转化
C.锂金属电池具有极高的比能量,可大幅提高电动汽车的续航里程
D.电池废弃后,需专业化处理其含有的各种重金属有害物质
9.合成氨工业中采用循环操作,主要原因是( )
A.降低氨的沸点 B.提高氮气和氢气的利用率
C.增大化学反应速率 D.提高平衡混合物中氨的含量
10.在不同条件下进行反应,生成氨的反应速率最快的是( )
A. B.
C. D.
11.某反应的反应机理、能量与反应进程的关系如图所示,下列说法正确的是( )
A.Ⅰ是该反应的催化剂
B.第一反应、第二步反应,和总反应都是放热反应
C.第一步反应决定总反应的速率
D.在第一步反应中作还原剂
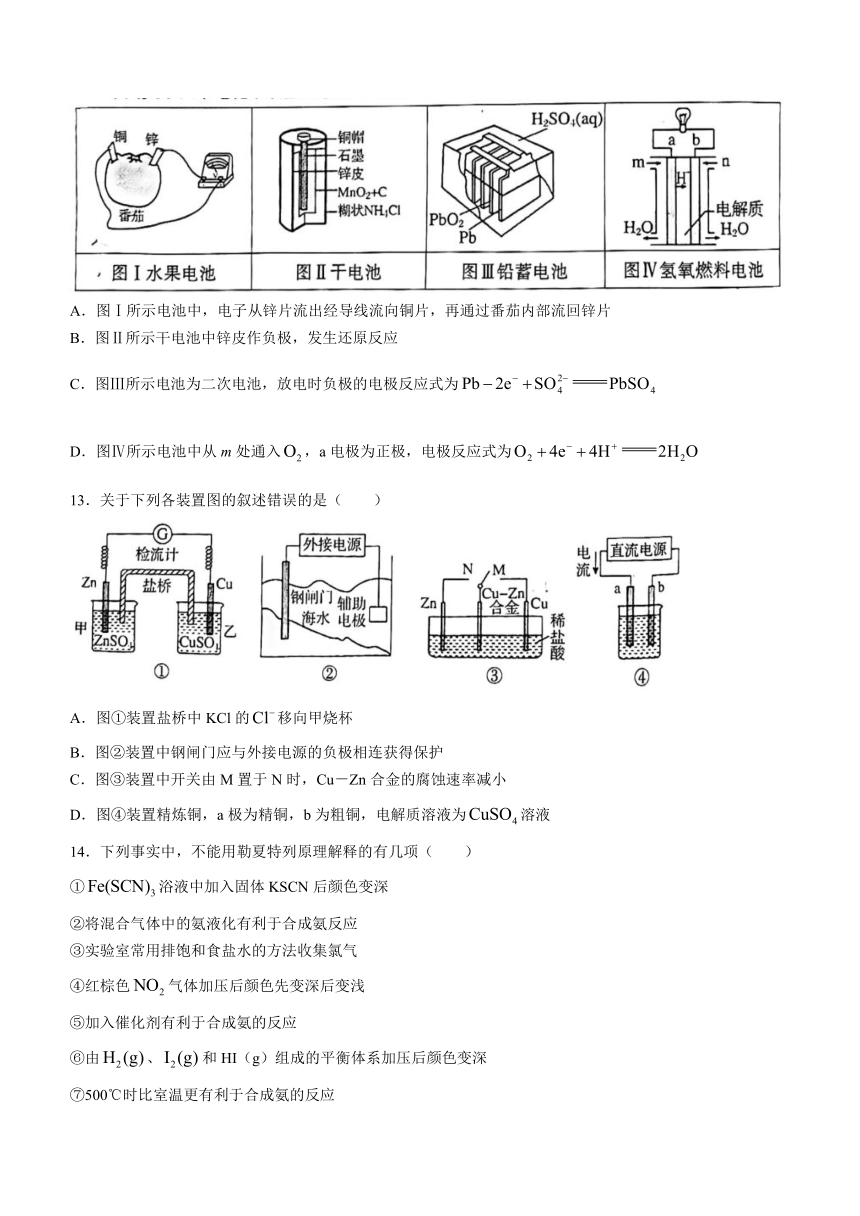
12.下列关于四个电化学装置的叙述正确的是( )
A.图Ⅰ所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片
B.图Ⅱ所示干电池中锌皮作负极,发生还原反应
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为
D.图Ⅳ所示电池中从m处通入,a电极为正极,电极反应式为
13.关于下列各装置图的叙述错误的是( )
A.图①装置盐桥中KCl的移向甲烧杯
B.图②装置中钢闸门应与外接电源的负极相连获得保护
C.图③装置中开关由M置于N时,Cu-Zn合金的腐蚀速率减小
D.图④装置精炼铜,a极为精铜,b为粗铜,电解质溶液为溶液
14.下列事实中,不能用勒夏特列原理解释的有几项( )
①浴液中加入固体KSCN后颜色变深
②将混合气体中的氨液化有利于合成氨反应
③实验室常用排饱和食盐水的方法收集氯气
④红棕色气体加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥由、和HI(g)组成的平衡体系加压后颜色变深
⑦500℃时比室温更有利于合成氨的反应
A.三项 B.四项 C.五项 D.六项
15.利用醋酸二氨合铜溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为。已知该反应的化学平衡常数与温度的关系如表所示,下列说法正确的是( )
温度/℃ 15 50 100
化学平衡常数数值 2
A.上述正反应为吸热反应
B.15℃时,的平衡常数值为
C.保持其他条件不变,减小压强,CO的转化率减小,化学平衡常数减小
D.醋酸二氨合铜溶液的浓度的改变使化学平衡常数也改变
16.下列有关化学反应速率的说法中,正确的是( )
A.100mL 1mo/L的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.合成氨的反应是一个放热反应,所以升高温度,反应速率减慢
C.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
D.汽车尾气中的CO和NO可以缓慢反应生成和,减小压强,反应速率减慢
17.结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压条件下测定)( )
选项 已知条件 热化学方程式
A 的燃烧热数值为a kJ/mol
B 与足量充分反应后,放出热量
C
D 31g白磷比31g红磷能量多b kJ ,
A.A B.B C.C D.D
18.下列有关说法正确的是( )
A.,恒温恒压下再通入少量,容器中气体密度增大
B.,室温下不能自发进行,说明该反应的
C.,压缩容器使体积减小,达到新平衡后浓度增大
D.,恒容绝热下,当压强不变时可以判定反应达到平衡
19.利用如图装置溶解铁矿石中的,下列说法正确的是( )
A.X为阳离子交换膜,Y为阴离子交换膜
B.通电一段时间后,溶液浓度变小
C.电极发生的电极反应为
D.当溶解时,至少产生气体(标准状况下,不考虑气体溶解)
20.汽车尾气中含有CO、NO等有害气体,两者在恒容密闭容器中能发生反应:,为了验证温度对该反应速率的影响,某同学设计了两组实验,如表所示。已知280℃的情况下,反应后达到平衡,测得的浓度为。下列说法不正确的是( )
实验编号 的初始浓度/() 的初始浓度
Ⅰ 280
Ⅱ 350
A.表中的数值应为
B.当,说明该反应已达到平衡状态
C.280℃时,前2min内,用表示的平均反应速率为
D.280℃的情况下达到平衡时的浓度为
二、非选择题(共4个小题,共50分)
21.(16分)某化学兴趣小组用盐酸与溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是____________;不能用铜质搅拌器代替玻璃搅拌器的理由是__________________。
(2)NaOH溶液稍过量的原因是________________________。
(3)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为,中和反应后溶液的比热容)
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.3
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,该实验测得反应放出的热量为______J。
(4)下列操作会导致实验结果出现偏差的是______(填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将氢氧化钠溶液取成了氢氧化钾溶液
d.做本实验的当天室温较高
(5)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热()______(填“偏大”、“偏小”或“不变”)。
(6)如果用盐酸与溶液进行实验,与上述实验相比,二者所放出的热量______(填“相等”或“不相等”,下同),所求的中和反应反应热()______
22.(12分)下图中的左边装置表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请用下图所示各仪器设计一个包括:以惰性电极电解饱和食盐水,测定电解时产生的的体积并检验的氧化性的实验装置。
(1)此电解反应的离子方程式为_____________________________。
(2)所选仪器连接时,各接口的顺序是(填各接口的字母代号):A接______,______接______;B接______,______接______。
(3)电解一段时间后,用丁测得气体体积为560mL(标准状况下),此时溶液的体积为500mL,不考虑与NaOH的反应,则溶液中NaOH的物质的量浓度是______,需加入______(填物质名称)可使溶液复原。
23.(8分)(1)实验一:已知。在酸性高锰酸钾溶液与草酸()溶液反应时,发现开始一段时间,反应速度较快,溶液褪色不明显,但不久突然褪色,反应速度明显加快。
①针对上述实验现象,小组同学认为与反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你认为还可能是______的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要的试剂最合理的是______(填字母)。
A.硫酸钾 B.硫酸镍 C.二氧化锰 D.水
(2)实验二:探究和混合时生成和的反应存在一定的限度。
Ⅰ、向溶液中滴加滴溶液,充分反应后,将所得溶液分成甲、乙两等份;
Ⅱ、向甲中滴加,充分振荡;
Ⅲ、向乙中滴加试剂X。
请回答下列问题:
(1)步骤Ⅲ中,试剂X是______;
(2)步骤Ⅱ和Ⅲ中的实验现象说明和混合时生成和的反应存在一定的限度,该实验现象是______________________________________。
24.(14分)一定条件下,在恒容密闭容器中发生反应:。开始时加入,在末测得的物质的量是。
(1)在末,______。
(2)若改变下列一个条件,推测反应速率发生的变化,用“增大”、“减小”或“不变”来回答下列问题。
①将容器的体积变为,化学反应速率______。
②加入少量的碳,化学反应速率______。
③升高温度,化学反应速率______。
(3)在不改变反应条件的情况下,通过实验监测发现在2min~7min内和的物质的量浓度的变化曲线如图所示。
①a=______(保留两位有效数字);
②由图可知7min时达平衡,此时混合气体的平均相对分子质量为______(保留三位有效数字),该反应的平衡常数K=______mol/L。
高二化学答案
一.选择题(共20小题,每题2.5分,共计50分,每小题只有一个正确选项符合题意。)
1B 2C 3D 4B
5A 6C 7A 8B
9B 10A 11C 12C
13D 14A 15B 16D
17D 18D 19C 20C
二、非选择题(共4个小题,共50分)
21.(16分)(1)上下匀速搅动 Cu是热的良导体,传热快,热量损失大
(2)D (3)1337.6 (4)ab (5)偏小
(6)不相等 相等
22.(12分)(除标注外,每空2分)
(1)
(2)G、F、H;D、E、C(各1分) (3)0.1 氯化氢
23.(8分)(1)①生成的对反应有催化作用(2分) ②B(2分)
(2)①KSCN溶液(2分)
②Ⅱ中可观察到溶液分层,下层呈现紫红色,Ⅲ中可观察到溶液变红(2分)
24.(14分)
(1)0.6(2分) (2)①减小(2分) ②不变(2分) ③增大(2分)
(3)①0.33(2分) ②39.7(2分) 6.4(2分)
化学
(满分:100分考试时间:75分钟)
注意事项:
1.本试题分为选择题和非选择题两部分。选择题用2B铅笔将答案涂在答题卡相应的位置;非选择题,用0.5mm黑色签字笔将答案写在答题卡规定的区域内。
2.答卷时,先将答题卡首有关项目填写清楚。
可能用到的原子量:C-12 N-14 O-16
一、选择题(共20小题,每题2.5分,共计50分,每小题只有一个正确选项符合题意。)
1.热化学方程式中,物质的化学计量数代表的意义是( )
A.体积 B.物质的量 C.浓度 D.个数
2.对于可逆反应: ,下列说法正确的是( )
A.平衡移动,反应的平衡常数必改变 B.增大压强平衡必移动
C.升高温度平衡必移动 D.加入催化剂平衡必移动
3.在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末
A.①②③ B.①②④ C.①③④ D.①②③④
4.下列有关叙述错误的是( )
A.金属的电化学腐蚀比化学腐蚀更普遍 B.用铝质铆钉焊接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀 D.温度对化学腐蚀的影响很大
5.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.电解饱和食盐水时,阳极的电极反应为
B.氢氧燃料电池的正极反应:
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为
D.钢铁发生电化学腐蚀的负极反应:
6.氢气和氧气发生反应的过程用如下模型表示(“-”表示化学键),下列说法正确的是( )
A.过程Ⅰ是放热过程 B.过程Ⅲ一定是吸热过程
C.a的总能量大于d的总能量 D.该反应的能量转化形式只能以热能的形式进行
7.下列反应属于吸热反应的是( )
A.高温时碳与的反应 B.高温时Al与的反应
C.加热时铁粉与硫粉的反应 D.铝粉与稀硫酸的反应
8.下列与电池相关的说法不正确的是( )
A.电池的使用可有效减少碳的排放
B.新能源电车在充电时实现的是化学能→电能→机械能的转化
C.锂金属电池具有极高的比能量,可大幅提高电动汽车的续航里程
D.电池废弃后,需专业化处理其含有的各种重金属有害物质
9.合成氨工业中采用循环操作,主要原因是( )
A.降低氨的沸点 B.提高氮气和氢气的利用率
C.增大化学反应速率 D.提高平衡混合物中氨的含量
10.在不同条件下进行反应,生成氨的反应速率最快的是( )
A. B.
C. D.
11.某反应的反应机理、能量与反应进程的关系如图所示,下列说法正确的是( )
A.Ⅰ是该反应的催化剂
B.第一反应、第二步反应,和总反应都是放热反应
C.第一步反应决定总反应的速率
D.在第一步反应中作还原剂
12.下列关于四个电化学装置的叙述正确的是( )
A.图Ⅰ所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片
B.图Ⅱ所示干电池中锌皮作负极,发生还原反应
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为
D.图Ⅳ所示电池中从m处通入,a电极为正极,电极反应式为
13.关于下列各装置图的叙述错误的是( )
A.图①装置盐桥中KCl的移向甲烧杯
B.图②装置中钢闸门应与外接电源的负极相连获得保护
C.图③装置中开关由M置于N时,Cu-Zn合金的腐蚀速率减小
D.图④装置精炼铜,a极为精铜,b为粗铜,电解质溶液为溶液
14.下列事实中,不能用勒夏特列原理解释的有几项( )
①浴液中加入固体KSCN后颜色变深
②将混合气体中的氨液化有利于合成氨反应
③实验室常用排饱和食盐水的方法收集氯气
④红棕色气体加压后颜色先变深后变浅
⑤加入催化剂有利于合成氨的反应
⑥由、和HI(g)组成的平衡体系加压后颜色变深
⑦500℃时比室温更有利于合成氨的反应
A.三项 B.四项 C.五项 D.六项
15.利用醋酸二氨合铜溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为。已知该反应的化学平衡常数与温度的关系如表所示,下列说法正确的是( )
温度/℃ 15 50 100
化学平衡常数数值 2
A.上述正反应为吸热反应
B.15℃时,的平衡常数值为
C.保持其他条件不变,减小压强,CO的转化率减小,化学平衡常数减小
D.醋酸二氨合铜溶液的浓度的改变使化学平衡常数也改变
16.下列有关化学反应速率的说法中,正确的是( )
A.100mL 1mo/L的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.合成氨的反应是一个放热反应,所以升高温度,反应速率减慢
C.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
D.汽车尾气中的CO和NO可以缓慢反应生成和,减小压强,反应速率减慢
17.结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压条件下测定)( )
选项 已知条件 热化学方程式
A 的燃烧热数值为a kJ/mol
B 与足量充分反应后,放出热量
C
D 31g白磷比31g红磷能量多b kJ ,
A.A B.B C.C D.D
18.下列有关说法正确的是( )
A.,恒温恒压下再通入少量,容器中气体密度增大
B.,室温下不能自发进行,说明该反应的
C.,压缩容器使体积减小,达到新平衡后浓度增大
D.,恒容绝热下,当压强不变时可以判定反应达到平衡
19.利用如图装置溶解铁矿石中的,下列说法正确的是( )
A.X为阳离子交换膜,Y为阴离子交换膜
B.通电一段时间后,溶液浓度变小
C.电极发生的电极反应为
D.当溶解时,至少产生气体(标准状况下,不考虑气体溶解)
20.汽车尾气中含有CO、NO等有害气体,两者在恒容密闭容器中能发生反应:,为了验证温度对该反应速率的影响,某同学设计了两组实验,如表所示。已知280℃的情况下,反应后达到平衡,测得的浓度为。下列说法不正确的是( )
实验编号 的初始浓度/() 的初始浓度
Ⅰ 280
Ⅱ 350
A.表中的数值应为
B.当,说明该反应已达到平衡状态
C.280℃时,前2min内,用表示的平均反应速率为
D.280℃的情况下达到平衡时的浓度为
二、非选择题(共4个小题,共50分)
21.(16分)某化学兴趣小组用盐酸与溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是____________;不能用铜质搅拌器代替玻璃搅拌器的理由是__________________。
(2)NaOH溶液稍过量的原因是________________________。
(3)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为,中和反应后溶液的比热容)
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.3
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,该实验测得反应放出的热量为______J。
(4)下列操作会导致实验结果出现偏差的是______(填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将氢氧化钠溶液取成了氢氧化钾溶液
d.做本实验的当天室温较高
(5)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热()______(填“偏大”、“偏小”或“不变”)。
(6)如果用盐酸与溶液进行实验,与上述实验相比,二者所放出的热量______(填“相等”或“不相等”,下同),所求的中和反应反应热()______
22.(12分)下图中的左边装置表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请用下图所示各仪器设计一个包括:以惰性电极电解饱和食盐水,测定电解时产生的的体积并检验的氧化性的实验装置。
(1)此电解反应的离子方程式为_____________________________。
(2)所选仪器连接时,各接口的顺序是(填各接口的字母代号):A接______,______接______;B接______,______接______。
(3)电解一段时间后,用丁测得气体体积为560mL(标准状况下),此时溶液的体积为500mL,不考虑与NaOH的反应,则溶液中NaOH的物质的量浓度是______,需加入______(填物质名称)可使溶液复原。
23.(8分)(1)实验一:已知。在酸性高锰酸钾溶液与草酸()溶液反应时,发现开始一段时间,反应速度较快,溶液褪色不明显,但不久突然褪色,反应速度明显加快。
①针对上述实验现象,小组同学认为与反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你认为还可能是______的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要的试剂最合理的是______(填字母)。
A.硫酸钾 B.硫酸镍 C.二氧化锰 D.水
(2)实验二:探究和混合时生成和的反应存在一定的限度。
Ⅰ、向溶液中滴加滴溶液,充分反应后,将所得溶液分成甲、乙两等份;
Ⅱ、向甲中滴加,充分振荡;
Ⅲ、向乙中滴加试剂X。
请回答下列问题:
(1)步骤Ⅲ中,试剂X是______;
(2)步骤Ⅱ和Ⅲ中的实验现象说明和混合时生成和的反应存在一定的限度,该实验现象是______________________________________。
24.(14分)一定条件下,在恒容密闭容器中发生反应:。开始时加入,在末测得的物质的量是。
(1)在末,______。
(2)若改变下列一个条件,推测反应速率发生的变化,用“增大”、“减小”或“不变”来回答下列问题。
①将容器的体积变为,化学反应速率______。
②加入少量的碳,化学反应速率______。
③升高温度,化学反应速率______。
(3)在不改变反应条件的情况下,通过实验监测发现在2min~7min内和的物质的量浓度的变化曲线如图所示。
①a=______(保留两位有效数字);
②由图可知7min时达平衡,此时混合气体的平均相对分子质量为______(保留三位有效数字),该反应的平衡常数K=______mol/L。
高二化学答案
一.选择题(共20小题,每题2.5分,共计50分,每小题只有一个正确选项符合题意。)
1B 2C 3D 4B
5A 6C 7A 8B
9B 10A 11C 12C
13D 14A 15B 16D
17D 18D 19C 20C
二、非选择题(共4个小题,共50分)
21.(16分)(1)上下匀速搅动 Cu是热的良导体,传热快,热量损失大
(2)D (3)1337.6 (4)ab (5)偏小
(6)不相等 相等
22.(12分)(除标注外,每空2分)
(1)
(2)G、F、H;D、E、C(各1分) (3)0.1 氯化氢
23.(8分)(1)①生成的对反应有催化作用(2分) ②B(2分)
(2)①KSCN溶液(2分)
②Ⅱ中可观察到溶液分层,下层呈现紫红色,Ⅲ中可观察到溶液变红(2分)
24.(14分)
(1)0.6(2分) (2)①减小(2分) ②不变(2分) ③增大(2分)
(3)①0.33(2分) ②39.7(2分) 6.4(2分)
同课章节目录
