第四章第一节 原子结构与元素周期表 达标训练(课时一)(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章第一节 原子结构与元素周期表 达标训练(课时一)(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 329.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 16:14:20 | ||
图片预览




文档简介
必修一第四章第一节原子结构与元素周期表达标训练(课时一)
一、单选题(共11题,每题4分,共44分)
1.下列说法正确的是
A.决定元素种类的是原子核最外层电子数 B.质子数相同的原子一定属于同种元素
C.决定元素化学性质的是原子核内中子数 D.原子核内的中子数一定不为零
2.我国科学家研制的“人造太阳”成功运行。所谓“人造太阳”是指受控核聚变。从1L海水中提取出来的氘 ()发生受控核聚变变成氦()时产生的能量相当于汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法不正确的是
A.氘()变成氦()发生化学变化
B.中的“2”与中的“2”意义不相同
C.的中子数和质子数均为2
D.和为不同核素
3.下列关于原子结构及微粒间的数量关系,说法正确的是
A.质子数相同的微粒一定属于同一种元素
B.微粒具有相同的电子层结构
C.某元素原子的最外层只有2个电子,则该元素一定是金属元素
D.一种分子和一种离子的质子数和电子数不可能均相等
4.某元素在自然界里有两种天然同位素,其原子个数比为2.44:1.05,第一种同位素的原子核内有29个质子和34个中子,第二种同位素原子核中的中子数比第一种多2个,该元素的近似相对原子质量是
A.64.00 B.63.60 C.65.00 D.63.00
5.元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是
A.CaCl2 B.MgCl2 C.MgF2 D.KBr
6.下列表示物质结构的化学用语正确的是
A.的结构示意图: B.H、D、T表示同一种核素
C.8个中子的碳原子的核素符号: D.、具有不同的最外层电子数
7.2005年有科学家在《Science》上发表论文,宣布发现铝的超原子结构 Al13和Al14,并在质谱仪检测到稳定的等。Al13和Al14的性质很像现行周期表中某些主族元素,已知当这类超原子具有40个价电子时最稳定(价电子指最外层电子)。下列说法不正确的是
A.Al13与卤素原子(ⅦA族)性质相似,能形成稳定的
B.Al14与HI反应的化学方程式为:Al14+2HI=Al14I2+H2↑
C.Al14超原子与烧碱溶液一定生成NaAlO2和氢气
D.Al14超原子共有42个价电子,容易失去2个电子形成稳定的Al
8.A、B、C三种元素的原子序数依次为a、b、c,它们的离子、、具有相同的电子层结构,且n>m。下列说法正确的是
A.三种元素位于同一周期 B.a=b+m+n
C.a>b>c D.c=a-m-n
9.下列各组微粒具有相同质子数和电子数的是
A.、、HF B.、、Ne
C.、、 D.、、
10.重水()是重要的核工业原料,下列有关说法错误的是
A.与互称同素异形体 B.氘(D)原子核外有1个电子
C.与D互称同位素 D.与的相对分子质量相同
11.自然界中NaCl是由与和所构成的。已知氯元素的相对原子质量是35.5,则58.5g氯化钠中,含的质量为
A.8.75g B.13.125g C.26.25g D.17.5g
二、填空题(共4题,共56分)
12.(16分)(1)写出表示含有8个质子,10个中子的原子的化学符号: 。
(2)根据下列微粒回答问题:H、H、H、C、、、、。
①以上8种微粒共有 种核素,共 种元素。
②互为同位素的是 。
③质量数相等的是 和 ,中子数相等的是 和 。
(3)相同物质的量的与的质量之比为 ;中子数之比为 ;电子数之比为 。
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是 。(铷的相对原子质量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为 。
13.(12分)近年来,我国航空航天事业成果显著,“北斗三号”导航卫星搭载了精密计时的铷(Rb)原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图1)。回答下列问题:
(1)下列说法错误的是_______(填字母)。
A., B.铷是金属元素
C.铷的相对原子质量是85.47 D.铷原子有5个电子层,最外层有1个电子
(2)Rb原子第一电子层上电子的能量比最外层上电子的能量 (填“低”或“高”)。
(3)如图2中所示粒子共表示 种元素,铷元素原子的化学性质与如图中
(填字母)的化学性质相似。
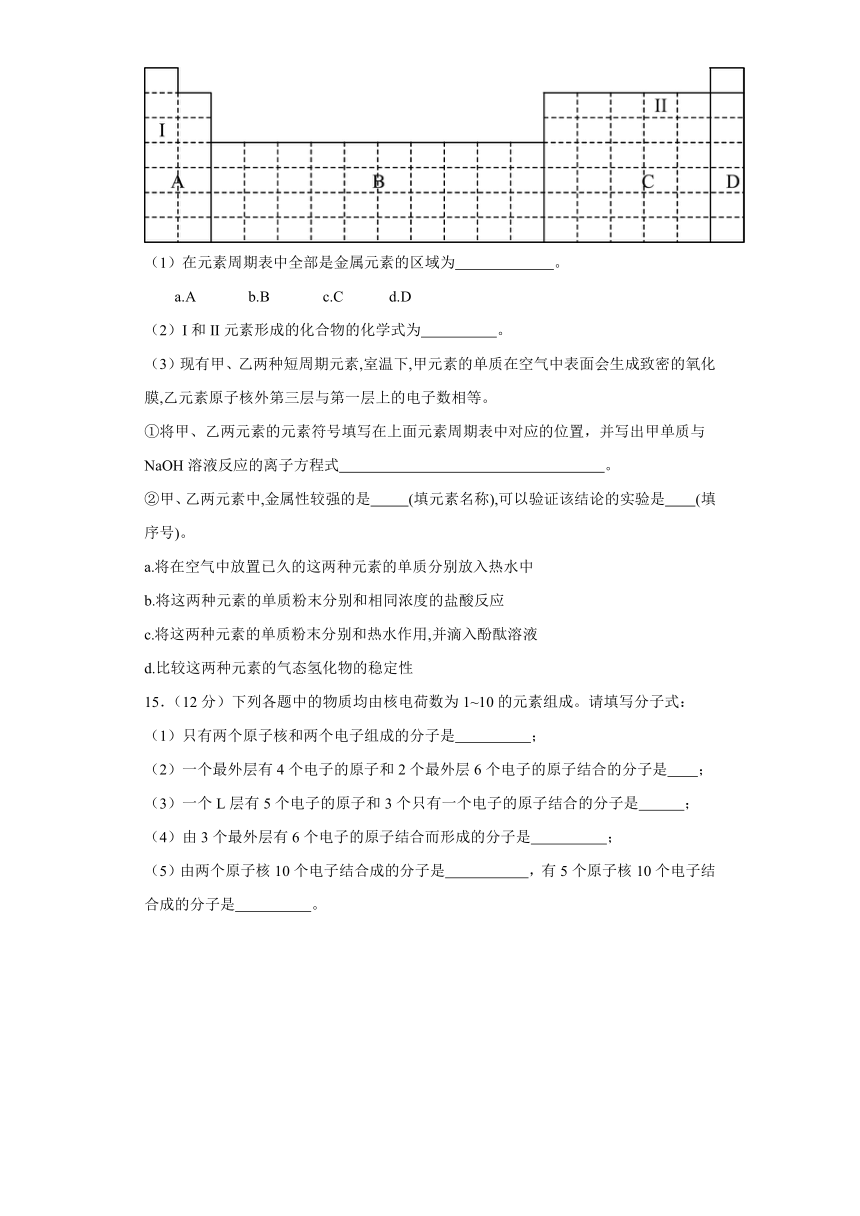
14.(16分)结合元素周期表,完成下列问题。
(1)在元素周期表中全部是金属元素的区域为 。
a.A b.B c.C d.D
(2)I和II元素形成的化合物的化学式为 。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在空气中表面会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置,并写出甲单质与NaOH溶液反应的离子方程式 。
②甲、乙两元素中,金属性较强的是 (填元素名称),可以验证该结论的实验是 (填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
15.(12分)下列各题中的物质均由核电荷数为1~10的元素组成。请填写分子式:
(1)只有两个原子核和两个电子组成的分子是 ;
(2)一个最外层有4个电子的原子和2个最外层6个电子的原子结合的分子是 ;
(3)一个L层有5个电子的原子和3个只有一个电子的原子结合的分子是 ;
(4)由3个最外层有6个电子的原子结合而形成的分子是 ;
(5)由两个原子核10个电子结合成的分子是 ,有5个原子核10个电子结合成的分子是 。
试卷第1页,共3页
参考答案:
1.B
【详解】A.元素是指具有相同质子数的一类原子的总称,所以质子数决定元素的种类,A项错误;
B.元素是指具有相同质子数的一类原子的总称,所以质子数相同的原子一定属于同种元素,B项正确;
C.元素发生化学变化时主要是最外层电子数发生变化,所以元素的化学性质主要决定于原子核最外层电子数,C项错误;
D.氢原子的原子核内只有1个质子,没有中子,中子数为0,D项错误;
故选B。
2.A
【详解】A.氘受控核聚变成氦是一种核反应,A错误;
B.符号中的“2”符号表示质量数是2,中“2”符号表示质子数是2,意义不同,B正确;
C.中子数为2,质子数为2,C错误;
D.属于质子数相同,中子数不同的不同核素,D正确;
故答案为:A。
3.D
【详解】A. 质子数相同的微粒不一定属于同一种元素,例如Ne、H2O分子、NH3分子均为10个质子,但不是同种元素,A错误;
B.微粒Na+、Mg2+核外电子排布是2、8,这两种微粒具有相同的电子层结构,S2-核外电子排布是2、8、8,B错误;
C. 某元素原子的最外层只有2个电子,该元素可能是He,也可能是Be,因此该元素不一定是金属元素,C错误;
D.分子的质子数和电子数相等,离子的质子数和电子数不相等,则一种分子和一种离子的质子数和电子数不可能均相等,D正确;
选D。
4.B
【详解】第一种同位素原子的质量数为63,第二种同位素原子的质量数为65,该元素的近似平均相对原子质量:,答案选B。
5.A
【分析】X的最高正价和负价的绝对值之差为6,说明X为非金属,Y为金属,X、Y的离子具有相同的电子排布,则Y在X相邻的下一层,元素Y原子次外层与元素X原子次外层均为8个电子, Y至少在第三周期。
【详解】A. Cl的最高正价和负价的绝对值之差为6,Cl和Ca次外层均为8个电子,符合要求,故A正确;
B. Mg2+和Cl-的电子排布不同,故B错误;
C. F无正价,Mg2+和F-的电子排布不同,故C错误;
D. K+和Br-的电子排布不同,故D错误;
故答案选A。
6.C
【详解】A.氯离子的核电荷数为17,核外有3个电子层,最外层电子数为8,离子的结构示意图为,故A错误;
B.H、D、T的质子数相同、中子数不同,表示不同种核素,故B 错误;
C.8个中子的碳原子的质子数为6、质量数为14,核素符号为,故C正确;
D.、的最外层电子数都为7,故D错误;
故选C。
7.C
【详解】A.根据当这类超原子具有40个价电子时最稳定(价电子指最外层电子),则Al13与卤素原子(ⅦA族)性质相似,能形成稳定的,故A正确;
B.根据题意Al14易失去2个电子,形成稳定离子,则Al14与HI反应的化学方程式为:Al14+2HI=Al14I2+H2↑,故B正确;
C.根据题意Al14易失去2个电子,形成稳定离子,则Al14超原子与烧碱溶液不一定生成NaAlO2和氢气,可能生成Na2Al14O2和氢气,故C错误;
D.Al14超原子共有42个价电子,根据当这类超原子具有40个价电子时最稳定(价电子指最外层电子),容易失去2个电子形成稳定的Al,故D正确。
综上所述,答案为C。
8.D
【详解】A.An+、Bn-、Cm-具有相同的电子层结构,则B、C位于A的上一周期,A错误;
B.An+、Bn-具有相同的电子层结构,则a-n=b+n,a=b+2n,又因为n>m,故a>b+m+n,B错误;
C.An+、Bn-、Cm-具有相同的电子层结构,则a-n=b+n=c+m,又因为n>m,故a>c>b,C错误;
D.An+、Cm-具有相同的电子层结构,则a-n=c+m,c=a-m-n,D正确;
故答案选D。
9.C
【分析】若电子数等于质子数,则微粒为电中性粒子,即为原子或分子。
【详解】A .、不是电中性微粒,故质子数不等于电子数,故A不符合题意;
B.、不是电中性微粒,故质子数不等于电子数,故B不符合题意;
C.CH4、NH3、H2O都为电中性微粒,具有相同质子数和电子数,故C符合题意;
D.、、不是电中性微粒,故质子数不等于电子数,故D不符合题意;
故选:C。
10.A
【详解】A.与属于化合物,同种元素形成的不同单质互为同素异形体,A错误;
B.氘(D)原子内有1个质子,原子的核外电子数等于质子数,核外有1个电子,B正确
C.与D具有相同质子数、不同中子数,二者互称同位素,C正确;
D.的相对分子质量是2+18=20,的相对分子质量是4+16=20,D正确;
故选A。
11.C
【分析】元素的相对原子质量为该元素各种核素的相对原子质量与其在自然界中所占原子个数百分比的乘积之和。先根据元素的相对原子质量计算和的原子个数比,再根据原子个数比计算的质量。
【详解】58.5g氯化钠中氯元素的质量为,氯元素的相对原子质量35.5是质量数分别为37和35的核素的平均值,可以采用十字交叉法计算其原子个数比,即 ,所以和的原子个数之比为0.5:1.5=1:3,因此含的质量为,故选C。
12. 5 H、H、 14C C :34 2:3 11:16 或Na :9
【详解】(1)质子数为8的原子,则为O,质量数=质子数+中子数=8+18=18,化学符号为 ;
(2)①具有一定数目质子和一定数目中子的一种原子称为核素,则共有6种核素;5种元素;
②同位素为质子数相等,而中子数不等的原子,则H、H、互为同位素;
③质量数相等的是C和,中子数相等的是C和。
(3)相同物质的量的与的质量,m():m()=n×46:n×68=23:34;中子数之比=n×24:n×36=2:3;电子数之比=n×22:n×32=11:16;
(4)M===39g/mol,铷摩尔质量为85.5g/mol,则另一碱金属的摩尔质量小于平均值,则只能是Na或Li;
(5)质量相同的H2O和D2O,物质的量分别为mol、mol,与足量钠反应生成氢气的量与水的物质的量有关,则氢气的物质的量的比为:=20:18=10:9,相同条件下,物质的量之比等于体积之比,则体积比为10:9。
【点睛】相同条件下,气体的体积之比等于物质的量之比。
13.(1)A
(2)低
(3) 三 D
【详解】(1)A.由铷元素在元素周期表中的信息可知,其原子序数为37,则,在原子中,质子数=核外电子数,所以,该选项说法错误;
B.铷元素属于金属元素,该选项说法正确;
C.铷的相对原子质量是85.47,该选项说法正确;
D.由图示可知铷原子有5个电子层,最外层有1个电子,该选项说法正确;
故选A;
(2)离核越近的电子能量越低,故原子第一电子层上电子的能量比最外层上电子的能量低,故答案为:低;
(3)中,B和C两种粒子的质子数相同,所以属于同种元素的粒子,中共表示三种元素;由图示可知,粒子中D粒子的最外层有1个电子,与铷元素原子的最外层电子数相同,故二者的化学性质相似,故答案为:三;D。
14. B Na2O2、Na2O
2Al+2H2O+2OH-=2AlO2-+3H2↑ 镁 bc
【详解】(1)A区中氢元素为非金属元素,B区均为过渡元素,均为金属元素,C区中含有金属元素和非金属元素,D区均为稀有气体元素,故答案为:B;
I为钠元素,II为氧元素,二者形成的化合物为Na2O2、Na2O,
(3)甲为短周期元素且甲元素的单质遇冷的浓硫酸会钝化,推知甲为铝元素,乙元素原子核外第三层与第一层上的电子数相等,即核外有12个电子,推知乙为镁元素。
①铝为第三周期IIIA族,镁为第三周期IIA族,在元素周期表中的位置为,铝与氢氧化钠溶液反应的离子反应方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:;2Al+2H2O+2OH-=2AlO2-+3H2↑;
②根据元素周期律,同一周期从左到右金属性逐渐减弱,可知镁的金属性比铝强;
a.镁单质和铝单质在空气中久置后都会在表面形成一层氧化物膜,阻止金属与水发生反应,所以不能比较出金属性强弱,故a错误;
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应,反应越剧烈,其金属性越强,故b正确;
c.镁单质能和热水反应生成氢氧化镁,而铝单质几乎和热水不反应,滴加酚酞溶液,加入镁粉的溶液会呈浅 色,而加入铝粉的溶液中无明显现象,故c正确;
d.二者都为金属元素,不能通过比较氢化物的稳定性来判断金属性强弱,故d错误;
综上所述,答案为:镁;bc。
【点睛】镁能够与热水反应生成氢氧化镁,在热水中氢氧化镁溶解度增大,溶解的氢氧化镁发生电离,使溶液呈弱碱性,故能使酚酞呈现浅红色。
15. H2 CO2 NH3 O3 HF CH4
【详解】(1)只有两个原子核和两个电子组成的分子,每个原子中有1个电子,所以该分子是H2;
(2)最外层有4个电子的原子是碳,最外层有6个电子的原子是氧,一个C原子和2个O原子结合的分子是CO2;
(3)L层有5个电子的原子是N原子,只有一个电子的原子是H原子,一个N原子和3个H原子结合的分子是NH3;
(4)最外层有6个电子的原子是O原子,由3个O原子结合而形成的分子是O3;
(5)1个H原子和1个F原子的电子总数是10,由两个原子核10个电子结合成的分子是HF,1个C原子、4个H原子的电子总数是10,有5个原子核10个电子结合成的分子是CH4。
【点睛】该题考查原子结构,熟练掌握核外电子排布规律是解答的关键,需要熟记10电子微粒的种类,由成键特点和形成分子的原子数目推导常见10电子分子
一、单选题(共11题,每题4分,共44分)
1.下列说法正确的是
A.决定元素种类的是原子核最外层电子数 B.质子数相同的原子一定属于同种元素
C.决定元素化学性质的是原子核内中子数 D.原子核内的中子数一定不为零
2.我国科学家研制的“人造太阳”成功运行。所谓“人造太阳”是指受控核聚变。从1L海水中提取出来的氘 ()发生受控核聚变变成氦()时产生的能量相当于汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法不正确的是
A.氘()变成氦()发生化学变化
B.中的“2”与中的“2”意义不相同
C.的中子数和质子数均为2
D.和为不同核素
3.下列关于原子结构及微粒间的数量关系,说法正确的是
A.质子数相同的微粒一定属于同一种元素
B.微粒具有相同的电子层结构
C.某元素原子的最外层只有2个电子,则该元素一定是金属元素
D.一种分子和一种离子的质子数和电子数不可能均相等
4.某元素在自然界里有两种天然同位素,其原子个数比为2.44:1.05,第一种同位素的原子核内有29个质子和34个中子,第二种同位素原子核中的中子数比第一种多2个,该元素的近似相对原子质量是
A.64.00 B.63.60 C.65.00 D.63.00
5.元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是
A.CaCl2 B.MgCl2 C.MgF2 D.KBr
6.下列表示物质结构的化学用语正确的是
A.的结构示意图: B.H、D、T表示同一种核素
C.8个中子的碳原子的核素符号: D.、具有不同的最外层电子数
7.2005年有科学家在《Science》上发表论文,宣布发现铝的超原子结构 Al13和Al14,并在质谱仪检测到稳定的等。Al13和Al14的性质很像现行周期表中某些主族元素,已知当这类超原子具有40个价电子时最稳定(价电子指最外层电子)。下列说法不正确的是
A.Al13与卤素原子(ⅦA族)性质相似,能形成稳定的
B.Al14与HI反应的化学方程式为:Al14+2HI=Al14I2+H2↑
C.Al14超原子与烧碱溶液一定生成NaAlO2和氢气
D.Al14超原子共有42个价电子,容易失去2个电子形成稳定的Al
8.A、B、C三种元素的原子序数依次为a、b、c,它们的离子、、具有相同的电子层结构,且n>m。下列说法正确的是
A.三种元素位于同一周期 B.a=b+m+n
C.a>b>c D.c=a-m-n
9.下列各组微粒具有相同质子数和电子数的是
A.、、HF B.、、Ne
C.、、 D.、、
10.重水()是重要的核工业原料,下列有关说法错误的是
A.与互称同素异形体 B.氘(D)原子核外有1个电子
C.与D互称同位素 D.与的相对分子质量相同
11.自然界中NaCl是由与和所构成的。已知氯元素的相对原子质量是35.5,则58.5g氯化钠中,含的质量为
A.8.75g B.13.125g C.26.25g D.17.5g
二、填空题(共4题,共56分)
12.(16分)(1)写出表示含有8个质子,10个中子的原子的化学符号: 。
(2)根据下列微粒回答问题:H、H、H、C、、、、。
①以上8种微粒共有 种核素,共 种元素。
②互为同位素的是 。
③质量数相等的是 和 ,中子数相等的是 和 。
(3)相同物质的量的与的质量之比为 ;中子数之比为 ;电子数之比为 。
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是 。(铷的相对原子质量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为 。
13.(12分)近年来,我国航空航天事业成果显著,“北斗三号”导航卫星搭载了精密计时的铷(Rb)原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图1)。回答下列问题:
(1)下列说法错误的是_______(填字母)。
A., B.铷是金属元素
C.铷的相对原子质量是85.47 D.铷原子有5个电子层,最外层有1个电子
(2)Rb原子第一电子层上电子的能量比最外层上电子的能量 (填“低”或“高”)。
(3)如图2中所示粒子共表示 种元素,铷元素原子的化学性质与如图中
(填字母)的化学性质相似。
14.(16分)结合元素周期表,完成下列问题。
(1)在元素周期表中全部是金属元素的区域为 。
a.A b.B c.C d.D
(2)I和II元素形成的化合物的化学式为 。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在空气中表面会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置,并写出甲单质与NaOH溶液反应的离子方程式 。
②甲、乙两元素中,金属性较强的是 (填元素名称),可以验证该结论的实验是 (填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
15.(12分)下列各题中的物质均由核电荷数为1~10的元素组成。请填写分子式:
(1)只有两个原子核和两个电子组成的分子是 ;
(2)一个最外层有4个电子的原子和2个最外层6个电子的原子结合的分子是 ;
(3)一个L层有5个电子的原子和3个只有一个电子的原子结合的分子是 ;
(4)由3个最外层有6个电子的原子结合而形成的分子是 ;
(5)由两个原子核10个电子结合成的分子是 ,有5个原子核10个电子结合成的分子是 。
试卷第1页,共3页
参考答案:
1.B
【详解】A.元素是指具有相同质子数的一类原子的总称,所以质子数决定元素的种类,A项错误;
B.元素是指具有相同质子数的一类原子的总称,所以质子数相同的原子一定属于同种元素,B项正确;
C.元素发生化学变化时主要是最外层电子数发生变化,所以元素的化学性质主要决定于原子核最外层电子数,C项错误;
D.氢原子的原子核内只有1个质子,没有中子,中子数为0,D项错误;
故选B。
2.A
【详解】A.氘受控核聚变成氦是一种核反应,A错误;
B.符号中的“2”符号表示质量数是2,中“2”符号表示质子数是2,意义不同,B正确;
C.中子数为2,质子数为2,C错误;
D.属于质子数相同,中子数不同的不同核素,D正确;
故答案为:A。
3.D
【详解】A. 质子数相同的微粒不一定属于同一种元素,例如Ne、H2O分子、NH3分子均为10个质子,但不是同种元素,A错误;
B.微粒Na+、Mg2+核外电子排布是2、8,这两种微粒具有相同的电子层结构,S2-核外电子排布是2、8、8,B错误;
C. 某元素原子的最外层只有2个电子,该元素可能是He,也可能是Be,因此该元素不一定是金属元素,C错误;
D.分子的质子数和电子数相等,离子的质子数和电子数不相等,则一种分子和一种离子的质子数和电子数不可能均相等,D正确;
选D。
4.B
【详解】第一种同位素原子的质量数为63,第二种同位素原子的质量数为65,该元素的近似平均相对原子质量:,答案选B。
5.A
【分析】X的最高正价和负价的绝对值之差为6,说明X为非金属,Y为金属,X、Y的离子具有相同的电子排布,则Y在X相邻的下一层,元素Y原子次外层与元素X原子次外层均为8个电子, Y至少在第三周期。
【详解】A. Cl的最高正价和负价的绝对值之差为6,Cl和Ca次外层均为8个电子,符合要求,故A正确;
B. Mg2+和Cl-的电子排布不同,故B错误;
C. F无正价,Mg2+和F-的电子排布不同,故C错误;
D. K+和Br-的电子排布不同,故D错误;
故答案选A。
6.C
【详解】A.氯离子的核电荷数为17,核外有3个电子层,最外层电子数为8,离子的结构示意图为,故A错误;
B.H、D、T的质子数相同、中子数不同,表示不同种核素,故B 错误;
C.8个中子的碳原子的质子数为6、质量数为14,核素符号为,故C正确;
D.、的最外层电子数都为7,故D错误;
故选C。
7.C
【详解】A.根据当这类超原子具有40个价电子时最稳定(价电子指最外层电子),则Al13与卤素原子(ⅦA族)性质相似,能形成稳定的,故A正确;
B.根据题意Al14易失去2个电子,形成稳定离子,则Al14与HI反应的化学方程式为:Al14+2HI=Al14I2+H2↑,故B正确;
C.根据题意Al14易失去2个电子,形成稳定离子,则Al14超原子与烧碱溶液不一定生成NaAlO2和氢气,可能生成Na2Al14O2和氢气,故C错误;
D.Al14超原子共有42个价电子,根据当这类超原子具有40个价电子时最稳定(价电子指最外层电子),容易失去2个电子形成稳定的Al,故D正确。
综上所述,答案为C。
8.D
【详解】A.An+、Bn-、Cm-具有相同的电子层结构,则B、C位于A的上一周期,A错误;
B.An+、Bn-具有相同的电子层结构,则a-n=b+n,a=b+2n,又因为n>m,故a>b+m+n,B错误;
C.An+、Bn-、Cm-具有相同的电子层结构,则a-n=b+n=c+m,又因为n>m,故a>c>b,C错误;
D.An+、Cm-具有相同的电子层结构,则a-n=c+m,c=a-m-n,D正确;
故答案选D。
9.C
【分析】若电子数等于质子数,则微粒为电中性粒子,即为原子或分子。
【详解】A .、不是电中性微粒,故质子数不等于电子数,故A不符合题意;
B.、不是电中性微粒,故质子数不等于电子数,故B不符合题意;
C.CH4、NH3、H2O都为电中性微粒,具有相同质子数和电子数,故C符合题意;
D.、、不是电中性微粒,故质子数不等于电子数,故D不符合题意;
故选:C。
10.A
【详解】A.与属于化合物,同种元素形成的不同单质互为同素异形体,A错误;
B.氘(D)原子内有1个质子,原子的核外电子数等于质子数,核外有1个电子,B正确
C.与D具有相同质子数、不同中子数,二者互称同位素,C正确;
D.的相对分子质量是2+18=20,的相对分子质量是4+16=20,D正确;
故选A。
11.C
【分析】元素的相对原子质量为该元素各种核素的相对原子质量与其在自然界中所占原子个数百分比的乘积之和。先根据元素的相对原子质量计算和的原子个数比,再根据原子个数比计算的质量。
【详解】58.5g氯化钠中氯元素的质量为,氯元素的相对原子质量35.5是质量数分别为37和35的核素的平均值,可以采用十字交叉法计算其原子个数比,即 ,所以和的原子个数之比为0.5:1.5=1:3,因此含的质量为,故选C。
12. 5 H、H、 14C C :34 2:3 11:16 或Na :9
【详解】(1)质子数为8的原子,则为O,质量数=质子数+中子数=8+18=18,化学符号为 ;
(2)①具有一定数目质子和一定数目中子的一种原子称为核素,则共有6种核素;5种元素;
②同位素为质子数相等,而中子数不等的原子,则H、H、互为同位素;
③质量数相等的是C和,中子数相等的是C和。
(3)相同物质的量的与的质量,m():m()=n×46:n×68=23:34;中子数之比=n×24:n×36=2:3;电子数之比=n×22:n×32=11:16;
(4)M===39g/mol,铷摩尔质量为85.5g/mol,则另一碱金属的摩尔质量小于平均值,则只能是Na或Li;
(5)质量相同的H2O和D2O,物质的量分别为mol、mol,与足量钠反应生成氢气的量与水的物质的量有关,则氢气的物质的量的比为:=20:18=10:9,相同条件下,物质的量之比等于体积之比,则体积比为10:9。
【点睛】相同条件下,气体的体积之比等于物质的量之比。
13.(1)A
(2)低
(3) 三 D
【详解】(1)A.由铷元素在元素周期表中的信息可知,其原子序数为37,则,在原子中,质子数=核外电子数,所以,该选项说法错误;
B.铷元素属于金属元素,该选项说法正确;
C.铷的相对原子质量是85.47,该选项说法正确;
D.由图示可知铷原子有5个电子层,最外层有1个电子,该选项说法正确;
故选A;
(2)离核越近的电子能量越低,故原子第一电子层上电子的能量比最外层上电子的能量低,故答案为:低;
(3)中,B和C两种粒子的质子数相同,所以属于同种元素的粒子,中共表示三种元素;由图示可知,粒子中D粒子的最外层有1个电子,与铷元素原子的最外层电子数相同,故二者的化学性质相似,故答案为:三;D。
14. B Na2O2、Na2O
2Al+2H2O+2OH-=2AlO2-+3H2↑ 镁 bc
【详解】(1)A区中氢元素为非金属元素,B区均为过渡元素,均为金属元素,C区中含有金属元素和非金属元素,D区均为稀有气体元素,故答案为:B;
I为钠元素,II为氧元素,二者形成的化合物为Na2O2、Na2O,
(3)甲为短周期元素且甲元素的单质遇冷的浓硫酸会钝化,推知甲为铝元素,乙元素原子核外第三层与第一层上的电子数相等,即核外有12个电子,推知乙为镁元素。
①铝为第三周期IIIA族,镁为第三周期IIA族,在元素周期表中的位置为,铝与氢氧化钠溶液反应的离子反应方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:;2Al+2H2O+2OH-=2AlO2-+3H2↑;
②根据元素周期律,同一周期从左到右金属性逐渐减弱,可知镁的金属性比铝强;
a.镁单质和铝单质在空气中久置后都会在表面形成一层氧化物膜,阻止金属与水发生反应,所以不能比较出金属性强弱,故a错误;
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应,反应越剧烈,其金属性越强,故b正确;
c.镁单质能和热水反应生成氢氧化镁,而铝单质几乎和热水不反应,滴加酚酞溶液,加入镁粉的溶液会呈浅 色,而加入铝粉的溶液中无明显现象,故c正确;
d.二者都为金属元素,不能通过比较氢化物的稳定性来判断金属性强弱,故d错误;
综上所述,答案为:镁;bc。
【点睛】镁能够与热水反应生成氢氧化镁,在热水中氢氧化镁溶解度增大,溶解的氢氧化镁发生电离,使溶液呈弱碱性,故能使酚酞呈现浅红色。
15. H2 CO2 NH3 O3 HF CH4
【详解】(1)只有两个原子核和两个电子组成的分子,每个原子中有1个电子,所以该分子是H2;
(2)最外层有4个电子的原子是碳,最外层有6个电子的原子是氧,一个C原子和2个O原子结合的分子是CO2;
(3)L层有5个电子的原子是N原子,只有一个电子的原子是H原子,一个N原子和3个H原子结合的分子是NH3;
(4)最外层有6个电子的原子是O原子,由3个O原子结合而形成的分子是O3;
(5)1个H原子和1个F原子的电子总数是10,由两个原子核10个电子结合成的分子是HF,1个C原子、4个H原子的电子总数是10,有5个原子核10个电子结合成的分子是CH4。
【点睛】该题考查原子结构,熟练掌握核外电子排布规律是解答的关键,需要熟记10电子微粒的种类,由成键特点和形成分子的原子数目推导常见10电子分子
