3.4 离子反应 同步练习题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.4 离子反应 同步练习题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 693.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 00:00:00 | ||
图片预览



文档简介
3.4 离子反应 同步练习题
一、选择题
1.下列实验操作或实验仪器的使用错误的是
A.用剩的药品均不能放回原瓶
B.用pH计测量溶液的pH
C.用酸式滴定管量取高锰酸钾溶液
D.洗净的锥形瓶和容量瓶不需要干燥
2.下列离子方程式书写正确的是
A.将固体投入中:
B.在海带灰的浸出液(含有)中滴加双氧水得到:
C.溶液与足量的NaOH溶液反应:
D.向溶液中滴加少量稀硫酸:
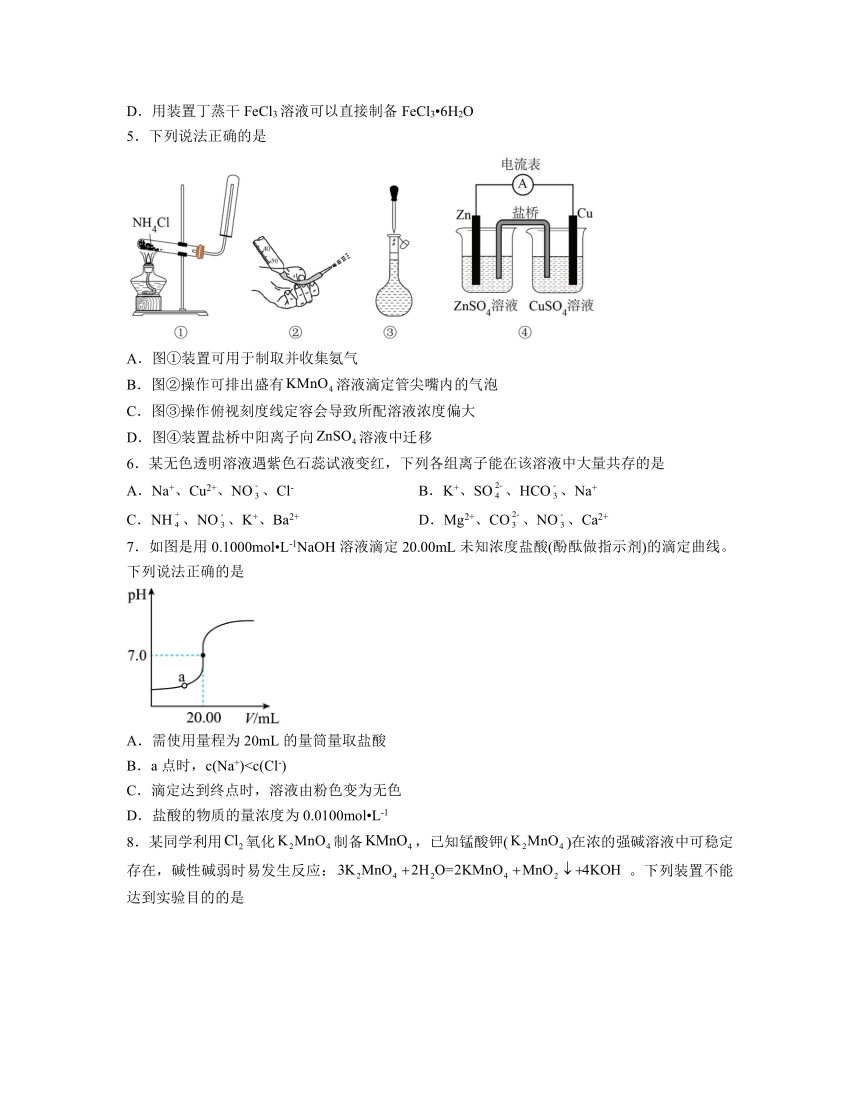
3.根据下列装置和物质,能达到相应实验目的的是
A.分离碘和酒精 B.进行酸碱中和滴定 C.验证铁钉能发生析氢腐蚀 D.制备
A.A B.B C.C D.D
4.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3 6H2O步骤:用H2O2氧化废蚀刻液、制备氨气、制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离、用盐酸溶解沉淀并制备FeCl3 6H2O。下列有关实验的说法不正确的是
A.用装置甲制备氨气
B.用装置乙可以制备Cu(NH3)4Cl2溶液并沉铁
C.用装置丙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D.用装置丁蒸干FeCl3溶液可以直接制备FeCl3 6H2O
5.下列说法正确的是
A.图①装置可用于制取并收集氨气
B.图②操作可排出盛有溶液滴定管尖嘴内的气泡
C.图③操作俯视刻度线定容会导致所配溶液浓度偏大
D.图④装置盐桥中阳离子向溶液中迁移
6.某无色透明溶液遇紫色石蕊试液变红,下列各组离子能在该溶液中大量共存的是
A.Na+、Cu2+、NO、Cl- B.K+、SO、HCO、Na+
C.NH、NO、K+、Ba2+ D.Mg2+、CO、NO、Ca2+
7.如图是用0.1000mol L-1NaOH溶液滴定20.00mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
A.需使用量程为20mL的量筒量取盐酸
B.a点时,c(Na+)C.滴定达到终点时,溶液由粉色变为无色
D.盐酸的物质的量浓度为0.0100mol L-1
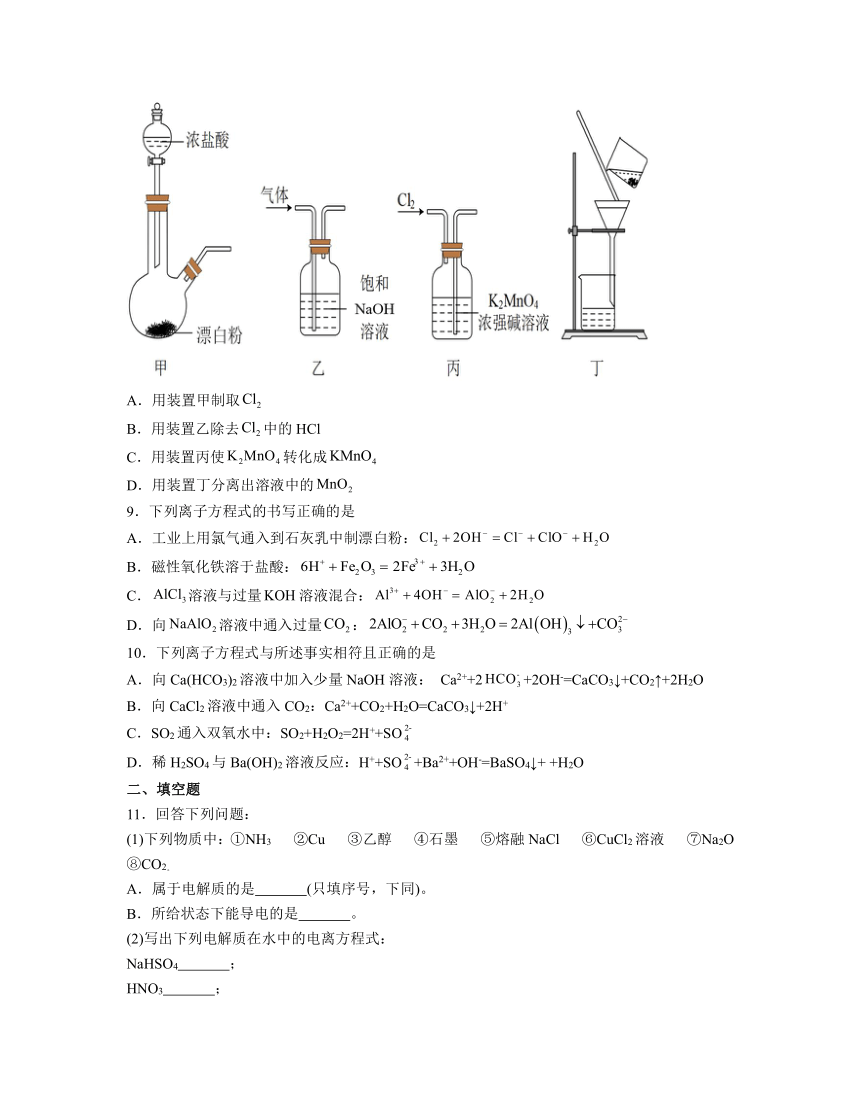
8.某同学利用氧化制备,已知锰酸钾()在浓的强碱溶液中可稳定存在,碱性碱弱时易发生反应:。下列装置不能达到实验目的的是
A.用装置甲制取
B.用装置乙除去中的HCl
C.用装置丙使转化成
D.用装置丁分离出溶液中的
9.下列离子方程式的书写正确的是
A.工业上用氯气通入到石灰乳中制漂白粉:
B.磁性氧化铁溶于盐酸:
C.溶液与过量溶液混合:
D.向溶液中通入过量:
10.下列离子方程式与所述事实相符且正确的是
A.向Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2+2OH-=CaCO3↓+CO2↑+2H2O
B.向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+
C.SO2通入双氧水中:SO2+H2O2=2H++SO
D.稀H2SO4与Ba(OH)2溶液反应:H++SO+Ba2++OH-=BaSO4↓+ +H2O
二、填空题
11.回答下列问题:
(1)下列物质中:①NH3 ②Cu ③乙醇 ④石墨 ⑤熔融NaCl ⑥CuCl2溶液 ⑦Na2O ⑧CO2。
A.属于电解质的是 (只填序号,下同)。
B.所给状态下能导电的是 。
(2)写出下列电解质在水中的电离方程式:
NaHSO4 ;
HNO3 ;
(3)写出下列物质间反应的离子方程式:
氢氧化镁固体溶于足量稀盐酸: ;
碳酸氢钠溶液与稀盐酸混合: 。
12.为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2-按1∶1反应。
步骤Ⅰ:准确称取0.457 0 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 mol·L-1 Na2H2标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
(1)步骤Ⅱ中移取溶液时所使用的玻璃仪器为 ;
(2)产品中Zn3(PO4)2·4H2O的质量分数为 ;
(3)下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。
A.步骤Ⅰ中定容时俯视刻度线
B.步骤Ⅰ中转移溶液时未洗涤烧杯
C.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗
D.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
13.按要求回答下列问题
(1)将氨与氯气混合也会产生白烟,用化学方程式解释产生白烟的过程: 。
(2)在饱和溶液中滴加,产生刺激性气味的气体和白色沉淀,用离子方程式解释其现象: ,体现 。
(3)实验室常用饱和氯化铵与亚硝酸钠加热来制取氮气,写出发生反应的化学方程式: ,体现 。
14.填空。
(1)CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化。对开发新能源和降低碳排放意义重大。
已知:①
②
③
写出由甲烷和氧气合成液态甲醇的热化学方程式: 。
(2)已知:
则反应的△H= kJ mol-1。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,化学反应的离子方程式是 。
(4)实验室现欲用质量分数为98%,密度为包的浓H2SO4溶液配制450 mL浓度为的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是 mL。
15.已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子 K+、NH、Mg2+、Ba2+、Fe3+
阴离子 Cl-、Br-、CO、HCO、SO
现进行如下实验操作(每次实验所加试剂均过量):
已知:NaHCO3+NaOH=Na2CO3+H2O
(1)由气体B可确定待测液中含有的离子是 。
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是 ,据此可以排除的离子是 。
(3)由白色沉淀B可确定待测液中含有的离子是 。
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是 。
(5)综合分析,待测液中K+的最小浓度为 。
16.草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)= 。
②已知H2C2O4是一种二元弱酸,实验室可以用酸性高锰酸钾溶液标定草酸溶液的浓度,其离子方程式为 。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.7700 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900 g。
步骤Ⅱ 准确称取1.7700 g样品,用NH3·H2O/NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.05000 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
第一次滴定 第二次滴定 第三次滴定
消耗EDTA标准溶液的体积/mL 25.92 24.99 25.01
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有 (填字母)。
A.锥形瓶水洗后未干燥
B.滴定时锥形瓶中有液体溅出
C.装EDTA标准溶液的滴定管水洗后未润洗
D.开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式 (写出计算过程)。
【参考答案】
一、选择题
1.A
解析:A.金属Na等易发生安全事故的试剂应放回原瓶,A错误;
B.溶液具有强氧化性,会漂白试纸,可以用pH计测量溶液的pH,B正确;
C.高锰酸钾溶液具有强氧化性,不可以使用碱式滴定管,否则会氧化橡胶,需要用酸式滴定管量取高锰酸钾溶液,C正确;
D.洗净的锥形瓶和容量瓶不需要干燥,有水残余不影响使用,D正确。
故选A。
2.D
解析:A.将固体投入中离子方程式:,A项错误;
B.海带灰的浸出液(含有)中滴加双氧水得到离子方程式:,B项错误;
C.溶液与足量的NaOH溶液反应离子方程式:,C项错误;
D.向溶液中滴加少量稀硫酸离子方程式:,D项正确;
故选D。
3.D
解析:A.碘易溶于酒精,无法通过分液操作将碘和酒精分离,A错误;
B.氢氧化钠溶液应装在碱式滴定管中,B错误;
C.食盐水浸泡过的铁钉和空气接触,发生的是吸氧腐蚀,不是析氢腐蚀,C错误;
D.氨气,二氧化碳通入饱和氢化钠溶液中生成碳酸氢钠沉淀和氯化铵,过滤得到碳酸氢钠晶体,D正确;
故选D。
4.D
解析:A.NH4Cl和Ca(OH)2固体加热制备NH3,A项正确;
B.NH3可将CuCl2转变为Cu(NH3)4Cl2液,同时将Fe3+转变为Fe(OH)3沉淀,B项正确;
C.Cu(NH3)4Cl2溶液和Fe(OH)3为固液混合体系,可选用过滤如图丙,C项正确;
D.FeCl3在加热条件下水解加剧得到Fe(OH)3,所提直接如图丁蒸干得到Fe(OH)3,D项错误;
故选D。
5.C
解析:A.氯化铵受热分解生成氨气和氯化氢,遇冷又化合生成氯化铵,则直接加热氯化铵无法制得氨气,实验室用加热氯化铵和氢氧化钙固体的方法制备氨气,故A错误;
B.高锰酸钾溶液具有强氧化性,会腐蚀橡胶管,所以高锰酸钾溶液应盛放在酸式滴定管在,不能盛放在碱式滴定管中,故B错误;
C.配制一定物质的量浓度的溶液时,俯视刻度线定容会使溶液的体积偏小,导致所配溶液浓度偏大,故C正确;
D.由图可知,锌铜原电池中,锌电极为原电池的负极,铜为正极,盐桥中阳离子向硫酸铜溶液中迁移,故D错误;
故选C。
6.C
解析:A.Cu2+显蓝色,无色透明的溶液中有颜色的离子不能存在,A不符合题意;
B.遇紫色石蕊试液变红说明有大量存在,HCO与H+反应生成CO2和H2O,B不符合题意;
C.该组离子不反应,且可与大量氢离子共存,C符合题意;
D.CO与Mg2+、Ca2+均会生成沉淀,且不能与大量共存,D不符合题意;
故选C。
7.B
解析:A.量筒的最小读数为0.1mL,应该使用酸式滴定管量取20.00mL未知浓度盐酸,故A错误;
B.a点溶液的pH<7,此时溶液呈酸性,则c(H+)>c(OH﹣),结合电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)可知:c(Na+)C.用氢氧化钠溶液滴定未知浓度的盐酸,滴定达到终点时,溶液颜色应该由无色变为粉色,故C错误;
D.结合图示可知,滴定终点时消耗20.00mL 0.1000mol L﹣1NaOH溶液,未知浓度的盐酸体积为20.00mL,根据关系式NaOH~HCl可知,未知盐酸的物质的量浓度与氢氧化钠溶液的浓度相等,也是0.100mol L﹣1,故D错误;
故选:B。
【点睛】本题考查中和滴定,明确图示曲线变化的意义为解答关键,注意掌握电荷守恒及滴定终点的判断方法,试题侧重考查学生的分析能力及化学实验能力,题目难度不大。
8.B
解析:A.浓盐酸与漂白粉反应可生成氯气,可选图中固液反应装置制备,故A正确;
B.HCl与碳酸氢钠溶液反应生成二氧化碳,氯气中引入新杂质,不能除杂,应选饱和食盐水洗气,故B错误;
C.Cl2氧化K2MnO4可生成KMnO4,可选装置丙使K2MnO4转化成KMnO4,故C正确;
D.二氧化锰不溶于水,可选图中过滤装置分离,故D正确;
故选:B。
9.C
解析:A.工业上将Cl2通入石灰乳中制漂白粉:,故A错误;
B.磁性氧化铁为,溶于盐酸离子方程式为,故B错误;
C.溶液与过量溶液混合,生成偏铝酸钠,离子方程式为,故C正确;
D.向溶液中通入过量,离子方程式为,故D错误;
故答案选C
10.C
解析:A.向Ca(HCO3)2溶液中加入少量NaOH溶液生成碳酸钙和水,离子方程式为:Ca2+++OH-=CaCO3↓+H2O,故A错误;
B.向CaCl2溶液中通入CO2不会有碳酸钙沉淀生成,故B错误;
C.SO2通入双氧水中发生氧化还原反应生成硫酸根,离子方程式为:SO2+H2O2=2H++SO,故C正确;
D.稀H2SO4与Ba(OH)2溶液反应生成硫酸钡沉淀和水,离子方程式为:2H++SO+Ba2++2OH-=BaSO4↓ +2H2O,故D错误;
故选C。
二、填空题
11.(1) ⑤⑦ ②④⑤⑥
(2)NaHSO4=Na++H++SO HNO3=H++NO
(3)Mg(OH)2+2H+=Mg2++2H2O HCO+H+=H2O+CO2↑
【分析】①NH3是非电解质,②Cu是单质,③乙醇是非电解质,④石墨是单质,⑤熔融NaCl是电解质,⑥CuCl2溶液是混合物,⑦Na2O是电解质,⑧CO2是非电解质。
解析:(1)A.由以上分析可知,属于电解质的是⑤熔融NaCl和⑦Na2O;
B. 金属、石墨、有自由移动阴阳离子的可以导电,故为②④⑤⑥;
(2)NaHSO4在水溶液中完全电离,生成Na+、H+、,电离方程式为NaHSO4=Na++H++;HNO3在水中发生完全电离,生成H+和,电离方程式为HNO3=H++;
(3)氢氧化镁固体溶于足量稀盐酸生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;碳酸氢钠溶液与稀盐酸混合生成氯化钠、水和二氧化碳,离子方程式为+H+=H2O+CO2↑。
12.(1)移液管(或酸式滴定管)
(2)92%
(3)BD
解析:(1)移取溶液时所使用的玻璃仪器为移液管(或酸式滴定管);
(2)滴定时有关系:Zn3(PO4)2·4H2O~3Zn2+~3Na2H2Y,消耗Na2H2Y物质的量为27.60×10-3 L×0.020 00 mol·L-1=5.52×10-4 mol,则样品中含有Zn3(PO4)2·4H2O的物质的量为×=9.2×10-4 mol,则产品中Zn3(PO4)2·4H2O的质量分数为×100%=92%。
(3)A.步骤Ⅰ中定容时俯视刻度线,导致产品浓度偏高,测定值偏高;
B.步骤Ⅰ中转移溶液时未洗涤烧杯,导致产品浓度偏低,测定值偏低;
C.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗,所需标准液体积偏高,测定值偏高;
D.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡,所需标准液体积偏低,测定值偏低;
故选BD。
13.(1),
(2) 水解呈酸性
(3) 的还原性
解析:(1)将氨与氯气混合时的反应方程式:,,氯化铵是固体小颗粒,所以会产生白烟。
(2)水解使溶液显酸性,能和氢离子作用生成氢氧化铝沉淀,并有弱电解质NH3 H2O生成,NH3 H2O分解会以氨气的形式从溶液中分离出来,离子方程式为:。
(3)饱和氯化铵与亚硝酸钠反应生成N2,N元素由-3价上升到0价,又由+3价下降到0价,根据得失电子守恒和原子守恒配平方程式为:,中N元素化合价上升,体现了其还原性。
14.(1)CH4(g)+O2(g)=CH3OH(g) H=-164kJ mol-1
(2)+53.1
(3)Ba2+ + OH-+ H++= BaSO4↓+ H2O
(4)5.0
解析:(1)①
②
③
利用盖斯定律,将反应①+②+③×得,甲烷和氧气合成液态甲醇的热化学方程式:CH4(g)+O2(g)=CH3OH(g) H=(206.1-128.3-483.6×) kJ mol-1=-164kJ mol-1。答案为:CH4(g)+O2(g)=CH3OH(g) H=-164kJ mol-1;
(2)①
②
利用盖斯定律,将反应①×-②得,反应的△H=(-4.4×+55.3) kJ mol-1=+53.1 kJ mol-1。答案为:+53.1;
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,则反应生成等摩尔的BaSO4、H2O、NaOH,离子方程式是Ba2+ + OH-+ H++= BaSO4↓+ H2O。答案为:Ba2+ + OH-+ H++= BaSO4↓+ H2O;
(4)质量分数为98%,密度为的浓H2SO4,物质的量浓度为mol/L=18mol/L,配制450 mL浓度为的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是=5.0mL。答案为:5.0。
【点睛】物质的量浓度与密度、质量分数之间的关系为:。
15.NH CO、SO Mg2+、Ba2+、Fe3+ HCO 向溶液B中通入氯气,溶液呈浅黄绿色(或向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀) 0.1mol·L-1
【分析】待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO、SO,向沉淀A中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO和SO,根据离子共存知,溶液中不存在Mg2+、Ba2+、Fe3+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH、HCO,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br ,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl ,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl ,据此分析解答。
解析:(1)由滤液A加入NaOH反应生成气体B,则B肯定为NH3,则由此可以确定待测液中含有的离子是NH;
(2)待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO、SO,向沉淀A中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO和SO,根据离子共存知,溶液中不存在Mg2+、Ba2+、Fe3+;
(3)滤液A中有Ba2+,加入过量的NaOH溶液得到白色沉淀B,则溶液中一定有HCO,发生反应HCO+OH-= CO+H2O,Ba2+与CO结合生成BaCO3沉淀,则由白色沉淀B可确定待测液中含有的离子是HCO;
(4)由图中信息可知,滤液B中通入氯气,得浅黄绿色溶液,则溶液中一定没有Br ,且向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀,也能说明溶液中一定没有Br ;
(5)根据元素守恒可知:n(CO)=、n(SO)=、n(HCO)=、n(NH)=;根据溶液呈电中性,有:2×n(SO)+n(HCO)+2×n(CO)=2×0.05mol+0.1mol+2×0.1mol=0.4mol,n(NH)+n(Na+)=0.1mol+1L×0.2mol L-1=0.3mol;由于阳离子所带的正电荷总数小于负电荷总数,所以一定含有阳离子K+;若原溶液中不存在Cl ,则K+的物质的量是0.4mol-0.3mol=0.1mol,K+浓度是c(K+)=,若存在Cl ,则K+的浓度应该大于0.1 mol·L 1,故待测液中K+的最小浓度为0.1 mol·L 1。
16.(1) 2.2×10-6 mol·L-1 +5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O
(2)CD K2Cu(C2O4)2·2H2O
解析:(1)①c(Cu2+)=;②离子方程式为+5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O;
(2)①A.锥形瓶水洗后未干燥,对实验误差无影响,A选项错误;B.滴定时锥形瓶中有液体溅出,消耗EDTA标准液偏小,B选项错误;C.装EDTA标准溶液的滴定管水洗后未润洗,装入溶液被稀释,消耗标准液体积偏大,C选项正确;D.开始滴定时,滴定管尖嘴部分未充满液体,V始偏小,消耗标注液ΔV偏大,D选项正确;答案选CD;②根据Cu2+与EDTA反应的化学计量数关系可知样品中n(Cu2+)=n(EDTA)=0.05000××=0.005000mol,则样品中n(K+)=,n(K+):n(Cu2+)=2:1,设草酸合铜酸钾的化学式为K2Cu(C2O4)x,其中K为+1,Cu为+2,根据化合价代数和为0可得x=2,则样品中 n(C2O)=0.01000mol,样品中n(H2O)=,通过计算确定得该样品的化学式为K2Cu(C2O4)2·2H2O
一、选择题
1.下列实验操作或实验仪器的使用错误的是
A.用剩的药品均不能放回原瓶
B.用pH计测量溶液的pH
C.用酸式滴定管量取高锰酸钾溶液
D.洗净的锥形瓶和容量瓶不需要干燥
2.下列离子方程式书写正确的是
A.将固体投入中:
B.在海带灰的浸出液(含有)中滴加双氧水得到:
C.溶液与足量的NaOH溶液反应:
D.向溶液中滴加少量稀硫酸:
3.根据下列装置和物质,能达到相应实验目的的是
A.分离碘和酒精 B.进行酸碱中和滴定 C.验证铁钉能发生析氢腐蚀 D.制备
A.A B.B C.C D.D
4.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3 6H2O步骤:用H2O2氧化废蚀刻液、制备氨气、制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离、用盐酸溶解沉淀并制备FeCl3 6H2O。下列有关实验的说法不正确的是
A.用装置甲制备氨气
B.用装置乙可以制备Cu(NH3)4Cl2溶液并沉铁
C.用装置丙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D.用装置丁蒸干FeCl3溶液可以直接制备FeCl3 6H2O
5.下列说法正确的是
A.图①装置可用于制取并收集氨气
B.图②操作可排出盛有溶液滴定管尖嘴内的气泡
C.图③操作俯视刻度线定容会导致所配溶液浓度偏大
D.图④装置盐桥中阳离子向溶液中迁移
6.某无色透明溶液遇紫色石蕊试液变红,下列各组离子能在该溶液中大量共存的是
A.Na+、Cu2+、NO、Cl- B.K+、SO、HCO、Na+
C.NH、NO、K+、Ba2+ D.Mg2+、CO、NO、Ca2+
7.如图是用0.1000mol L-1NaOH溶液滴定20.00mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
A.需使用量程为20mL的量筒量取盐酸
B.a点时,c(Na+)
D.盐酸的物质的量浓度为0.0100mol L-1
8.某同学利用氧化制备,已知锰酸钾()在浓的强碱溶液中可稳定存在,碱性碱弱时易发生反应:。下列装置不能达到实验目的的是
A.用装置甲制取
B.用装置乙除去中的HCl
C.用装置丙使转化成
D.用装置丁分离出溶液中的
9.下列离子方程式的书写正确的是
A.工业上用氯气通入到石灰乳中制漂白粉:
B.磁性氧化铁溶于盐酸:
C.溶液与过量溶液混合:
D.向溶液中通入过量:
10.下列离子方程式与所述事实相符且正确的是
A.向Ca(HCO3)2溶液中加入少量NaOH溶液: Ca2++2+2OH-=CaCO3↓+CO2↑+2H2O
B.向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+
C.SO2通入双氧水中:SO2+H2O2=2H++SO
D.稀H2SO4与Ba(OH)2溶液反应:H++SO+Ba2++OH-=BaSO4↓+ +H2O
二、填空题
11.回答下列问题:
(1)下列物质中:①NH3 ②Cu ③乙醇 ④石墨 ⑤熔融NaCl ⑥CuCl2溶液 ⑦Na2O ⑧CO2。
A.属于电解质的是 (只填序号,下同)。
B.所给状态下能导电的是 。
(2)写出下列电解质在水中的电离方程式:
NaHSO4 ;
HNO3 ;
(3)写出下列物质间反应的离子方程式:
氢氧化镁固体溶于足量稀盐酸: ;
碳酸氢钠溶液与稀盐酸混合: 。
12.为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2-按1∶1反应。
步骤Ⅰ:准确称取0.457 0 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH=5~6的缓冲溶液中用0.020 00 mol·L-1 Na2H2标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
(1)步骤Ⅱ中移取溶液时所使用的玻璃仪器为 ;
(2)产品中Zn3(PO4)2·4H2O的质量分数为 ;
(3)下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________。
A.步骤Ⅰ中定容时俯视刻度线
B.步骤Ⅰ中转移溶液时未洗涤烧杯
C.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗
D.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
13.按要求回答下列问题
(1)将氨与氯气混合也会产生白烟,用化学方程式解释产生白烟的过程: 。
(2)在饱和溶液中滴加,产生刺激性气味的气体和白色沉淀,用离子方程式解释其现象: ,体现 。
(3)实验室常用饱和氯化铵与亚硝酸钠加热来制取氮气,写出发生反应的化学方程式: ,体现 。
14.填空。
(1)CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化。对开发新能源和降低碳排放意义重大。
已知:①
②
③
写出由甲烷和氧气合成液态甲醇的热化学方程式: 。
(2)已知:
则反应的△H= kJ mol-1。
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,化学反应的离子方程式是 。
(4)实验室现欲用质量分数为98%,密度为包的浓H2SO4溶液配制450 mL浓度为的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是 mL。
15.已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子 K+、NH、Mg2+、Ba2+、Fe3+
阴离子 Cl-、Br-、CO、HCO、SO
现进行如下实验操作(每次实验所加试剂均过量):
已知:NaHCO3+NaOH=Na2CO3+H2O
(1)由气体B可确定待测液中含有的离子是 。
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是 ,据此可以排除的离子是 。
(3)由白色沉淀B可确定待测液中含有的离子是 。
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是 。
(5)综合分析,待测液中K+的最小浓度为 。
16.草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)= 。
②已知H2C2O4是一种二元弱酸,实验室可以用酸性高锰酸钾溶液标定草酸溶液的浓度,其离子方程式为 。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.7700 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900 g。
步骤Ⅱ 准确称取1.7700 g样品,用NH3·H2O/NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.05000 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
第一次滴定 第二次滴定 第三次滴定
消耗EDTA标准溶液的体积/mL 25.92 24.99 25.01
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有 (填字母)。
A.锥形瓶水洗后未干燥
B.滴定时锥形瓶中有液体溅出
C.装EDTA标准溶液的滴定管水洗后未润洗
D.开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式 (写出计算过程)。
【参考答案】
一、选择题
1.A
解析:A.金属Na等易发生安全事故的试剂应放回原瓶,A错误;
B.溶液具有强氧化性,会漂白试纸,可以用pH计测量溶液的pH,B正确;
C.高锰酸钾溶液具有强氧化性,不可以使用碱式滴定管,否则会氧化橡胶,需要用酸式滴定管量取高锰酸钾溶液,C正确;
D.洗净的锥形瓶和容量瓶不需要干燥,有水残余不影响使用,D正确。
故选A。
2.D
解析:A.将固体投入中离子方程式:,A项错误;
B.海带灰的浸出液(含有)中滴加双氧水得到离子方程式:,B项错误;
C.溶液与足量的NaOH溶液反应离子方程式:,C项错误;
D.向溶液中滴加少量稀硫酸离子方程式:,D项正确;
故选D。
3.D
解析:A.碘易溶于酒精,无法通过分液操作将碘和酒精分离,A错误;
B.氢氧化钠溶液应装在碱式滴定管中,B错误;
C.食盐水浸泡过的铁钉和空气接触,发生的是吸氧腐蚀,不是析氢腐蚀,C错误;
D.氨气,二氧化碳通入饱和氢化钠溶液中生成碳酸氢钠沉淀和氯化铵,过滤得到碳酸氢钠晶体,D正确;
故选D。
4.D
解析:A.NH4Cl和Ca(OH)2固体加热制备NH3,A项正确;
B.NH3可将CuCl2转变为Cu(NH3)4Cl2液,同时将Fe3+转变为Fe(OH)3沉淀,B项正确;
C.Cu(NH3)4Cl2溶液和Fe(OH)3为固液混合体系,可选用过滤如图丙,C项正确;
D.FeCl3在加热条件下水解加剧得到Fe(OH)3,所提直接如图丁蒸干得到Fe(OH)3,D项错误;
故选D。
5.C
解析:A.氯化铵受热分解生成氨气和氯化氢,遇冷又化合生成氯化铵,则直接加热氯化铵无法制得氨气,实验室用加热氯化铵和氢氧化钙固体的方法制备氨气,故A错误;
B.高锰酸钾溶液具有强氧化性,会腐蚀橡胶管,所以高锰酸钾溶液应盛放在酸式滴定管在,不能盛放在碱式滴定管中,故B错误;
C.配制一定物质的量浓度的溶液时,俯视刻度线定容会使溶液的体积偏小,导致所配溶液浓度偏大,故C正确;
D.由图可知,锌铜原电池中,锌电极为原电池的负极,铜为正极,盐桥中阳离子向硫酸铜溶液中迁移,故D错误;
故选C。
6.C
解析:A.Cu2+显蓝色,无色透明的溶液中有颜色的离子不能存在,A不符合题意;
B.遇紫色石蕊试液变红说明有大量存在,HCO与H+反应生成CO2和H2O,B不符合题意;
C.该组离子不反应,且可与大量氢离子共存,C符合题意;
D.CO与Mg2+、Ca2+均会生成沉淀,且不能与大量共存,D不符合题意;
故选C。
7.B
解析:A.量筒的最小读数为0.1mL,应该使用酸式滴定管量取20.00mL未知浓度盐酸,故A错误;
B.a点溶液的pH<7,此时溶液呈酸性,则c(H+)>c(OH﹣),结合电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)可知:c(Na+)
D.结合图示可知,滴定终点时消耗20.00mL 0.1000mol L﹣1NaOH溶液,未知浓度的盐酸体积为20.00mL,根据关系式NaOH~HCl可知,未知盐酸的物质的量浓度与氢氧化钠溶液的浓度相等,也是0.100mol L﹣1,故D错误;
故选:B。
【点睛】本题考查中和滴定,明确图示曲线变化的意义为解答关键,注意掌握电荷守恒及滴定终点的判断方法,试题侧重考查学生的分析能力及化学实验能力,题目难度不大。
8.B
解析:A.浓盐酸与漂白粉反应可生成氯气,可选图中固液反应装置制备,故A正确;
B.HCl与碳酸氢钠溶液反应生成二氧化碳,氯气中引入新杂质,不能除杂,应选饱和食盐水洗气,故B错误;
C.Cl2氧化K2MnO4可生成KMnO4,可选装置丙使K2MnO4转化成KMnO4,故C正确;
D.二氧化锰不溶于水,可选图中过滤装置分离,故D正确;
故选:B。
9.C
解析:A.工业上将Cl2通入石灰乳中制漂白粉:,故A错误;
B.磁性氧化铁为,溶于盐酸离子方程式为,故B错误;
C.溶液与过量溶液混合,生成偏铝酸钠,离子方程式为,故C正确;
D.向溶液中通入过量,离子方程式为,故D错误;
故答案选C
10.C
解析:A.向Ca(HCO3)2溶液中加入少量NaOH溶液生成碳酸钙和水,离子方程式为:Ca2+++OH-=CaCO3↓+H2O,故A错误;
B.向CaCl2溶液中通入CO2不会有碳酸钙沉淀生成,故B错误;
C.SO2通入双氧水中发生氧化还原反应生成硫酸根,离子方程式为:SO2+H2O2=2H++SO,故C正确;
D.稀H2SO4与Ba(OH)2溶液反应生成硫酸钡沉淀和水,离子方程式为:2H++SO+Ba2++2OH-=BaSO4↓ +2H2O,故D错误;
故选C。
二、填空题
11.(1) ⑤⑦ ②④⑤⑥
(2)NaHSO4=Na++H++SO HNO3=H++NO
(3)Mg(OH)2+2H+=Mg2++2H2O HCO+H+=H2O+CO2↑
【分析】①NH3是非电解质,②Cu是单质,③乙醇是非电解质,④石墨是单质,⑤熔融NaCl是电解质,⑥CuCl2溶液是混合物,⑦Na2O是电解质,⑧CO2是非电解质。
解析:(1)A.由以上分析可知,属于电解质的是⑤熔融NaCl和⑦Na2O;
B. 金属、石墨、有自由移动阴阳离子的可以导电,故为②④⑤⑥;
(2)NaHSO4在水溶液中完全电离,生成Na+、H+、,电离方程式为NaHSO4=Na++H++;HNO3在水中发生完全电离,生成H+和,电离方程式为HNO3=H++;
(3)氢氧化镁固体溶于足量稀盐酸生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;碳酸氢钠溶液与稀盐酸混合生成氯化钠、水和二氧化碳,离子方程式为+H+=H2O+CO2↑。
12.(1)移液管(或酸式滴定管)
(2)92%
(3)BD
解析:(1)移取溶液时所使用的玻璃仪器为移液管(或酸式滴定管);
(2)滴定时有关系:Zn3(PO4)2·4H2O~3Zn2+~3Na2H2Y,消耗Na2H2Y物质的量为27.60×10-3 L×0.020 00 mol·L-1=5.52×10-4 mol,则样品中含有Zn3(PO4)2·4H2O的物质的量为×=9.2×10-4 mol,则产品中Zn3(PO4)2·4H2O的质量分数为×100%=92%。
(3)A.步骤Ⅰ中定容时俯视刻度线,导致产品浓度偏高,测定值偏高;
B.步骤Ⅰ中转移溶液时未洗涤烧杯,导致产品浓度偏低,测定值偏低;
C.步骤Ⅱ中滴定管未用Na2H2Y标准溶液润洗,所需标准液体积偏高,测定值偏高;
D.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡,所需标准液体积偏低,测定值偏低;
故选BD。
13.(1),
(2) 水解呈酸性
(3) 的还原性
解析:(1)将氨与氯气混合时的反应方程式:,,氯化铵是固体小颗粒,所以会产生白烟。
(2)水解使溶液显酸性,能和氢离子作用生成氢氧化铝沉淀,并有弱电解质NH3 H2O生成,NH3 H2O分解会以氨气的形式从溶液中分离出来,离子方程式为:。
(3)饱和氯化铵与亚硝酸钠反应生成N2,N元素由-3价上升到0价,又由+3价下降到0价,根据得失电子守恒和原子守恒配平方程式为:,中N元素化合价上升,体现了其还原性。
14.(1)CH4(g)+O2(g)=CH3OH(g) H=-164kJ mol-1
(2)+53.1
(3)Ba2+ + OH-+ H++= BaSO4↓+ H2O
(4)5.0
解析:(1)①
②
③
利用盖斯定律,将反应①+②+③×得,甲烷和氧气合成液态甲醇的热化学方程式:CH4(g)+O2(g)=CH3OH(g) H=(206.1-128.3-483.6×) kJ mol-1=-164kJ mol-1。答案为:CH4(g)+O2(g)=CH3OH(g) H=-164kJ mol-1;
(2)①
②
利用盖斯定律,将反应①×-②得,反应的△H=(-4.4×+55.3) kJ mol-1=+53.1 kJ mol-1。答案为:+53.1;
(3)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,则反应生成等摩尔的BaSO4、H2O、NaOH,离子方程式是Ba2+ + OH-+ H++= BaSO4↓+ H2O。答案为:Ba2+ + OH-+ H++= BaSO4↓+ H2O;
(4)质量分数为98%,密度为的浓H2SO4,物质的量浓度为mol/L=18mol/L,配制450 mL浓度为的稀H2SO4溶液,用量筒量取所需浓H2SO4溶液的体积是=5.0mL。答案为:5.0。
【点睛】物质的量浓度与密度、质量分数之间的关系为:。
15.NH CO、SO Mg2+、Ba2+、Fe3+ HCO 向溶液B中通入氯气,溶液呈浅黄绿色(或向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀) 0.1mol·L-1
【分析】待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO、SO,向沉淀A中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO和SO,根据离子共存知,溶液中不存在Mg2+、Ba2+、Fe3+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH、HCO,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br ,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl ,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl ,据此分析解答。
解析:(1)由滤液A加入NaOH反应生成气体B,则B肯定为NH3,则由此可以确定待测液中含有的离子是NH;
(2)待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO、SO,向沉淀A中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO和SO,根据离子共存知,溶液中不存在Mg2+、Ba2+、Fe3+;
(3)滤液A中有Ba2+,加入过量的NaOH溶液得到白色沉淀B,则溶液中一定有HCO,发生反应HCO+OH-= CO+H2O,Ba2+与CO结合生成BaCO3沉淀,则由白色沉淀B可确定待测液中含有的离子是HCO;
(4)由图中信息可知,滤液B中通入氯气,得浅黄绿色溶液,则溶液中一定没有Br ,且向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀,也能说明溶液中一定没有Br ;
(5)根据元素守恒可知:n(CO)=、n(SO)=、n(HCO)=、n(NH)=;根据溶液呈电中性,有:2×n(SO)+n(HCO)+2×n(CO)=2×0.05mol+0.1mol+2×0.1mol=0.4mol,n(NH)+n(Na+)=0.1mol+1L×0.2mol L-1=0.3mol;由于阳离子所带的正电荷总数小于负电荷总数,所以一定含有阳离子K+;若原溶液中不存在Cl ,则K+的物质的量是0.4mol-0.3mol=0.1mol,K+浓度是c(K+)=,若存在Cl ,则K+的浓度应该大于0.1 mol·L 1,故待测液中K+的最小浓度为0.1 mol·L 1。
16.(1) 2.2×10-6 mol·L-1 +5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O
(2)CD K2Cu(C2O4)2·2H2O
解析:(1)①c(Cu2+)=;②离子方程式为+5H2C2O4+6H+=2Mn2+ +10CO2↑+8H2O;
(2)①A.锥形瓶水洗后未干燥,对实验误差无影响,A选项错误;B.滴定时锥形瓶中有液体溅出,消耗EDTA标准液偏小,B选项错误;C.装EDTA标准溶液的滴定管水洗后未润洗,装入溶液被稀释,消耗标准液体积偏大,C选项正确;D.开始滴定时,滴定管尖嘴部分未充满液体,V始偏小,消耗标注液ΔV偏大,D选项正确;答案选CD;②根据Cu2+与EDTA反应的化学计量数关系可知样品中n(Cu2+)=n(EDTA)=0.05000××=0.005000mol,则样品中n(K+)=,n(K+):n(Cu2+)=2:1,设草酸合铜酸钾的化学式为K2Cu(C2O4)x,其中K为+1,Cu为+2,根据化合价代数和为0可得x=2,则样品中 n(C2O)=0.01000mol,样品中n(H2O)=,通过计算确定得该样品的化学式为K2Cu(C2O4)2·2H2O
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
