专题1 物质的分类及计量 单元检测题 (含解析)2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题1 物质的分类及计量 单元检测题 (含解析)2023-2024学年高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 185.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 00:00:00 | ||
图片预览




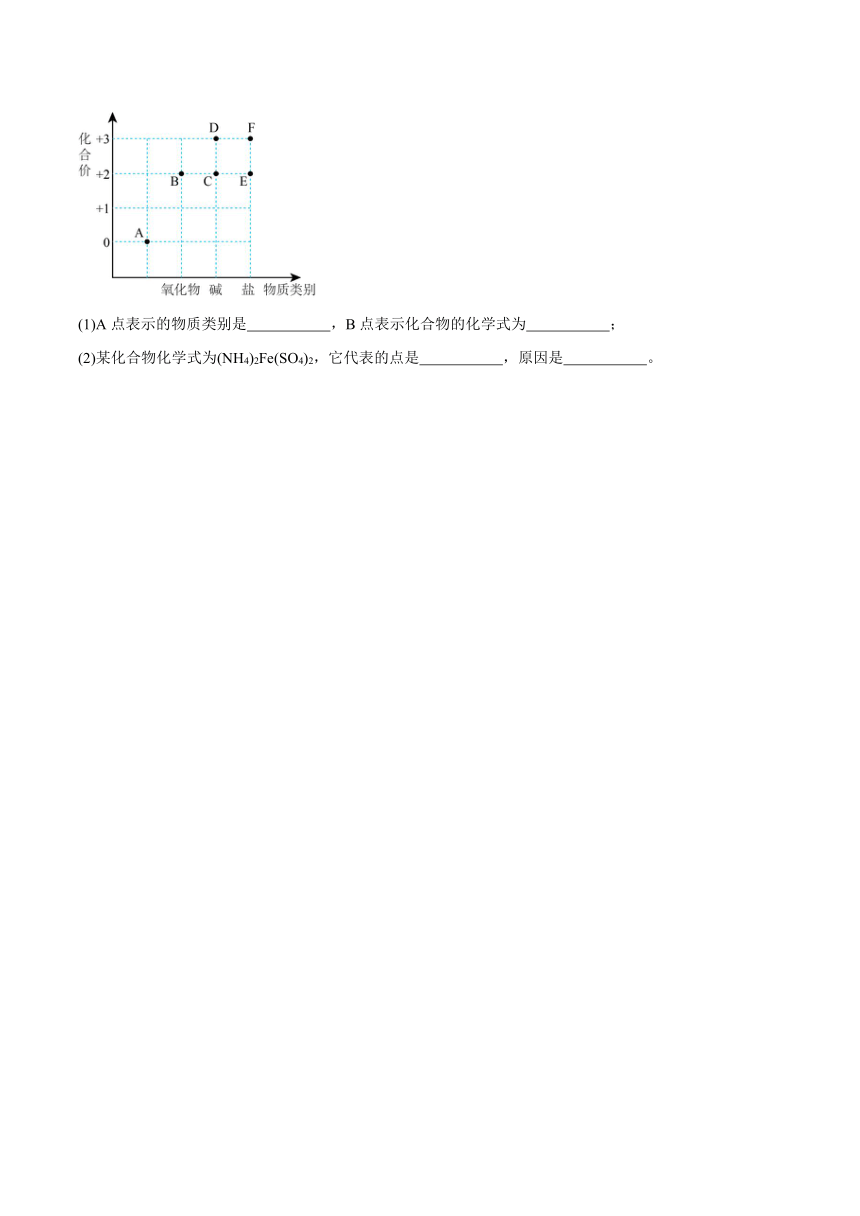
文档简介
专题1《物质的分类及计量》单元检测题
一、单选题(共20题)
1.化学与生产、生活、社会密切相关,下列说法错误的是
A.“卤水点豆腐”属于蛋白质变性
B.绿色化学的核心思想是改变“先污染、后治理”的观念和做法
C.含氮、磷元素的大量污水任意排入近海水域,会出现水华、赤潮等水体污染问题
D.地沟油可以用来制造肥皂
2.下列关于胶体的说法不正确的是
A.胶体可以产生丁达尔效应 B.胶体粒子直径为1~100nm
C.胶体粒子可以通过半透膜 D.胶体粒子是分子的聚合体
3.
代表阿伏加德罗常数的值,以下说法正确的是
A.2个HCl分子与44.8L 和的混合气体所含的原子数目均为4
B.物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA
C.78g Na2O2与足量水反应转移的电子数为NA
D.22.4L(标准状况)H2O所含的质子数为10NA
4.下列物质的分类不正确的是
A.烧碱、纯碱、熟石灰都属于碱
B.H2SO4、HClO、H2CO3都属于酸
C.CuO、Na2O2和干冰都属于氧化物
D.NaHCO3、CuSO4·5H2O和KMnO4都属于盐
5.卫生部明令禁止在面粉中添加,从氧的价态角度进行分类,与属于同一类的是
A. B. C. D.
6.下列说法正确的是
A.2 mol Al的质量是54 g/mol
B.CO2的摩尔质量是44g/mol
C.标况下,22.4 L 酒精的物质的量为1mol
D.0.5 mol/L Na2SO4 的物质的量为0.5mol
7.设为阿伏加 德罗常数的值,下列说法不正确的是
A.1mol分子中含有的原子总数为6
B.500mL的NaCl溶液中微粒数大于0.5
C.30g HCHO与混合物中含C原子数为
D.加热条件下,2.3g Na与完全反应,生成0.2个
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1L 0.5mol/L CH3COOH溶液中含有的氢离子数为0.05NA
B.常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1NA
C.22.4 L(标准状况)氩气含有的质子数为18NA
D.标准状况下,4.48 L CCl4含有的共价键数为0.8NA
9.已知标准状况下,气体X的密度为1.25gL-1,则下列关于X的说法错误的是
A.X的相对分子质量为28 B.X可能含有两种元素
C.X一定是纯净物 D.X可能是N2
10.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.在1 L 0.1 mol·L-1的碳酸钠溶液中,氧原子总数为0.3 NA
B.常温常压下,32 g O2-中所含电子的数目为20 NA
C.物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
D.标准状况下,11.2LSO3中含有分子的数目为0.5 NA
11.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L的H2和22.4L的H2O气混合后,气体分子数为2NA
B.0.5molAl与足量盐酸反应转移电子数为NA
C.46gNO2和N2O4的混合物含有的分子数为NA
D.向Na2O2通入足量的水蒸气,固体质量增加bg,该反应转移电子数为
12.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.2.0L1.0mol L-1的酸性KMnO4溶液中含有的氧原子数为8NA
B.5.6克Fe完全参与化学反应,一定转移0.3NA个电子
C.标准状况下,11.2L14CO2含有的中子数为13NA
D.1molFeCl3与沸水完全反应制得的氢氧化铁胶粒数目为NA
13.NA代表阿伏加 德罗常数,下列叙述错误的是( )
A.18g金刚石中,碳碳共价键数为3NA
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.一定温度下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
14.下列转化关系不能通过一步反应实现的是
A.Fe→FeCl2 B.Fe2O3→Fe(OH)3
C.FeCl3→FeCl2 D.Fe(OH)3→Fe2O3
15.英国科学家希尔发现,离体的叶绿体悬浮液中加入适当的电子受体(如草酸铁),在光照时可使水分解而释放氧气,从而证明了氧的释放与CO2还原是不同的过程,将对光合作用的研究上升到细胞层面。该反应方程式为4Fe3++2H2O4Fe2++4H++O2↑,下列有关希尔反应说法错误的是
A.水在光反应中起供氢体和供电子体双重作用
B.反应后溶液pH减小
C.生成11.2L O2时,Fe3+得电子数为2NA
D.叶绿体本身起催化剂作用,光起供能作用
16.下列物质按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A.淀粉、CuO、HClO、Cu
B.水玻璃、Na2O·CaO·6SiO2、CH3COOH、SO3
C.KAl(SO4)2·12H2O、KClO3、NH3·H2O、CH3CH2OH
D.普通玻璃、H2O、Fe(SCN)3、葡萄糖
17.假设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.1molCl2与足量的铁反应转移的电子数是3NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
C.7.8g Na2O2中含有阴离子数目为0.1NA,与足量水反应时电子转移了0.1NA
D.标准状况下33.6L四氯化碳含有的分子数为1.5NA
18.化学与生产、生活、社会、环境密切相关,下列说法中正确的是
A.铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品
B.明矾净水过程中只涉及了物理变化
C.向氢氧化铁胶体中滴加稀硫酸,开始有红褐色沉淀生成,最终沉淀会完全溶解
D.溶于水能导电,故是电解质
19.下列叙述中,正确的是
A.的质量为
B.二氧化碳的摩尔质量是44g
C.1mol任何物质的质量等于该物质的相对分子质量
D.的摩尔质量是
20.当光束通过下列分散系时,能观察到丁达尔效应的是
A.NaOH溶液 B.NaCl溶液 C.K2SO4溶液 D.Fe(OH)3胶体
二、非选择题(共4题)
21.(1)44.4 g某二价金属氯化物( ACl2)中含有0.8molCl-,则ACl2的摩尔质量是 。A的相对原子量是 ,ACl2的化学式是 。
(2)同温同压下,同体积的气体X2和气体Y2完全反应生成气体Z,且反应前后气体体积不变,则Z的化学式为 。
22.相同物质的量的CO2和O2,其分子数之比为 ,原子数之比为 ,氧原子数之比为 ;质量相同的CO2和O2,其物质的量之比为 。
23.A、B、C、D、E、F、G七种物质都是日常生活和生产中常见的物质,各物质间存在如下转化关系(反应的条件已省略)
已知:B、C两种物质在不同情况下可分别发生①和②两个反应;A-G七种物质都是由非金属元素组成的,其中只有一种物质是盐,一种物质是单质;且B的相对分子质量大于C。
(1)请写出下列物质的化学式:A ;G ;
(2)请写出E+F→B+C的化学方程式: 。
24.如图为铁元素的“价—类”二维图,请分析后填写:
(1)A点表示的物质类别是 ,B点表示化合物的化学式为 ;
(2)某化合物化学式为(NH4)2Fe(SO4)2,它代表的点是 ,原因是 。
参考答案:
1.A
A.胶体遇电解质溶液可发生聚沉,“卤水点豆腐”的原理是Mg2+、Ca2+等离子使蛋白质胶体发生聚沉,不是变性,故A错误;
B.绿色化学的核心是要利用化学原理从源头消除污染,实现零排放,而不是对环境污染进行治理,故B正确;
C.含氮、磷的化合物排放到水中会使水体出现富营养化,使某些藻类迅速繁殖,从而造成水体缺氧,使其他水生生物因缺氧而死亡,破坏生态系统,故C正确;
D.“地沟油”的成分是油脂,可从地沟油中提炼出油脂作为生物柴油,碱性条件下的水解反应生成肥皂,故D正确;
故选:A。
2.C
A.丁达尔效应就是胶体的特殊性质 ,A正确;
B.胶体的分散系粒子直径大小在1-100nm,B正确;
C.胶体粒子不能通过半透膜,C错误;
D. 胶体粒子是分子的聚合而成的大分子集合体,D正确;
故选C。
3.C
A.H2和Cl2的混合气体所处的状态不明确,其物质的量不能计算,故A错误;
B.溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C.78g Na2O2的物质的量为=1mol, Na2O2与足量水反应生成NaOH和O2,转移的电子数为NA,故C正确;
D.H2O在标况下不是气体,不能计算22.4L(标准状况)H2O的物质的量,故D错误;
正确答案是C。
4.A
A、纯碱是碳酸钠,属于盐,A错误;
B、H2SO4、HClO、H2CO3三者都是酸,B正确;
C、氧化物是含有两种元素其中一种为氧元素的化合物,C正确;
D、盐是金属阳离子或铵根离子与酸根离子构成的化合物,NaHCO3、CuSO4·5H2O和KMnO4三者都是盐,D正确;
答案为A。
5.B
A.是超氧化物,不是过氧化物,A不选;
B.和中氧元素的价态均为-1价,都属于过氧化物,B选;
C.中氧元素为-2价,不是过氧化物,C不选;
D.是两性氧化物,不是过氧化物,D不选;
故选B。
6.B
A.2 mol Al的质量是2mol×27g/mol=54 g,A错误;
B.CO2的相对分子质量是44,其摩尔质量是44g/mol,B正确;
C.标况下酒精是液体,22.4 L 酒精的物质的量不是1mol,C错误;
D.0.5 mol/L Na2SO4 溶液的体积未知,无法计算物质的量,D错误;
答案选B。
7.D
A.1个分子中包含6个原子,故1mol分子中含有的原子总数为6,A项正确;
B.500mL的NaCl溶液中含有的微粒包括、、、、,故微粒数大于0.5,B项正确;
C.HCHO和的最简式均为,故30g HCHO和混合物中含“”的物质的量为1mol,含C原子数为,C项正确;
D.加热条件下,2.3g Na与完全反应,生成0.05个,D项不正确;
故选D。
8.C
A.醋酸是弱酸部分电离,0.1L0.5mol/LCH3COOH溶液中含有的氢离子数小于0.05NA,选项A错误;
B.溶液体积未知,无法计算0.5 mol·L-1Fe2(SO4)3溶液中含的Fe3+数,选项B错误;
C.22.4 L(标准状况)氩气的物质的量为1mol,1mol氩气分子中含有1molAr原子,含有18mol质子,含有的质子数为18NA,选项C正确;
D.标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,选项D错误;
答案选C。
9.C
X的密度为1.25gL-1,,M=1.25gL-1×22.4L/mol=28g/mol,据此分析解题。
A.摩尔质量与相对分子质量在数值上相同,所以相对分子质量为28,A正确;
B.相对分子质量为28的气体有:N2、CO、C2H4,B正确;
C.该气体可能是纯净物也可能是混合物,C错误;
D.X可能是N2、CO、C2H4,或者其中的混合气体,D正确;
答案选C。
10.B
A.在1 L 0.1 mol·L-1的碳酸钠溶液中,碳酸钠含有氧原子数为1L×0.1mol·L-1×3×NA/mol=0.3 NA,但水分子中也含有氧原子,故溶液中含有氧原子数大于0.3 NA,故A错误;
B.32g O2-中所含电子的数目为32g ÷16g/mol×10×NA /mol=20 NA,故B正确;
C.题目未给溶液体积,无法计算离子的物质的量,故C错误;
D.标准状况下,SO3不是气体,无法使用22.4L/mol计算物质的量,故D错误;
故答案选B。
11.D
A.标准状况下水是液态,无法确定分子数,故A错误;
B.铝元素化合价由0变为+3,故0.5molAl与足量盐酸反应转移电子1.5mol,数目为1.5NA,故B错误;
C.1molNO2的质量为46g,故46gNO2和N2O4的混合物的分子数小于NA,故C错误;
D.Na2O2与水蒸气反应,,固体增重的质量实际为H2的质量,固体质量增加bg,则反应过氧化钠为,电子转移关系为2Na2O2~2e-,故转移电子数为,故D正确;
故选D。
12.C
A.溶液中除了高锰酸钾含O原子,水中也含O原子,则的酸性溶液中含有的氧原子数大于,故A错误;
B.Fe遇到弱氧化剂时,失去2个电子,转化成价化合物,Fe遇到强氧化剂时,失去3个电子,转化成价化合物,故B错误;
C.一个含有的中子数为26,标准状况下,为个分子,所以含有的中子数为,故C正确;
D.氢氧化铁胶粒是氢氧化铁的聚集体,所以完全反应得到的氢氧化铁胶粒数目小于,故D错误;
选C。
13.D
A. 18g金刚石中含有1.5molC,金刚石中每个C与其它4个C形成了4个碳碳键,根据均摊法,每个C形成的共价键为:=2,所以1.5molC形成的共价键的物质的量为3mol,碳碳共价键数为3NA,A项正确;
B. 32g氧气的物质的量为1mol,在H2O2+Cl2=2HCl+O2反应中,双氧水中氧元素化合价为-1价,每生成1mol氧气,则转移2mol电子,转移了2NA个电子,B项正确;
C. 6.4gS2和S8的混合物中含有硫原子的物质的量为0.2mol,所含硫原子数一定为0.2NA,C项正确;
D. 1L 0.50mol·L-1 NH4Cl溶液与2L 0.25 mol·L-1 NH4Cl溶液中,前者铵根离子浓度大于后者,前者铵根离子水解程度小于后者,所以溶液中铵根离子的物质的量前者大于后者,D项错误;
答案选D。
14.B
A.Fe和氯化铁反应生成FeCl2,A不符合;
B.Fe2O3不溶于水,不能直接转化为Fe(OH)3,B符合;
C.FeCl3和铁反应生成FeCl2,C不符合;
D.Fe(OH)3受热分解生成Fe2O3,D不符合;
答案选B。
15.C
A.反应中水中氧元素失去电子生成氧气,且生成氢离子,在光反应中起供氢体和供电子体双重作用,故A正确;
B.根据离子方程式可知生成氢离子,则反应后溶液pH减小,故B正确;
C.O元素化合价由-2价升高到0价,则每生成1mol O2转移4mol电子,生成标准状况下11.2L O2时,及0.5mol,转移2mol电子,则Fe3+得电子数为2NA,但选项中未注明是否为标准状况,故C错误;
D.由方程式可知叶绿体为催化剂,光提供反应所需的能量,故D正确;
综上所述答案为C。
16.D
A.Cu为单质,既不是电解质也不是非电解质,A不合题意;
B.Na2O·CaO·6SiO2是玻璃的主要成分,属于混合物,B不合题意;
C.KAl(SO4)2·12H2O属于纯净物,KClO3属于盐,C不合题意;
D.普通玻璃为混合物,H2O为氧化物,Fe(SCN)3为弱电解质,葡萄糖为非电解质,D符合题意;
故选D。
17.C
A.1molCl2与足量的铁反应,Fe过量,以氯气来算,转移的电子数是2NA,A错误;
B.物质的量浓度为0.5mol/L的MgCl2溶液,由于不知道体积,所以无法确定含有Cl 个数,B错误;
C.7.8g Na2O2的物质的量是0.1mol,过氧化钠有钠离子和过氧根离子构成,含阴离子数目为0.1NA,过氧化钠与水反应生成了氢氧化钠,-1价的氧元素被还原为-2,同时又被氧化为0价,所以转移的电子数为0.1NA,C正确;
D.标准状况下四氯化碳为液体,D错误,
答案选C。
18.C
A.金属铝既能和酸反应又能和碱反应,不能盛放酸性或碱性食品,也不能长期盛放腌制食品,里面有氯化钠,会形对铝制容器进行腐蚀,故A错误;
B.明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中的杂质,该过程涉及了化学变化,故B错误;
C.盐酸是电解质溶液,氢氧化铁胶体遇到盐酸,胶体发生聚沉,生成氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸反应生成氯化铁,故C选项正确;
D.溶于水能导电是因为氨气与水反应生成一水合氨电解质,一水合氨电离产生自由移动的离子,氨气本身不能电离产生自由移动的离子,所以不是电解质,故D错误。
故选C选项。
19.D
A.的质量为32g,故A错误;
B.二氧化碳的摩尔质量是,故B错误;
C.1mol物质的质量在以克为单位时等于该物质的相对分子质量或相对原子质量,故C错误;
D.的相对分子质量为96,所以的摩尔质量为96 ,故D正确。
故选D。
20.D
丁达尔效应为当光束通过胶体时,能产生一条光亮的通路;A、B、C均为溶液,通过溶液时无此现象,光通过Fe(OH)3胶体时产生丁达尔效应,答案为D。
21. 40 CaCl2 XY或YX
按定义、结合阿伏加德罗定律、质量守恒定律求解;
(1)44.4 g某二价金属氯化物( ACl2)中含有0.8molCl-,则ACl2的物质的量为0.4mol,摩尔质量。ACl2的相对分子质量为111,A的相对原子量是40,ACl2的化学式是CaCl2。
(2)按阿伏加德罗定律:同温同压下,同体积的气体X2和气体Y2的物质的量、分子数相同,完全反应生成气体Z,且反应前后气体体积不变,则反应后生成Z的物质的量等于混合气体的物质的量,结合质量守恒定律知,该化学方程式为:X2+Y2=2Z,Z的化学式为XY或YX。
22. 1:1 3:2 1:1 8:11
由分子数可知,相同物质的量的CO2和O2,其分子数之比为1:1;CO2与O2的原子数为3:2,因此相同物质的量的的CO2和O2,其原子数之比为3:2;CO2与O2的氧原子数为1:1,因此相同物质的量的的CO2和O2,其氧原子数之比为1:1;设质量为m,质量相同的CO2和O2,其物质的量之比为=8:11。
23.(1) NH4HCO3 H2CO3
(2)C6H12O6+6O26CO2+6H2O
A、B、C、D、E、F、G七种物质都是日常生活和生产中常见的物质,七种物质都是由非金属元素组成的,其中只有一种物质是盐,则该种物质一定为铵盐,假设为碳酸氢铵,碳酸铵氢加热分解生成氨气、水和二氧化碳;二氧化碳和水反应生成碳酸,在一定条件可生成葡萄糖;碳酸分解又生成二氧化碳和水,葡萄糖和氧气在一定条件下生成二氧化碳和水,代入验证符合转化关系;所以A为碳酸氢铵,B为二氧化碳,C为水,D为氨气,G为碳酸;
(1)根据分析可得,A为NH4HCO3;G为H2CO3;
(2)E+F→B+C的反应是葡萄糖和氧气在一定条件下生成二氧化碳和水,化学方程式为C6H12O6+6O26CO2+6H2O。
24.(1) 单质 FeO
(2) E (NH4)2Fe(SO)2为盐,其中铁元素的价态为+2价
(1)由铁的价类图可知,A处物质的化合价为0,单质中元素的化合价为0,则A点表示的物质类别是单质;B处为+3价铁的氧化物,即为氧化铁,氧化铜的颜色为红棕色;答案为单质;FeO;
(2)(NH4)2Fe(SO)2是由金属离子和酸根离子构成的化合物,属于盐;铵根显+1价,硫酸根显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×2=0,则x=+2价;则它代表的点是E
一、单选题(共20题)
1.化学与生产、生活、社会密切相关,下列说法错误的是
A.“卤水点豆腐”属于蛋白质变性
B.绿色化学的核心思想是改变“先污染、后治理”的观念和做法
C.含氮、磷元素的大量污水任意排入近海水域,会出现水华、赤潮等水体污染问题
D.地沟油可以用来制造肥皂
2.下列关于胶体的说法不正确的是
A.胶体可以产生丁达尔效应 B.胶体粒子直径为1~100nm
C.胶体粒子可以通过半透膜 D.胶体粒子是分子的聚合体
3.
代表阿伏加德罗常数的值,以下说法正确的是
A.2个HCl分子与44.8L 和的混合气体所含的原子数目均为4
B.物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA
C.78g Na2O2与足量水反应转移的电子数为NA
D.22.4L(标准状况)H2O所含的质子数为10NA
4.下列物质的分类不正确的是
A.烧碱、纯碱、熟石灰都属于碱
B.H2SO4、HClO、H2CO3都属于酸
C.CuO、Na2O2和干冰都属于氧化物
D.NaHCO3、CuSO4·5H2O和KMnO4都属于盐
5.卫生部明令禁止在面粉中添加,从氧的价态角度进行分类,与属于同一类的是
A. B. C. D.
6.下列说法正确的是
A.2 mol Al的质量是54 g/mol
B.CO2的摩尔质量是44g/mol
C.标况下,22.4 L 酒精的物质的量为1mol
D.0.5 mol/L Na2SO4 的物质的量为0.5mol
7.设为阿伏加 德罗常数的值,下列说法不正确的是
A.1mol分子中含有的原子总数为6
B.500mL的NaCl溶液中微粒数大于0.5
C.30g HCHO与混合物中含C原子数为
D.加热条件下,2.3g Na与完全反应,生成0.2个
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1L 0.5mol/L CH3COOH溶液中含有的氢离子数为0.05NA
B.常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1NA
C.22.4 L(标准状况)氩气含有的质子数为18NA
D.标准状况下,4.48 L CCl4含有的共价键数为0.8NA
9.已知标准状况下,气体X的密度为1.25gL-1,则下列关于X的说法错误的是
A.X的相对分子质量为28 B.X可能含有两种元素
C.X一定是纯净物 D.X可能是N2
10.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.在1 L 0.1 mol·L-1的碳酸钠溶液中,氧原子总数为0.3 NA
B.常温常压下,32 g O2-中所含电子的数目为20 NA
C.物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA
D.标准状况下,11.2LSO3中含有分子的数目为0.5 NA
11.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L的H2和22.4L的H2O气混合后,气体分子数为2NA
B.0.5molAl与足量盐酸反应转移电子数为NA
C.46gNO2和N2O4的混合物含有的分子数为NA
D.向Na2O2通入足量的水蒸气,固体质量增加bg,该反应转移电子数为
12.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.2.0L1.0mol L-1的酸性KMnO4溶液中含有的氧原子数为8NA
B.5.6克Fe完全参与化学反应,一定转移0.3NA个电子
C.标准状况下,11.2L14CO2含有的中子数为13NA
D.1molFeCl3与沸水完全反应制得的氢氧化铁胶粒数目为NA
13.NA代表阿伏加 德罗常数,下列叙述错误的是( )
A.18g金刚石中,碳碳共价键数为3NA
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
D.一定温度下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
14.下列转化关系不能通过一步反应实现的是
A.Fe→FeCl2 B.Fe2O3→Fe(OH)3
C.FeCl3→FeCl2 D.Fe(OH)3→Fe2O3
15.英国科学家希尔发现,离体的叶绿体悬浮液中加入适当的电子受体(如草酸铁),在光照时可使水分解而释放氧气,从而证明了氧的释放与CO2还原是不同的过程,将对光合作用的研究上升到细胞层面。该反应方程式为4Fe3++2H2O4Fe2++4H++O2↑,下列有关希尔反应说法错误的是
A.水在光反应中起供氢体和供电子体双重作用
B.反应后溶液pH减小
C.生成11.2L O2时,Fe3+得电子数为2NA
D.叶绿体本身起催化剂作用,光起供能作用
16.下列物质按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A.淀粉、CuO、HClO、Cu
B.水玻璃、Na2O·CaO·6SiO2、CH3COOH、SO3
C.KAl(SO4)2·12H2O、KClO3、NH3·H2O、CH3CH2OH
D.普通玻璃、H2O、Fe(SCN)3、葡萄糖
17.假设NA表示阿伏加德罗常数的数值,下列说法正确的是
A.1molCl2与足量的铁反应转移的电子数是3NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
C.7.8g Na2O2中含有阴离子数目为0.1NA,与足量水反应时电子转移了0.1NA
D.标准状况下33.6L四氯化碳含有的分子数为1.5NA
18.化学与生产、生活、社会、环境密切相关,下列说法中正确的是
A.铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品
B.明矾净水过程中只涉及了物理变化
C.向氢氧化铁胶体中滴加稀硫酸,开始有红褐色沉淀生成,最终沉淀会完全溶解
D.溶于水能导电,故是电解质
19.下列叙述中,正确的是
A.的质量为
B.二氧化碳的摩尔质量是44g
C.1mol任何物质的质量等于该物质的相对分子质量
D.的摩尔质量是
20.当光束通过下列分散系时,能观察到丁达尔效应的是
A.NaOH溶液 B.NaCl溶液 C.K2SO4溶液 D.Fe(OH)3胶体
二、非选择题(共4题)
21.(1)44.4 g某二价金属氯化物( ACl2)中含有0.8molCl-,则ACl2的摩尔质量是 。A的相对原子量是 ,ACl2的化学式是 。
(2)同温同压下,同体积的气体X2和气体Y2完全反应生成气体Z,且反应前后气体体积不变,则Z的化学式为 。
22.相同物质的量的CO2和O2,其分子数之比为 ,原子数之比为 ,氧原子数之比为 ;质量相同的CO2和O2,其物质的量之比为 。
23.A、B、C、D、E、F、G七种物质都是日常生活和生产中常见的物质,各物质间存在如下转化关系(反应的条件已省略)
已知:B、C两种物质在不同情况下可分别发生①和②两个反应;A-G七种物质都是由非金属元素组成的,其中只有一种物质是盐,一种物质是单质;且B的相对分子质量大于C。
(1)请写出下列物质的化学式:A ;G ;
(2)请写出E+F→B+C的化学方程式: 。
24.如图为铁元素的“价—类”二维图,请分析后填写:
(1)A点表示的物质类别是 ,B点表示化合物的化学式为 ;
(2)某化合物化学式为(NH4)2Fe(SO4)2,它代表的点是 ,原因是 。
参考答案:
1.A
A.胶体遇电解质溶液可发生聚沉,“卤水点豆腐”的原理是Mg2+、Ca2+等离子使蛋白质胶体发生聚沉,不是变性,故A错误;
B.绿色化学的核心是要利用化学原理从源头消除污染,实现零排放,而不是对环境污染进行治理,故B正确;
C.含氮、磷的化合物排放到水中会使水体出现富营养化,使某些藻类迅速繁殖,从而造成水体缺氧,使其他水生生物因缺氧而死亡,破坏生态系统,故C正确;
D.“地沟油”的成分是油脂,可从地沟油中提炼出油脂作为生物柴油,碱性条件下的水解反应生成肥皂,故D正确;
故选:A。
2.C
A.丁达尔效应就是胶体的特殊性质 ,A正确;
B.胶体的分散系粒子直径大小在1-100nm,B正确;
C.胶体粒子不能通过半透膜,C错误;
D. 胶体粒子是分子的聚合而成的大分子集合体,D正确;
故选C。
3.C
A.H2和Cl2的混合气体所处的状态不明确,其物质的量不能计算,故A错误;
B.溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C.78g Na2O2的物质的量为=1mol, Na2O2与足量水反应生成NaOH和O2,转移的电子数为NA,故C正确;
D.H2O在标况下不是气体,不能计算22.4L(标准状况)H2O的物质的量,故D错误;
正确答案是C。
4.A
A、纯碱是碳酸钠,属于盐,A错误;
B、H2SO4、HClO、H2CO3三者都是酸,B正确;
C、氧化物是含有两种元素其中一种为氧元素的化合物,C正确;
D、盐是金属阳离子或铵根离子与酸根离子构成的化合物,NaHCO3、CuSO4·5H2O和KMnO4三者都是盐,D正确;
答案为A。
5.B
A.是超氧化物,不是过氧化物,A不选;
B.和中氧元素的价态均为-1价,都属于过氧化物,B选;
C.中氧元素为-2价,不是过氧化物,C不选;
D.是两性氧化物,不是过氧化物,D不选;
故选B。
6.B
A.2 mol Al的质量是2mol×27g/mol=54 g,A错误;
B.CO2的相对分子质量是44,其摩尔质量是44g/mol,B正确;
C.标况下酒精是液体,22.4 L 酒精的物质的量不是1mol,C错误;
D.0.5 mol/L Na2SO4 溶液的体积未知,无法计算物质的量,D错误;
答案选B。
7.D
A.1个分子中包含6个原子,故1mol分子中含有的原子总数为6,A项正确;
B.500mL的NaCl溶液中含有的微粒包括、、、、,故微粒数大于0.5,B项正确;
C.HCHO和的最简式均为,故30g HCHO和混合物中含“”的物质的量为1mol,含C原子数为,C项正确;
D.加热条件下,2.3g Na与完全反应,生成0.05个,D项不正确;
故选D。
8.C
A.醋酸是弱酸部分电离,0.1L0.5mol/LCH3COOH溶液中含有的氢离子数小于0.05NA,选项A错误;
B.溶液体积未知,无法计算0.5 mol·L-1Fe2(SO4)3溶液中含的Fe3+数,选项B错误;
C.22.4 L(标准状况)氩气的物质的量为1mol,1mol氩气分子中含有1molAr原子,含有18mol质子,含有的质子数为18NA,选项C正确;
D.标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,选项D错误;
答案选C。
9.C
X的密度为1.25gL-1,,M=1.25gL-1×22.4L/mol=28g/mol,据此分析解题。
A.摩尔质量与相对分子质量在数值上相同,所以相对分子质量为28,A正确;
B.相对分子质量为28的气体有:N2、CO、C2H4,B正确;
C.该气体可能是纯净物也可能是混合物,C错误;
D.X可能是N2、CO、C2H4,或者其中的混合气体,D正确;
答案选C。
10.B
A.在1 L 0.1 mol·L-1的碳酸钠溶液中,碳酸钠含有氧原子数为1L×0.1mol·L-1×3×NA/mol=0.3 NA,但水分子中也含有氧原子,故溶液中含有氧原子数大于0.3 NA,故A错误;
B.32g O2-中所含电子的数目为32g ÷16g/mol×10×NA /mol=20 NA,故B正确;
C.题目未给溶液体积,无法计算离子的物质的量,故C错误;
D.标准状况下,SO3不是气体,无法使用22.4L/mol计算物质的量,故D错误;
故答案选B。
11.D
A.标准状况下水是液态,无法确定分子数,故A错误;
B.铝元素化合价由0变为+3,故0.5molAl与足量盐酸反应转移电子1.5mol,数目为1.5NA,故B错误;
C.1molNO2的质量为46g,故46gNO2和N2O4的混合物的分子数小于NA,故C错误;
D.Na2O2与水蒸气反应,,固体增重的质量实际为H2的质量,固体质量增加bg,则反应过氧化钠为,电子转移关系为2Na2O2~2e-,故转移电子数为,故D正确;
故选D。
12.C
A.溶液中除了高锰酸钾含O原子,水中也含O原子,则的酸性溶液中含有的氧原子数大于,故A错误;
B.Fe遇到弱氧化剂时,失去2个电子,转化成价化合物,Fe遇到强氧化剂时,失去3个电子,转化成价化合物,故B错误;
C.一个含有的中子数为26,标准状况下,为个分子,所以含有的中子数为,故C正确;
D.氢氧化铁胶粒是氢氧化铁的聚集体,所以完全反应得到的氢氧化铁胶粒数目小于,故D错误;
选C。
13.D
A. 18g金刚石中含有1.5molC,金刚石中每个C与其它4个C形成了4个碳碳键,根据均摊法,每个C形成的共价键为:=2,所以1.5molC形成的共价键的物质的量为3mol,碳碳共价键数为3NA,A项正确;
B. 32g氧气的物质的量为1mol,在H2O2+Cl2=2HCl+O2反应中,双氧水中氧元素化合价为-1价,每生成1mol氧气,则转移2mol电子,转移了2NA个电子,B项正确;
C. 6.4gS2和S8的混合物中含有硫原子的物质的量为0.2mol,所含硫原子数一定为0.2NA,C项正确;
D. 1L 0.50mol·L-1 NH4Cl溶液与2L 0.25 mol·L-1 NH4Cl溶液中,前者铵根离子浓度大于后者,前者铵根离子水解程度小于后者,所以溶液中铵根离子的物质的量前者大于后者,D项错误;
答案选D。
14.B
A.Fe和氯化铁反应生成FeCl2,A不符合;
B.Fe2O3不溶于水,不能直接转化为Fe(OH)3,B符合;
C.FeCl3和铁反应生成FeCl2,C不符合;
D.Fe(OH)3受热分解生成Fe2O3,D不符合;
答案选B。
15.C
A.反应中水中氧元素失去电子生成氧气,且生成氢离子,在光反应中起供氢体和供电子体双重作用,故A正确;
B.根据离子方程式可知生成氢离子,则反应后溶液pH减小,故B正确;
C.O元素化合价由-2价升高到0价,则每生成1mol O2转移4mol电子,生成标准状况下11.2L O2时,及0.5mol,转移2mol电子,则Fe3+得电子数为2NA,但选项中未注明是否为标准状况,故C错误;
D.由方程式可知叶绿体为催化剂,光提供反应所需的能量,故D正确;
综上所述答案为C。
16.D
A.Cu为单质,既不是电解质也不是非电解质,A不合题意;
B.Na2O·CaO·6SiO2是玻璃的主要成分,属于混合物,B不合题意;
C.KAl(SO4)2·12H2O属于纯净物,KClO3属于盐,C不合题意;
D.普通玻璃为混合物,H2O为氧化物,Fe(SCN)3为弱电解质,葡萄糖为非电解质,D符合题意;
故选D。
17.C
A.1molCl2与足量的铁反应,Fe过量,以氯气来算,转移的电子数是2NA,A错误;
B.物质的量浓度为0.5mol/L的MgCl2溶液,由于不知道体积,所以无法确定含有Cl 个数,B错误;
C.7.8g Na2O2的物质的量是0.1mol,过氧化钠有钠离子和过氧根离子构成,含阴离子数目为0.1NA,过氧化钠与水反应生成了氢氧化钠,-1价的氧元素被还原为-2,同时又被氧化为0价,所以转移的电子数为0.1NA,C正确;
D.标准状况下四氯化碳为液体,D错误,
答案选C。
18.C
A.金属铝既能和酸反应又能和碱反应,不能盛放酸性或碱性食品,也不能长期盛放腌制食品,里面有氯化钠,会形对铝制容器进行腐蚀,故A错误;
B.明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中的杂质,该过程涉及了化学变化,故B错误;
C.盐酸是电解质溶液,氢氧化铁胶体遇到盐酸,胶体发生聚沉,生成氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸反应生成氯化铁,故C选项正确;
D.溶于水能导电是因为氨气与水反应生成一水合氨电解质,一水合氨电离产生自由移动的离子,氨气本身不能电离产生自由移动的离子,所以不是电解质,故D错误。
故选C选项。
19.D
A.的质量为32g,故A错误;
B.二氧化碳的摩尔质量是,故B错误;
C.1mol物质的质量在以克为单位时等于该物质的相对分子质量或相对原子质量,故C错误;
D.的相对分子质量为96,所以的摩尔质量为96 ,故D正确。
故选D。
20.D
丁达尔效应为当光束通过胶体时,能产生一条光亮的通路;A、B、C均为溶液,通过溶液时无此现象,光通过Fe(OH)3胶体时产生丁达尔效应,答案为D。
21. 40 CaCl2 XY或YX
按定义、结合阿伏加德罗定律、质量守恒定律求解;
(1)44.4 g某二价金属氯化物( ACl2)中含有0.8molCl-,则ACl2的物质的量为0.4mol,摩尔质量。ACl2的相对分子质量为111,A的相对原子量是40,ACl2的化学式是CaCl2。
(2)按阿伏加德罗定律:同温同压下,同体积的气体X2和气体Y2的物质的量、分子数相同,完全反应生成气体Z,且反应前后气体体积不变,则反应后生成Z的物质的量等于混合气体的物质的量,结合质量守恒定律知,该化学方程式为:X2+Y2=2Z,Z的化学式为XY或YX。
22. 1:1 3:2 1:1 8:11
由分子数可知,相同物质的量的CO2和O2,其分子数之比为1:1;CO2与O2的原子数为3:2,因此相同物质的量的的CO2和O2,其原子数之比为3:2;CO2与O2的氧原子数为1:1,因此相同物质的量的的CO2和O2,其氧原子数之比为1:1;设质量为m,质量相同的CO2和O2,其物质的量之比为=8:11。
23.(1) NH4HCO3 H2CO3
(2)C6H12O6+6O26CO2+6H2O
A、B、C、D、E、F、G七种物质都是日常生活和生产中常见的物质,七种物质都是由非金属元素组成的,其中只有一种物质是盐,则该种物质一定为铵盐,假设为碳酸氢铵,碳酸铵氢加热分解生成氨气、水和二氧化碳;二氧化碳和水反应生成碳酸,在一定条件可生成葡萄糖;碳酸分解又生成二氧化碳和水,葡萄糖和氧气在一定条件下生成二氧化碳和水,代入验证符合转化关系;所以A为碳酸氢铵,B为二氧化碳,C为水,D为氨气,G为碳酸;
(1)根据分析可得,A为NH4HCO3;G为H2CO3;
(2)E+F→B+C的反应是葡萄糖和氧气在一定条件下生成二氧化碳和水,化学方程式为C6H12O6+6O26CO2+6H2O。
24.(1) 单质 FeO
(2) E (NH4)2Fe(SO)2为盐,其中铁元素的价态为+2价
(1)由铁的价类图可知,A处物质的化合价为0,单质中元素的化合价为0,则A点表示的物质类别是单质;B处为+3价铁的氧化物,即为氧化铁,氧化铜的颜色为红棕色;答案为单质;FeO;
(2)(NH4)2Fe(SO)2是由金属离子和酸根离子构成的化合物,属于盐;铵根显+1价,硫酸根显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×2=0,则x=+2价;则它代表的点是E
