第九单元 溶液 综合复习题(含答案) -2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第九单元 溶液 综合复习题(含答案) -2023-2024学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 194.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 19:26:57 | ||
图片预览

文档简介
第九单元 溶液 综合复习题
一、单选题
1.下列叙述中,正确的是( )
A.溶液都是无色透明的液体
B.物质的溶解过程通常会伴随着能量的变化
C.配制溶液时,搅拌可以增大固体物质的溶解度
D. 60℃时硝酸钾的溶解度为110g,其溶液中溶质与溶剂的质量比为11:21
2.在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯
A.①②③④⑤ B.只有①②④⑤
C.只有①②③ D.只有②③④⑤
3.溶液对自然界中的生命活动和人类的生产活动具有重要意义。下列说法正确的是( )
A.只有固体和液体物质可以作为溶质
B.长期放置不分层的液体就是溶液
C.饱和溶液升温一定变为不饱和溶液
D.溶液中溶质可以是一种或者多种
4.下图为氢氧化钙的溶解度曲线,下列说法错误的是( )
A.氢氧化钙的溶解度随温度的升高而减小
B.30℃时,100g水中最多溶解0.15g氢氧化钙
C.30℃恰好饱和的石灰水升温到50℃,溶质的质量分数不变
D.70℃时,饱和石灰水中溶质和溶剂的质量比为1:1000
5.20℃时,向100g未知浓度KCl溶液中加入5g KCl后,正确的是( )
A.溶液质量变为105g B.溶剂质量不变
C.溶液浓度一定变大 D.溶质质量一定发生变化
6.要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法,其中可行的是( )
①加入CaO;②加入Ca(OH)2 ;③升高温度;④降低温度
A.②③ B.②④ C.①②④ D.①②③
7.下列实验方案中正确的是( )
A.通过蒸发,使盐酸浓度增大
B.可用洗涤剂清洗餐具上的油污
C.通过过滤,将硬水变成软水
D.通过降温,将饱和食盐水变成不饱和
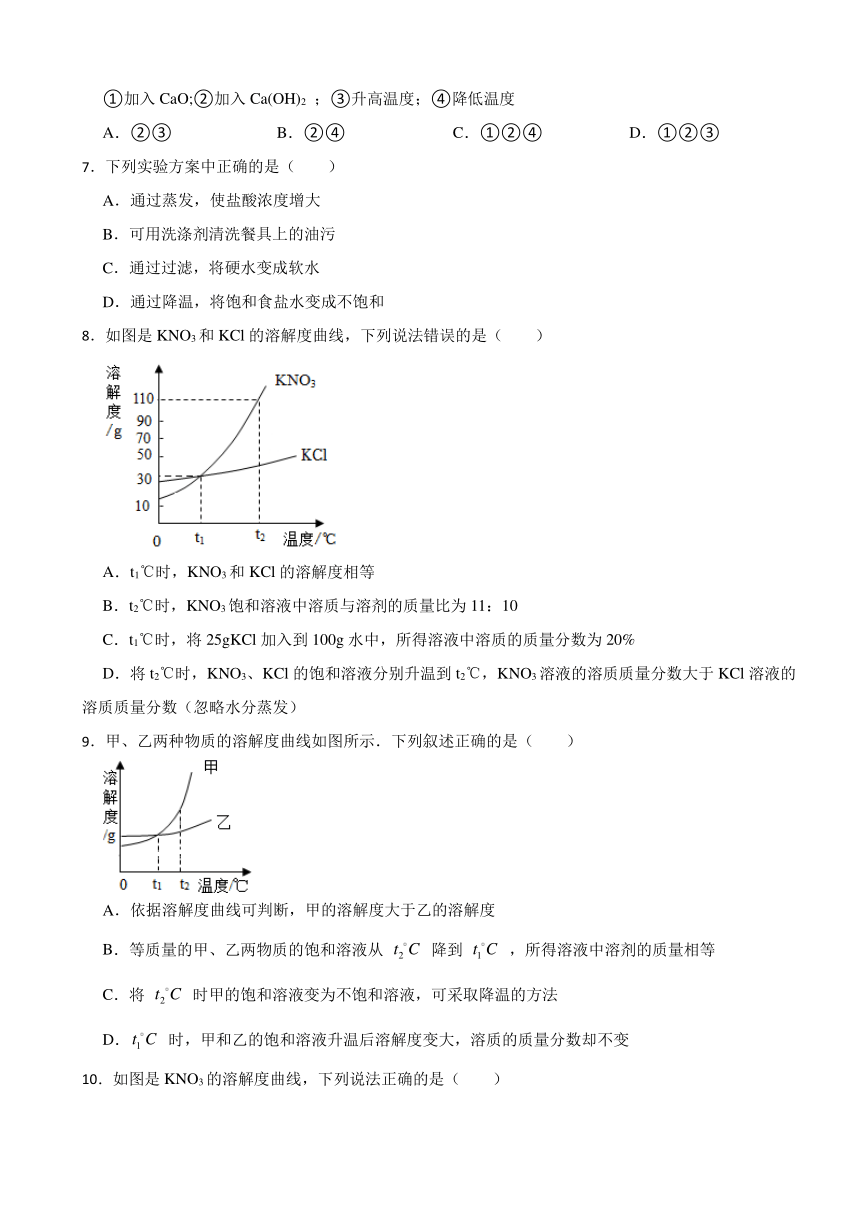
8.如图是KNO3和KCl的溶解度曲线,下列说法错误的是( )
A.t1℃时,KNO3和KCl的溶解度相等
B.t2℃时,KNO3饱和溶液中溶质与溶剂的质量比为11:10
C.t1℃时,将25gKCl加入到100g水中,所得溶液中溶质的质量分数为20%
D.将t2℃时,KNO3、KCl的饱和溶液分别升温到t2℃,KNO3溶液的溶质质量分数大于KCl溶液的溶质质量分数(忽略水分蒸发)
9.甲、乙两种物质的溶解度曲线如图所示.下列叙述正确的是( )
A.依据溶解度曲线可判断,甲的溶解度大于乙的溶解度
B.等质量的甲、乙两物质的饱和溶液从 降到 ,所得溶液中溶剂的质量相等
C.将 时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D. 时,甲和乙的饱和溶液升温后溶解度变大,溶质的质量分数却不变
10.如图是KNO3的溶解度曲线,下列说法正确的是( )
A.60℃时,b、c点对应的都是饱和溶液
B.将a点溶液从20℃升温到60℃,溶质的质量分数增大
C.从c点对应的溶液降温到a点,一定有晶体析出
D.c点溶液加60g硝酸钾晶体,溶液变饱和
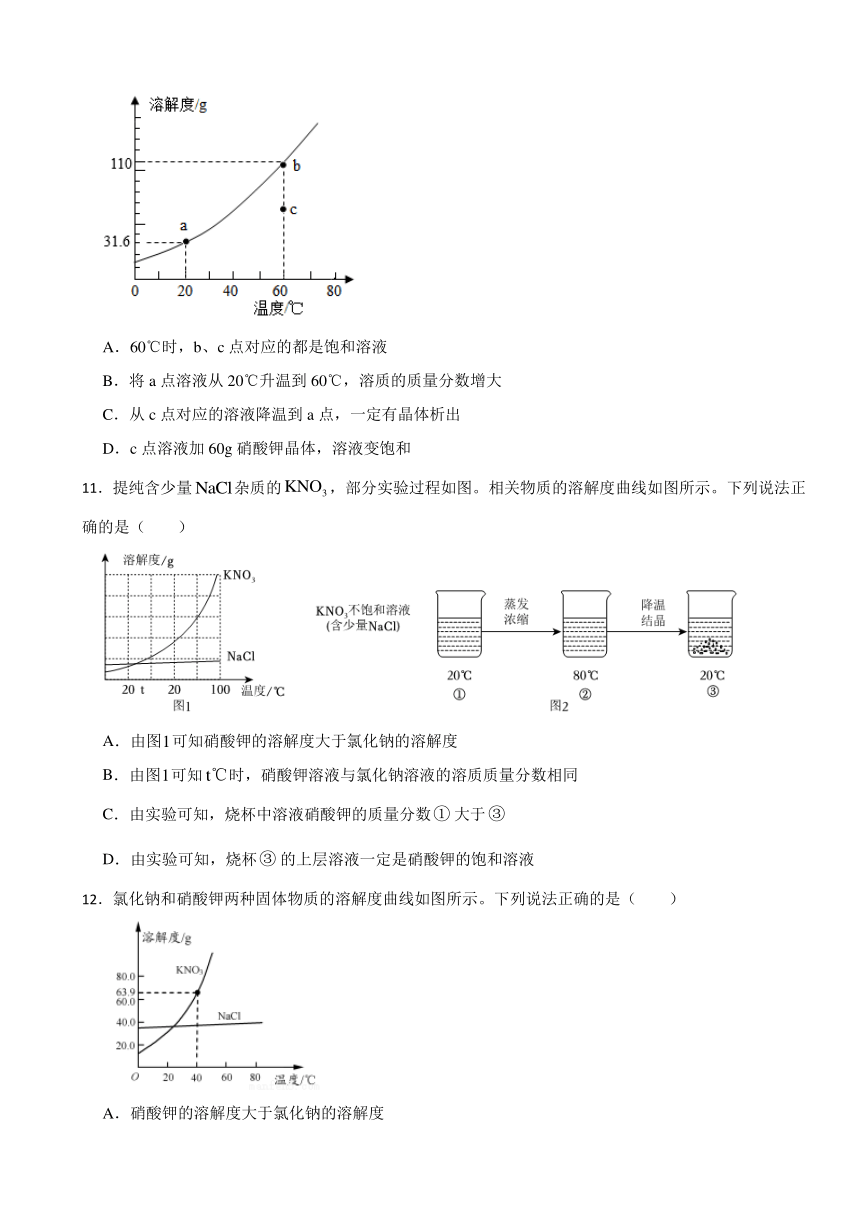
11.提纯含少量杂质的,部分实验过程如图。相关物质的溶解度曲线如图所示。下列说法正确的是( )
A.由图可知硝酸钾的溶解度大于氯化钠的溶解度
B.由图可知时,硝酸钾溶液与氯化钠溶液的溶质质量分数相同
C.由实验可知,烧杯中溶液硝酸钾的质量分数大于
D.由实验可知,烧杯的上层溶液一定是硝酸钾的饱和溶液
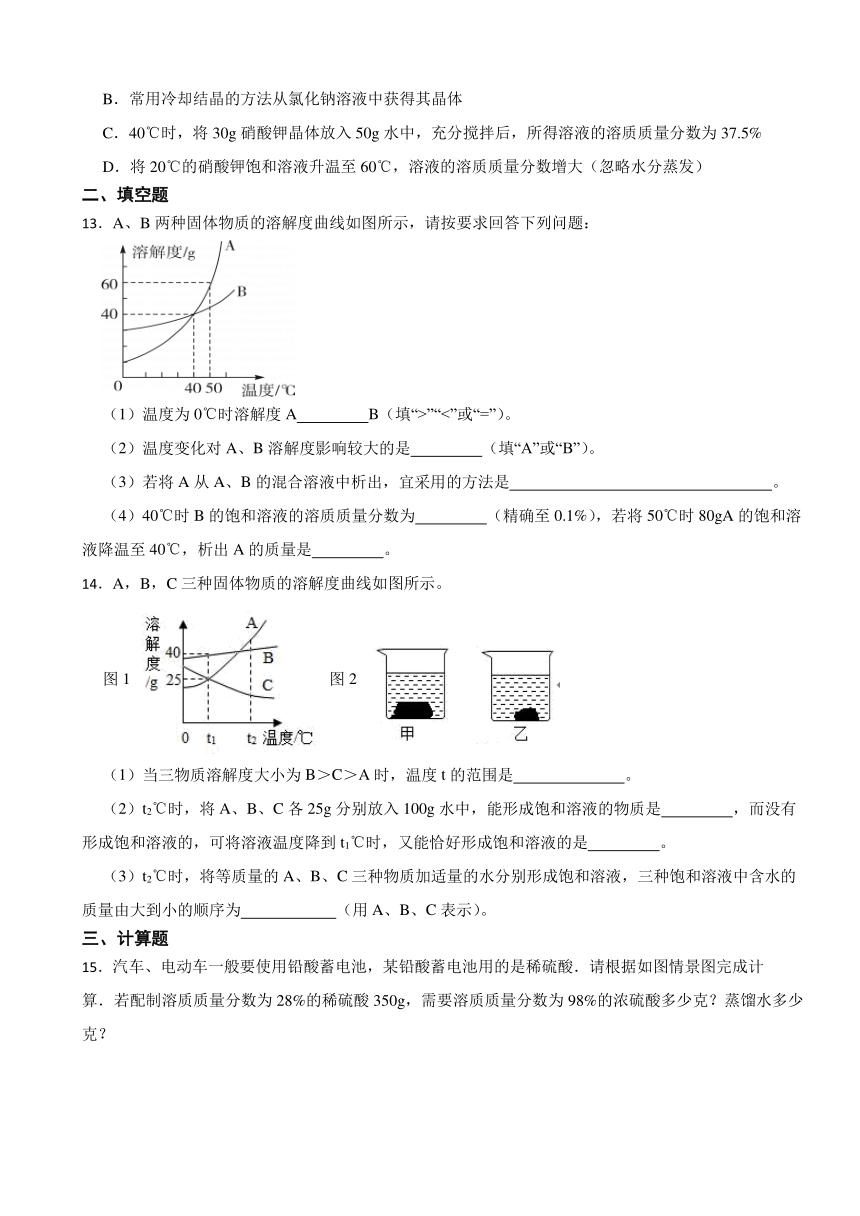
12.氯化钠和硝酸钾两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40℃时,将30g硝酸钾晶体放入50g水中,充分搅拌后,所得溶液的溶质质量分数为37.5%
D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)
二、填空题
13.A、B两种固体物质的溶解度曲线如图所示,请按要求回答下列问题:
(1)温度为0℃时溶解度A B(填“>”“<”或“=”)。
(2)温度变化对A、B溶解度影响较大的是 (填“A”或“B”)。
(3)若将A从A、B的混合溶液中析出,宜采用的方法是 。
(4)40℃时B的饱和溶液的溶质质量分数为 (精确至0.1%),若将50℃时80gA的饱和溶液降温至40℃,析出A的质量是 。
14.A,B,C三种固体物质的溶解度曲线如图所示。
图1 图2
(1)当三物质溶解度大小为B>C>A时,温度t的范围是 。
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是 ,而没有形成饱和溶液的,可将溶液温度降到t1℃时,又能恰好形成饱和溶液的是 。
(3)t2℃时,将等质量的A、B、C三种物质加适量的水分别形成饱和溶液,三种饱和溶液中含水的质量由大到小的顺序为 (用A、B、C表示)。
三、计算题
15.汽车、电动车一般要使用铅酸蓄电池,某铅酸蓄电池用的是稀硫酸.请根据如图情景图完成计算.若配制溶质质量分数为28%的稀硫酸350g,需要溶质质量分数为98%的浓硫酸多少克?蒸馏水多少克?
四、实验探究题
16.如图为A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时A、B、C三种物质的溶解度大小关系是 .
(2)a点的含义是 .
(3)t1℃时将A物质40g加入到50g水中充分搅拌,形成溶液的质量是 g.
(4)将t3℃时A、B、C三种物质饱和溶液的温度降温到t1℃,三种溶液的溶质质量分数大小关系是 .
17.以下是化学实验常用的仪器.请回答有关问题.
(1)仪器F的名称是 ;
(2)加热KMnO4制取氧气,反应的化学方程式是 ;用铁夹固定好试管后,要使试管口略低于试管底部,应调节螺旋 (填“K1”、“K2”或“K3”)
(3)实验室制取并收集CO2应选用上述仪器中的 (填序号);所用80g 10%的稀盐酸,需用25%的盐酸 g来配制,若配出盐酸的浓度偏低,操作中可能存在的错误是 .
18.根据所学知识,完成问题:
(1)(1)人体胃液中含有适量的盐酸,可以帮助消化,正常胃液的pH通常在0.9~1.5之间,胃酸过多或过少,都会引起胃部不适.治疗胃酸过多病症的药物中常含有一种物质即碳酸氢钠,写出用此药物治疗胃酸过多所发生的化学方程式 .
(2)常温下,将盛饱和硝酸钾溶液(底部有硝酸钾晶体)的试管固定在有水的烧杯中(如图所示).若向烧杯中加入某种物质并搅拌后,结果试管中的晶体消失了.请你推测,加入的物质可能是 、 (写出不同类别的物质).
五、综合题
19.请根据硝酸钾、氯化铵两种固体物质的溶解度曲线回答下列问题:
(1)70℃时,氯化铵的溶解度为
(2)将30℃时等质量的两种物质的饱和溶液降温到10℃,析出晶体的质量是硝酸钾 氯化铵(填“>”、“=”或“<”);
(3)如图中m点的含义是
20.如图是几种物质的溶解度曲线,根据图示回答:
(1)在图1中,t2℃时甲物质的溶解度为 g.
(2)甲、丙在 ℃时溶解度相同.
(3)图1中,若将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得三种溶液的溶质质量分数由大到小的顺序是 (析出晶体都不含结晶水).
(4)气体的溶解度也有一定的变化规律,不同的温度下,氧气的溶解度随压强而变化的情况如图2所示,若t1℃对应的温度为40℃,则t2对应的温度 (填字母序号)
A.小于40℃ B.等于40℃ C.大于40℃ D.无法确定.
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】D
4.【答案】C
5.【答案】B
6.【答案】D
7.【答案】B
8.【答案】D
9.【答案】D
10.【答案】C
11.【答案】D
12.【答案】C
13.【答案】(1)<
(2)A
(3)降温结晶(或冷却热饱和溶液)
(4)28.6%;10g
14.【答案】(1)0℃~t1℃
(2)C;A
(3)C>B>A
15.【答案】解:设需要98%的浓硫酸质量为x.
350g×28%=x×98%
x=100g
需要水的质量=350g﹣100g=250g
答:需要98%的浓硫酸100克,蒸馏水250克.
16.【答案】(1)B>C>A
(2)t2℃时,A和C的溶解度相等
(3)70
(4)B>C>A
17.【答案】(1)水槽
(2)2KMnO4 K2MnO4+MnO2+O2↑;K2
(3)ABCE;32;量取水时仰视读数
18.【答案】(1)NaHCO3+HCl═NaCl+H2O+CO2↑
(2)氧化钙;氢氧化钠
19.【答案】(1)60g
(2)>
(3)t℃时,硝酸钾和氯化铵的溶解度相等
20.【答案】(1)60
(2)t1
(3)乙、甲、丙
(4)C
一、单选题
1.下列叙述中,正确的是( )
A.溶液都是无色透明的液体
B.物质的溶解过程通常会伴随着能量的变化
C.配制溶液时,搅拌可以增大固体物质的溶解度
D. 60℃时硝酸钾的溶解度为110g,其溶液中溶质与溶剂的质量比为11:21
2.在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯
A.①②③④⑤ B.只有①②④⑤
C.只有①②③ D.只有②③④⑤
3.溶液对自然界中的生命活动和人类的生产活动具有重要意义。下列说法正确的是( )
A.只有固体和液体物质可以作为溶质
B.长期放置不分层的液体就是溶液
C.饱和溶液升温一定变为不饱和溶液
D.溶液中溶质可以是一种或者多种
4.下图为氢氧化钙的溶解度曲线,下列说法错误的是( )
A.氢氧化钙的溶解度随温度的升高而减小
B.30℃时,100g水中最多溶解0.15g氢氧化钙
C.30℃恰好饱和的石灰水升温到50℃,溶质的质量分数不变
D.70℃时,饱和石灰水中溶质和溶剂的质量比为1:1000
5.20℃时,向100g未知浓度KCl溶液中加入5g KCl后,正确的是( )
A.溶液质量变为105g B.溶剂质量不变
C.溶液浓度一定变大 D.溶质质量一定发生变化
6.要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法,其中可行的是( )
①加入CaO;②加入Ca(OH)2 ;③升高温度;④降低温度
A.②③ B.②④ C.①②④ D.①②③
7.下列实验方案中正确的是( )
A.通过蒸发,使盐酸浓度增大
B.可用洗涤剂清洗餐具上的油污
C.通过过滤,将硬水变成软水
D.通过降温,将饱和食盐水变成不饱和
8.如图是KNO3和KCl的溶解度曲线,下列说法错误的是( )
A.t1℃时,KNO3和KCl的溶解度相等
B.t2℃时,KNO3饱和溶液中溶质与溶剂的质量比为11:10
C.t1℃时,将25gKCl加入到100g水中,所得溶液中溶质的质量分数为20%
D.将t2℃时,KNO3、KCl的饱和溶液分别升温到t2℃,KNO3溶液的溶质质量分数大于KCl溶液的溶质质量分数(忽略水分蒸发)
9.甲、乙两种物质的溶解度曲线如图所示.下列叙述正确的是( )
A.依据溶解度曲线可判断,甲的溶解度大于乙的溶解度
B.等质量的甲、乙两物质的饱和溶液从 降到 ,所得溶液中溶剂的质量相等
C.将 时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D. 时,甲和乙的饱和溶液升温后溶解度变大,溶质的质量分数却不变
10.如图是KNO3的溶解度曲线,下列说法正确的是( )
A.60℃时,b、c点对应的都是饱和溶液
B.将a点溶液从20℃升温到60℃,溶质的质量分数增大
C.从c点对应的溶液降温到a点,一定有晶体析出
D.c点溶液加60g硝酸钾晶体,溶液变饱和
11.提纯含少量杂质的,部分实验过程如图。相关物质的溶解度曲线如图所示。下列说法正确的是( )
A.由图可知硝酸钾的溶解度大于氯化钠的溶解度
B.由图可知时,硝酸钾溶液与氯化钠溶液的溶质质量分数相同
C.由实验可知,烧杯中溶液硝酸钾的质量分数大于
D.由实验可知,烧杯的上层溶液一定是硝酸钾的饱和溶液
12.氯化钠和硝酸钾两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40℃时,将30g硝酸钾晶体放入50g水中,充分搅拌后,所得溶液的溶质质量分数为37.5%
D.将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)
二、填空题
13.A、B两种固体物质的溶解度曲线如图所示,请按要求回答下列问题:
(1)温度为0℃时溶解度A B(填“>”“<”或“=”)。
(2)温度变化对A、B溶解度影响较大的是 (填“A”或“B”)。
(3)若将A从A、B的混合溶液中析出,宜采用的方法是 。
(4)40℃时B的饱和溶液的溶质质量分数为 (精确至0.1%),若将50℃时80gA的饱和溶液降温至40℃,析出A的质量是 。
14.A,B,C三种固体物质的溶解度曲线如图所示。
图1 图2
(1)当三物质溶解度大小为B>C>A时,温度t的范围是 。
(2)t2℃时,将A、B、C各25g分别放入100g水中,能形成饱和溶液的物质是 ,而没有形成饱和溶液的,可将溶液温度降到t1℃时,又能恰好形成饱和溶液的是 。
(3)t2℃时,将等质量的A、B、C三种物质加适量的水分别形成饱和溶液,三种饱和溶液中含水的质量由大到小的顺序为 (用A、B、C表示)。
三、计算题
15.汽车、电动车一般要使用铅酸蓄电池,某铅酸蓄电池用的是稀硫酸.请根据如图情景图完成计算.若配制溶质质量分数为28%的稀硫酸350g,需要溶质质量分数为98%的浓硫酸多少克?蒸馏水多少克?
四、实验探究题
16.如图为A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时A、B、C三种物质的溶解度大小关系是 .
(2)a点的含义是 .
(3)t1℃时将A物质40g加入到50g水中充分搅拌,形成溶液的质量是 g.
(4)将t3℃时A、B、C三种物质饱和溶液的温度降温到t1℃,三种溶液的溶质质量分数大小关系是 .
17.以下是化学实验常用的仪器.请回答有关问题.
(1)仪器F的名称是 ;
(2)加热KMnO4制取氧气,反应的化学方程式是 ;用铁夹固定好试管后,要使试管口略低于试管底部,应调节螺旋 (填“K1”、“K2”或“K3”)
(3)实验室制取并收集CO2应选用上述仪器中的 (填序号);所用80g 10%的稀盐酸,需用25%的盐酸 g来配制,若配出盐酸的浓度偏低,操作中可能存在的错误是 .
18.根据所学知识,完成问题:
(1)(1)人体胃液中含有适量的盐酸,可以帮助消化,正常胃液的pH通常在0.9~1.5之间,胃酸过多或过少,都会引起胃部不适.治疗胃酸过多病症的药物中常含有一种物质即碳酸氢钠,写出用此药物治疗胃酸过多所发生的化学方程式 .
(2)常温下,将盛饱和硝酸钾溶液(底部有硝酸钾晶体)的试管固定在有水的烧杯中(如图所示).若向烧杯中加入某种物质并搅拌后,结果试管中的晶体消失了.请你推测,加入的物质可能是 、 (写出不同类别的物质).
五、综合题
19.请根据硝酸钾、氯化铵两种固体物质的溶解度曲线回答下列问题:
(1)70℃时,氯化铵的溶解度为
(2)将30℃时等质量的两种物质的饱和溶液降温到10℃,析出晶体的质量是硝酸钾 氯化铵(填“>”、“=”或“<”);
(3)如图中m点的含义是
20.如图是几种物质的溶解度曲线,根据图示回答:
(1)在图1中,t2℃时甲物质的溶解度为 g.
(2)甲、丙在 ℃时溶解度相同.
(3)图1中,若将t3℃时等质量的甲、乙、丙三种物质的饱和溶液分别降温到t1℃,所得三种溶液的溶质质量分数由大到小的顺序是 (析出晶体都不含结晶水).
(4)气体的溶解度也有一定的变化规律,不同的温度下,氧气的溶解度随压强而变化的情况如图2所示,若t1℃对应的温度为40℃,则t2对应的温度 (填字母序号)
A.小于40℃ B.等于40℃ C.大于40℃ D.无法确定.
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】D
4.【答案】C
5.【答案】B
6.【答案】D
7.【答案】B
8.【答案】D
9.【答案】D
10.【答案】C
11.【答案】D
12.【答案】C
13.【答案】(1)<
(2)A
(3)降温结晶(或冷却热饱和溶液)
(4)28.6%;10g
14.【答案】(1)0℃~t1℃
(2)C;A
(3)C>B>A
15.【答案】解:设需要98%的浓硫酸质量为x.
350g×28%=x×98%
x=100g
需要水的质量=350g﹣100g=250g
答:需要98%的浓硫酸100克,蒸馏水250克.
16.【答案】(1)B>C>A
(2)t2℃时,A和C的溶解度相等
(3)70
(4)B>C>A
17.【答案】(1)水槽
(2)2KMnO4 K2MnO4+MnO2+O2↑;K2
(3)ABCE;32;量取水时仰视读数
18.【答案】(1)NaHCO3+HCl═NaCl+H2O+CO2↑
(2)氧化钙;氢氧化钠
19.【答案】(1)60g
(2)>
(3)t℃时,硝酸钾和氯化铵的溶解度相等
20.【答案】(1)60
(2)t1
(3)乙、甲、丙
(4)C
同课章节目录
