第八单元 金属和金属材料 综合复习题(含答案)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第八单元 金属和金属材料 综合复习题(含答案)-2023-2024学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 111.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 19:41:06 | ||
图片预览




文档简介
第八单元 金属和金属材料 综合复习题
一、单选题
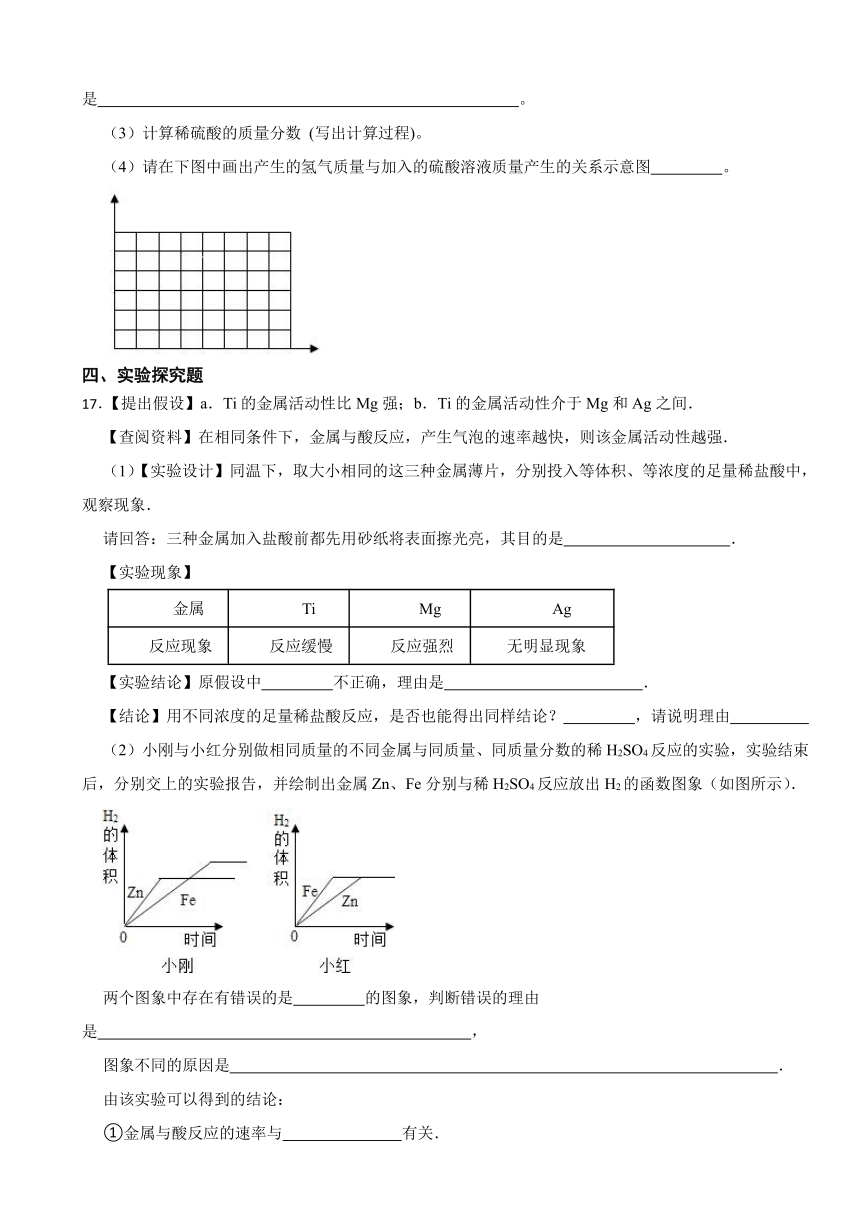
1.下列有关实验现象的描述,正确的是( )
A.电解水的实验中正极所产生的气体约是负极气体体积的2倍且能燃烧
B.镁条在空气中燃烧发出耀眼的白光,生成一种黑色物质
C.一氧化碳在空气中燃烧发出黄色火焰并放出热量
D.将打磨过的铝丝伸入硫酸铜溶液中一会儿,其表面有一层红色物质
2.下图所示的四个图像,能正确反映对应变化关系的是( )
A.镁在氧气中燃烧
B.向二氧化锰中加入过氧化氢溶液
C.向一定质量铁粉和铜粉的混合物中加入硫酸铜溶液
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
3.地壳中含量最多的元素是( )
A.O B.Si C.Al D.Fe
4.地壳中含量最多的元素是( )
A.氮元素 B.氧元素 C.铝元素 D.氢元素
5.高铁列车车体材料使用含镍不锈钢,工业上炼镍的原理之C+2NiO 2Ni+CO2↑。下列说法错误的是( )
A.含镍不锈钢的硬度小于纯铁
B.火法炼镍的反应是置换反应
C.含镍不锈钢属于一种铁合金
D.火法炼镍的反应中Ni元素化合价降低了
6.建立模型是学习化学的重要方法。下列有关模型正确的是()
A.原子结构模型
B.物质分类模型
C.地壳中各元素含量
D.空气组成模型
7.X、Y、Z三种金属,分别把X、Y放入稀硫酸中,只有X表面有气泡产生;分别把Y和Z放入硝酸银溶液中,只有Y表面有银析出。综上所述X、Y、Z的金属活动性由强到弱的顺序是( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
8.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列说法正确的是( )
A.丁一定是化合物
B.该反应是置换反应
C.丙一定是该反应的催化剂
D.反应前后甲和乙变化的质量比为9:8
9.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应错误的是( )
A. B.
C. D.
10.某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是( )
A.将Fe、Cu分别加入AgNO3溶液中
B.将Fe、Cu、Ag分别加入稀盐酸中
C.将Fe分别加入CuSO4、AgNO3溶液中
D.将Fe、Ag分别加入CuSO4溶液中
11.将天平调节平衡,在左右两端放上等质量等质量分数的稀盐酸,然后向左、右两盘盐酸中分别放入等质量的金属X、Y,在反应的过程中指针向左偏转,完全反应后(盐酸足量)指针向右偏转,则X、Y与下列金属相符的是( )
A.X:Fe Y:Mg B.X:Fe Y:Zn
C.X:Mg Y:Al D.X:Al Y:Zn
12.下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.C+H2O CO+H2
C.Cl2+H2O=HCl+HClO D.2F2+2H2O=4HF+O2
二、填空题
13.铁路上铺设钢轨常利用铝热反应:2Al+Fe2O3 2Fe+Al2O3,该反应说明铝的活动性比铁 (填“强”或“弱”);黄金是一种贵重金属,各种黄金首饰易于保存,具有收藏价值的主要原因是 .
14.黄金、黄铜(铜锌合金)、黄铁矿(主要成分是FeS2)都是金黄色固体。
(1)将黄铜片和纯铜片相互刻划时有明显划痕的是 。
(2)将黄铜片放入稀硫酸中发生反应的化学方程式是 。
(3)工业上用黄铁矿为原料生产硫酸,第一步的反应为
。则X的化学式为 。
三、计算题
15.为测定某铜锌合金的成分含量进行了如下实验:将320.0g20.0%的硫酸铜溶液分成四等份,逐次加入至50.3g的合金粉末中,充分反应后得到如下数据。
第1次 第2次 第3次 第4次
加入硫酸铜溶液的质量/g 80.0 80.0 80.0 80.0
剩余固体的质量/g 50.2 50.1 50.0 50.0
(1)第 次加入硫酸铜溶液时反应恰好完全,此时消耗的硫酸铜溶液总质量为 g。
(2)计算合金粉末中金属锌的质量分数(结果精确至0.1%)。
(3)在下图中画出加入硫酸铜溶液质量0~320.0g过程中,溶液中硫酸盐溶质的总质量对应的变化图,并标注必要的数值。
16.铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g于烧杯中,然后等量分5次加入未知质量分数的稀硫酸,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
项目 第1次 第2次 第3次 第4次 第5次
加入稀硫酸的质量/g 5 5 5 5 5
每次产生气体的质量/g 0.01 0.01 0.01 0.005 0
(1)完全反应后总共生成的氢气质量为 。
(2)铜粉中混有的铁粉能与酸反应的原因是 。
(3)计算稀硫酸的质量分数 (写出计算过程)。
(4)请在下图中画出产生的氢气质量与加入的硫酸溶液质量产生的关系示意图 。
四、实验探究题
17.【提出假设】a.Ti的金属活动性比Mg强;b.Ti的金属活动性介于Mg和Ag之间.
【查阅资料】在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
(1)【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 .
【实验现象】
金属 Ti Mg Ag
反应现象 反应缓慢 反应强烈 无明显现象
【实验结论】原假设中 不正确,理由是 .
【结论】用不同浓度的足量稀盐酸反应,是否也能得出同样结论? ,请说明理由
(2)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图象(如图所示).
两个图象中存在有错误的是 的图象,判断错误的理由是 ,
图象不同的原因是 .
由该实验可以得到的结论:
①金属与酸反应的速率与 有关.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与 有关.
(3)将铁粉加到硫酸铜溶液中,可能观察到的现象有 .
18.全世界每年因生锈而损失的钢铁约占世界钢铁年产量的1/4.某同学想探究铁生锈的条件,他将干净的铁钉分别同时放入A、B、C三支试管中进行探究。
(1)(设计实验)请你帮助该同学完成下列实验设计的内容:
编号 操作方法 实验目的
A 在干燥的试管中放入铁钉,并放入少量氯 化钙做干燥剂 探究铁在 铁的生锈情况
B 放入铁钉,注入蒸馏水浸没铁钉,并用植 物油液封 探究铁在 铁的生锈情况
C 探究铁在有氧气和水同时存在时的生锈情况
(实验结论)一周后,编号为 的试管中的铁钉最易生锈。
(2)(扩展延伸)苹果切开不久,果肉上就会产生一层咖啡色的物质,也好象是生了“锈”一样。
切开的苹果“生锈”与什么因素有关?
猜想①:可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”。
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”。
猜想③:可能是果肉中的物质与空气中的氮气作用而“生锈”。
猜想④:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”。
查阅资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生反应,生成咖啡色的物质。且不切开的苹果没有此现象,所以苹果“生锈”与猜想①无关。
在②﹣④猜想中,你认为猜想 最不合理,理由是 。
(3)(实践应用)
①用相同材料制作,经过相同防锈处理的铁栏杆,安装在沿海比安装在内陆更易生锈,其主要原因是 。
②有时候铁制品腐蚀不一定是因为锈蚀而引起的,如用铁桶盛装农药波尔多液(含硫酸铜溶液)就很容易被腐蚀,写出该反应的化学方程式 。
五、综合题
19.填空
(1)在“南海一号”打捞出来的文物中,“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少.这说明金、铜、铁这三种金属的活动顺序由强到弱的顺序是 .
(2)生铁和钢是世界上用量最大的 (填“金属材料”或“合成材料”).炼铁的原理是利用一氧化碳与氧化铁反应,反应的化学方程式为 .写出防止铁生锈的一种方法: .
20.如图是家用豆浆机,请回答下列问题:
(1)豆浆机上的聚苯乙烯指示灯罩的主要成分是[CH2﹣CH(C6H5)]n,从物质组成进行分类,这一类含碳化合物属于 ;
(2)豆浆机使用不锈钢外壳,其采用的防锈蚀的方法是 .
答案解析部分
1.【答案】D
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】A
6.【答案】D
7.【答案】A
8.【答案】D
9.【答案】C
10.【答案】D
11.【答案】B
12.【答案】C
13.【答案】强;化学性质不活泼或性质稳定或难与其它物质反应等等
14.【答案】(1)纯铜片
(2)
(3)SO2
15.【答案】(1)3;240
(2)解:消耗20.0%硫酸铜的总质量为80.0g×3=240.0g,则硫酸铜的质量为=240.0g×20.0%=48g;
设合金中锌的质量分数为,
所以,锌的质量分数=。
答:合金粉末中金属锌的质量分数为38.8%。
(3)如图:
16.【答案】(1)0.035g
(2)铁的金属活动性排在氢的前面,会置换出稀硫酸中的氢
(3)解:设5g该硫酸溶液中含H2SO4的质量为x,
x=0.49g
该硫酸溶液中溶质的质量分数为×100%=9.8%。
答:该硫酸溶液中溶质的质量分数为9.8%
(4)
17.【答案】(1)除去表面的附着物;a;Ti的金属活动性比Mg弱;不能;反应速率与反应物浓度有关
(2)小红;Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应;金属活动性;相对原子质量
(3)产生红色固体,溶液由蓝色变成浅绿色
18.【答案】(1)干燥空气中;有水无空气时;试管中放入铁钉,注入蒸馏水,使铁钉部分浸人水中;C
(2)③;氮气化学性质很稳定,通常不与其它物质反应
(3)铁在潮湿的空气中容易生锈,沿海地区的空气湿度较大,盐分高;Fe+CuSO4=Cu+FeSO4
19.【答案】(1)铁、铜、金
(2)金属材料;3CO+Fe2O3 2Fe+3CO2;在铁制品表面镀一层其他金属等
20.【答案】(1)有机物
(2)制成合金钢
一、单选题
1.下列有关实验现象的描述,正确的是( )
A.电解水的实验中正极所产生的气体约是负极气体体积的2倍且能燃烧
B.镁条在空气中燃烧发出耀眼的白光,生成一种黑色物质
C.一氧化碳在空气中燃烧发出黄色火焰并放出热量
D.将打磨过的铝丝伸入硫酸铜溶液中一会儿,其表面有一层红色物质
2.下图所示的四个图像,能正确反映对应变化关系的是( )
A.镁在氧气中燃烧
B.向二氧化锰中加入过氧化氢溶液
C.向一定质量铁粉和铜粉的混合物中加入硫酸铜溶液
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
3.地壳中含量最多的元素是( )
A.O B.Si C.Al D.Fe
4.地壳中含量最多的元素是( )
A.氮元素 B.氧元素 C.铝元素 D.氢元素
5.高铁列车车体材料使用含镍不锈钢,工业上炼镍的原理之C+2NiO 2Ni+CO2↑。下列说法错误的是( )
A.含镍不锈钢的硬度小于纯铁
B.火法炼镍的反应是置换反应
C.含镍不锈钢属于一种铁合金
D.火法炼镍的反应中Ni元素化合价降低了
6.建立模型是学习化学的重要方法。下列有关模型正确的是()
A.原子结构模型
B.物质分类模型
C.地壳中各元素含量
D.空气组成模型
7.X、Y、Z三种金属,分别把X、Y放入稀硫酸中,只有X表面有气泡产生;分别把Y和Z放入硝酸银溶液中,只有Y表面有银析出。综上所述X、Y、Z的金属活动性由强到弱的顺序是( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
8.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列说法正确的是( )
A.丁一定是化合物
B.该反应是置换反应
C.丙一定是该反应的催化剂
D.反应前后甲和乙变化的质量比为9:8
9.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应错误的是( )
A. B.
C. D.
10.某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是( )
A.将Fe、Cu分别加入AgNO3溶液中
B.将Fe、Cu、Ag分别加入稀盐酸中
C.将Fe分别加入CuSO4、AgNO3溶液中
D.将Fe、Ag分别加入CuSO4溶液中
11.将天平调节平衡,在左右两端放上等质量等质量分数的稀盐酸,然后向左、右两盘盐酸中分别放入等质量的金属X、Y,在反应的过程中指针向左偏转,完全反应后(盐酸足量)指针向右偏转,则X、Y与下列金属相符的是( )
A.X:Fe Y:Mg B.X:Fe Y:Zn
C.X:Mg Y:Al D.X:Al Y:Zn
12.下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.C+H2O CO+H2
C.Cl2+H2O=HCl+HClO D.2F2+2H2O=4HF+O2
二、填空题
13.铁路上铺设钢轨常利用铝热反应:2Al+Fe2O3 2Fe+Al2O3,该反应说明铝的活动性比铁 (填“强”或“弱”);黄金是一种贵重金属,各种黄金首饰易于保存,具有收藏价值的主要原因是 .
14.黄金、黄铜(铜锌合金)、黄铁矿(主要成分是FeS2)都是金黄色固体。
(1)将黄铜片和纯铜片相互刻划时有明显划痕的是 。
(2)将黄铜片放入稀硫酸中发生反应的化学方程式是 。
(3)工业上用黄铁矿为原料生产硫酸,第一步的反应为
。则X的化学式为 。
三、计算题
15.为测定某铜锌合金的成分含量进行了如下实验:将320.0g20.0%的硫酸铜溶液分成四等份,逐次加入至50.3g的合金粉末中,充分反应后得到如下数据。
第1次 第2次 第3次 第4次
加入硫酸铜溶液的质量/g 80.0 80.0 80.0 80.0
剩余固体的质量/g 50.2 50.1 50.0 50.0
(1)第 次加入硫酸铜溶液时反应恰好完全,此时消耗的硫酸铜溶液总质量为 g。
(2)计算合金粉末中金属锌的质量分数(结果精确至0.1%)。
(3)在下图中画出加入硫酸铜溶液质量0~320.0g过程中,溶液中硫酸盐溶质的总质量对应的变化图,并标注必要的数值。
16.铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g于烧杯中,然后等量分5次加入未知质量分数的稀硫酸,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
项目 第1次 第2次 第3次 第4次 第5次
加入稀硫酸的质量/g 5 5 5 5 5
每次产生气体的质量/g 0.01 0.01 0.01 0.005 0
(1)完全反应后总共生成的氢气质量为 。
(2)铜粉中混有的铁粉能与酸反应的原因是 。
(3)计算稀硫酸的质量分数 (写出计算过程)。
(4)请在下图中画出产生的氢气质量与加入的硫酸溶液质量产生的关系示意图 。
四、实验探究题
17.【提出假设】a.Ti的金属活动性比Mg强;b.Ti的金属活动性介于Mg和Ag之间.
【查阅资料】在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
(1)【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象.
请回答:三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 .
【实验现象】
金属 Ti Mg Ag
反应现象 反应缓慢 反应强烈 无明显现象
【实验结论】原假设中 不正确,理由是 .
【结论】用不同浓度的足量稀盐酸反应,是否也能得出同样结论? ,请说明理由
(2)小刚与小红分别做相同质量的不同金属与同质量、同质量分数的稀H2SO4反应的实验,实验结束后,分别交上的实验报告,并绘制出金属Zn、Fe分别与稀H2SO4反应放出H2的函数图象(如图所示).
两个图象中存在有错误的是 的图象,判断错误的理由是 ,
图象不同的原因是 .
由该实验可以得到的结论:
①金属与酸反应的速率与 有关.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与 有关.
(3)将铁粉加到硫酸铜溶液中,可能观察到的现象有 .
18.全世界每年因生锈而损失的钢铁约占世界钢铁年产量的1/4.某同学想探究铁生锈的条件,他将干净的铁钉分别同时放入A、B、C三支试管中进行探究。
(1)(设计实验)请你帮助该同学完成下列实验设计的内容:
编号 操作方法 实验目的
A 在干燥的试管中放入铁钉,并放入少量氯 化钙做干燥剂 探究铁在 铁的生锈情况
B 放入铁钉,注入蒸馏水浸没铁钉,并用植 物油液封 探究铁在 铁的生锈情况
C 探究铁在有氧气和水同时存在时的生锈情况
(实验结论)一周后,编号为 的试管中的铁钉最易生锈。
(2)(扩展延伸)苹果切开不久,果肉上就会产生一层咖啡色的物质,也好象是生了“锈”一样。
切开的苹果“生锈”与什么因素有关?
猜想①:可能与空气没有关系,只是果肉内的物质自身相互反应而“生锈”。
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”。
猜想③:可能是果肉中的物质与空气中的氮气作用而“生锈”。
猜想④:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”。
查阅资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生反应,生成咖啡色的物质。且不切开的苹果没有此现象,所以苹果“生锈”与猜想①无关。
在②﹣④猜想中,你认为猜想 最不合理,理由是 。
(3)(实践应用)
①用相同材料制作,经过相同防锈处理的铁栏杆,安装在沿海比安装在内陆更易生锈,其主要原因是 。
②有时候铁制品腐蚀不一定是因为锈蚀而引起的,如用铁桶盛装农药波尔多液(含硫酸铜溶液)就很容易被腐蚀,写出该反应的化学方程式 。
五、综合题
19.填空
(1)在“南海一号”打捞出来的文物中,“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少.这说明金、铜、铁这三种金属的活动顺序由强到弱的顺序是 .
(2)生铁和钢是世界上用量最大的 (填“金属材料”或“合成材料”).炼铁的原理是利用一氧化碳与氧化铁反应,反应的化学方程式为 .写出防止铁生锈的一种方法: .
20.如图是家用豆浆机,请回答下列问题:
(1)豆浆机上的聚苯乙烯指示灯罩的主要成分是[CH2﹣CH(C6H5)]n,从物质组成进行分类,这一类含碳化合物属于 ;
(2)豆浆机使用不锈钢外壳,其采用的防锈蚀的方法是 .
答案解析部分
1.【答案】D
2.【答案】B
3.【答案】A
4.【答案】B
5.【答案】A
6.【答案】D
7.【答案】A
8.【答案】D
9.【答案】C
10.【答案】D
11.【答案】B
12.【答案】C
13.【答案】强;化学性质不活泼或性质稳定或难与其它物质反应等等
14.【答案】(1)纯铜片
(2)
(3)SO2
15.【答案】(1)3;240
(2)解:消耗20.0%硫酸铜的总质量为80.0g×3=240.0g,则硫酸铜的质量为=240.0g×20.0%=48g;
设合金中锌的质量分数为,
所以,锌的质量分数=。
答:合金粉末中金属锌的质量分数为38.8%。
(3)如图:
16.【答案】(1)0.035g
(2)铁的金属活动性排在氢的前面,会置换出稀硫酸中的氢
(3)解:设5g该硫酸溶液中含H2SO4的质量为x,
x=0.49g
该硫酸溶液中溶质的质量分数为×100%=9.8%。
答:该硫酸溶液中溶质的质量分数为9.8%
(4)
17.【答案】(1)除去表面的附着物;a;Ti的金属活动性比Mg弱;不能;反应速率与反应物浓度有关
(2)小红;Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应;金属活动性;相对原子质量
(3)产生红色固体,溶液由蓝色变成浅绿色
18.【答案】(1)干燥空气中;有水无空气时;试管中放入铁钉,注入蒸馏水,使铁钉部分浸人水中;C
(2)③;氮气化学性质很稳定,通常不与其它物质反应
(3)铁在潮湿的空气中容易生锈,沿海地区的空气湿度较大,盐分高;Fe+CuSO4=Cu+FeSO4
19.【答案】(1)铁、铜、金
(2)金属材料;3CO+Fe2O3 2Fe+3CO2;在铁制品表面镀一层其他金属等
20.【答案】(1)有机物
(2)制成合金钢
同课章节目录
