第三章 金属及其化合物 第二节 金属的材料 第一课时 金属的化学性质(共33张PPT)
文档属性
| 名称 | 第三章 金属及其化合物 第二节 金属的材料 第一课时 金属的化学性质(共33张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 19:57:37 | ||
图片预览









文档简介
(共33张PPT)
第三章 金属及其化合物
第二节 金属材料
第一课时金属的化学性质
说课课题:
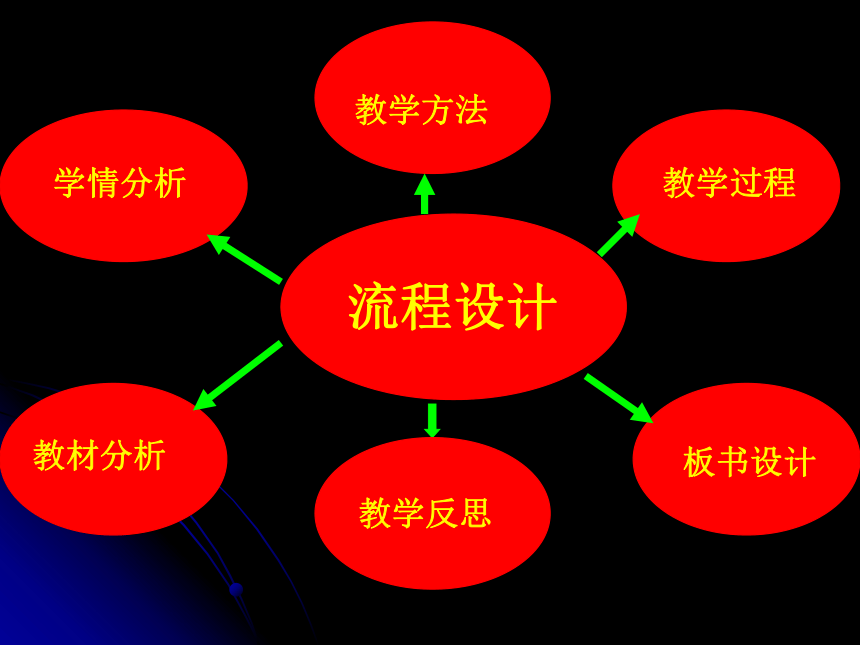
流程设计
学情分析
教学方法
教学过程
板书设计
教材分析
教学反思
一、教材分析—地位和作用
本章是在学习了第一章、第二章知识之后,开始具体地学习元素化合物的知识,既可以为前面的实验和理论知识补充感性认识的材料,也可以为化学必修2介绍的物质结构、元素周期表、化学反应与能量等理论知识打下重要的基础.
地位
作用
一、教材分析—教学目标
认识钠是一种很活泼的金属,了解钠的物理性质、保存和用途,掌握钠的化学性质。
知识目标
培养学生的观察能力、思维能力、自主探究能 力、动手操作能力思维能力和合作能力
能力目标
通过课堂活动参与以及动手做实验,激发学生学习化学的兴趣。
情感目标
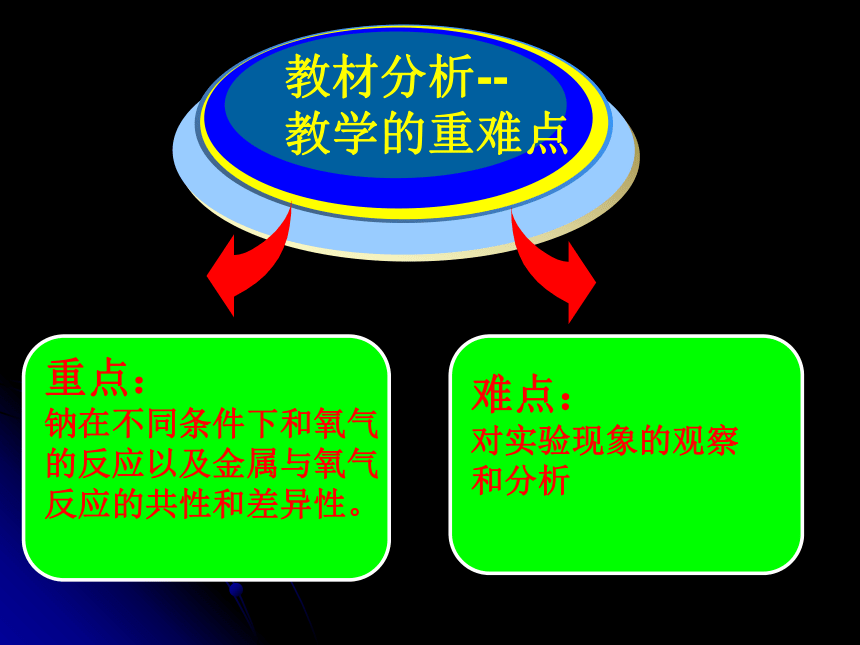
教材分析--
教学的重难点
重点:
钠在不同条件下和氧气
的反应以及金属与氧气
反应的共性和差异性。
难点:
对实验现象的观察
和分析
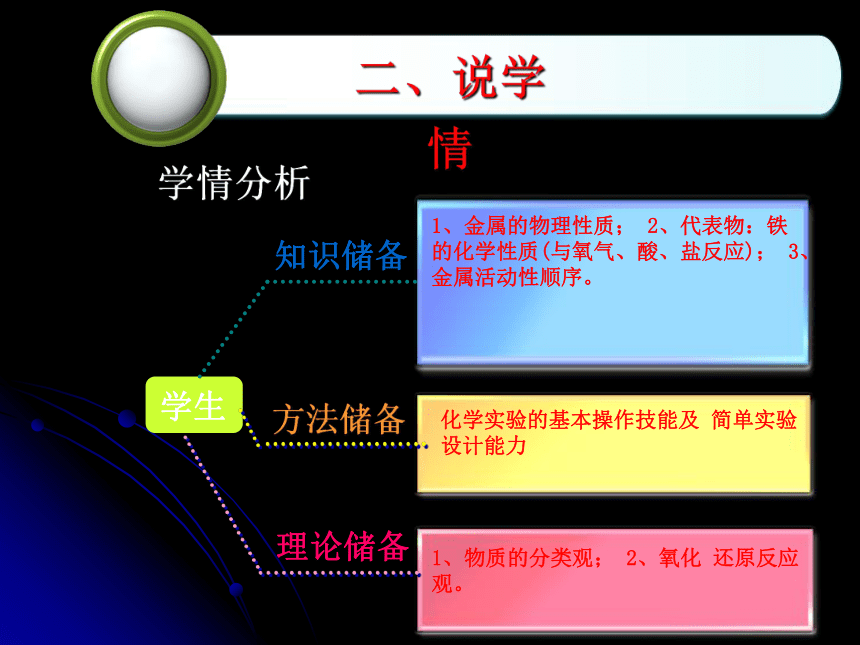
学情分析
化学实验的基本操作技能及 简单实验设计能力
1、金属的物理性质; 2、代表物:铁的化学性质(与氧气、酸、盐反应); 3、金属活动性顺序。
1、物质的分类观; 2、氧化 还原反应观。
学生
方法储备
知识储备
理论储备
二、说学情
三、说学法
1、分组探究
实验操作员
实验观察员
实验记录员
实验报告员
实验监督员
人人参与,自由分工
宗旨:将课堂还给学生
1、学案导学法
四、说教法
3、实验探究法
4、归纳比较法
2、启发式教学法
实验探究
观察现象
→
提出问题
→
分析讨论
→
练习巩固
→
得出结论
→
指导学生复习回顾,明确学习目标。
创设情境
四、说教学过程
五、说教学过程
一、图片展示,激发兴趣
二、创设情景,提出问题
三、动手实验,观察引导
四、学以致用,巧解疑惑
五、自主思考,科学探究
六、对比归纳,总结提升
七、当堂反馈,巩固所学
日常生活中常见的金属
(一)图片展示 激发兴趣
古代的炊具
甗
鬲
簋
常见的矿石
赤铁矿
主要成分是Fe2O3
黄铁矿
主要成分是FeS2
菱铁矿
主要成分是FeCO3
铝土矿
主要成分是Al2O3
黄铜矿
主要成分是CuFeS2
辉铜矿
主要成分是Cu2S3
地球上绝大多数金属是
以化合态存在于自然界
金属光泽,不透明,易导电导热,有延展性等。
金属有哪些共同物理性质?
思考与交流
金属所同有的化学性质?
2Al + 3CuSO4 = 3Cu + Al2 (SO4) 3
Cu + 2AgNO3 = Cu(NO3) 2 + 2Ag
2Mg + O2 点燃 2MgO
Mg + 2HCl = H2 ↑+ MgCl2
在广州市珠江河段曾经发生过惊险神秘的“水雷”,6个装满金属钠的铁皮水桶浮在水面上,其中3个发生剧烈爆炸,另三个被成功打捞。据现场的同志讲,早上10点多,河内突然冒起一股白烟,在水面上漂浮的一个铁桶内窜出黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。群众议论说,“没想到水里的东西也能着火爆炸。”打捞上来的桶被打开盖子后,马上冒出白烟,而且,一旦人们接触了桶内的物质,双手感到剧烈的疼痛……
(二)创设情境,提出问题
珠江河段“水雷”剧烈爆炸 元凶竟是金属钠
1.为什么装满金属钠的铁桶不下沉?
2.消防队员将打捞上来的铁桶如何处理?
3.为什么“水里的东西也能着火爆炸”?
4.为什么打捞上来的桶被打开盖子后,马上冒出白烟,而且一旦人们接触了桶内的物质,双手感到剧烈的疼痛?
设计意图:创设社会型的学习环境
(二)创设情境,提出问题
用镊子取钠块置于玻璃片上,用滤纸吸干表面的煤油后,并用小刀切下绿豆大的一块钠,放置观察断面的光泽和颜色以及相关变化。
可以用小刀切割 说明什么?
观察颜色变化
钠的保存方法及原因
1
(三)动手实验,观察引导
一、金属与非金属反应:
1、钠与氧气的反应
钠与氧气常温就能反应,如果温度升高会怎样呢?——引出钠在氧气中燃烧的反应。
(三)动手实验,观察引导
将黄豆大的一块钠放入玻璃燃烧匙中,加热。当钠熔成小球并开始燃烧时,停止加热,这样改进便于观察钠的熔化、反应产物的颜色、状态。
钠在氧气中燃烧——改进实验
2
(三)动手实验,观察引导
学完钠的性质后,解决前面情景中提出的问题: (1)为什么装满金属钠的铁桶不下沉? (2)消防队员将打捞上来的铁桶如何处理?
(3)为什么“水里的东西也能着火爆炸”?
设计意图:让学生利用所获取的知识,解释前面提出的问题:加深学生对钠性质的认识。
(四)学以致用,巧解疑惑
(五)自主思考,科学探究
用镊子夹住一块铝箔,在酒精灯上加热,观察现象。
现象:不燃烧,铝箔熔化但不滴落,
2、铝与氧气的反应探究
好像有一层膜兜着
3
(五)自主思考,科学探究
思考与交流 1
是什么因素造成了铝箔在空气中和氧气中均不能燃烧?
铝箔表面有一层致密的氧化物保护膜,保护了内层铝不被氧化,所以不能燃烧。
如果将铝箔表面打磨,破坏其氧化膜,结果又将如何?
设疑
(五)自主思考,科学探究
4
取一块铝箔,用砂纸小心打磨后,在酒精灯上加热,观察现象。
思考与交流 2
打磨过的铝箔在空气中很快又生成了新的氧化膜,有效保护了内层金属,从而不能燃烧。
(五)自主思考,科学探究
演示实验
银
金
学生实验
铜丝
(五)自主思考,科学探究
设计意图:培养学生的动手实验、现象观察、逻辑推理能力及小组合作意识。
Na Mg Al Fe Cu Ag Au
与氧气反应 常 温
加 热
结论
学生活动
填表自主总结
物质
现象
及产物
反
应
发现共性 和差异性
金属单质 + 氧气 金属氧化物
结论:金属与氧气反应的情况与金属的活泼性有关,金属越活泼就越容易与氧气反应。
设计意图:培养学生的知识归纳和评价能力;回扣落实三维教学目标。
(六)对比归纳,总结提升
(七)当堂反馈,巩固所学
设计意图:通过练习,当场反馈,解决问题,巩固所学。
教学反思
“主动参与、乐于探究,交流与合作”
孔子曰:“知之者不如好知者,好知者不如乐知者。”
2Na + Cl2 = 2NaCl
点燃
板书设计
第一节 金属的化学性质
一、钠的物理性质
一、金属与非金属的反应
1、钠与氧气的反应
2、铝与氧气的反应
4Na + O2 === 2Na2O(白色)
2Na + O2 === Na2O2(淡黄色)
△
点燃
4Al+3O2===2Al2O3
2Na + S = Na2S
点燃
第三章 金属及其化合物
第二节 金属材料
第一课时金属的化学性质
说课课题:
流程设计
学情分析
教学方法
教学过程
板书设计
教材分析
教学反思
一、教材分析—地位和作用
本章是在学习了第一章、第二章知识之后,开始具体地学习元素化合物的知识,既可以为前面的实验和理论知识补充感性认识的材料,也可以为化学必修2介绍的物质结构、元素周期表、化学反应与能量等理论知识打下重要的基础.
地位
作用
一、教材分析—教学目标
认识钠是一种很活泼的金属,了解钠的物理性质、保存和用途,掌握钠的化学性质。
知识目标
培养学生的观察能力、思维能力、自主探究能 力、动手操作能力思维能力和合作能力
能力目标
通过课堂活动参与以及动手做实验,激发学生学习化学的兴趣。
情感目标
教材分析--
教学的重难点
重点:
钠在不同条件下和氧气
的反应以及金属与氧气
反应的共性和差异性。
难点:
对实验现象的观察
和分析
学情分析
化学实验的基本操作技能及 简单实验设计能力
1、金属的物理性质; 2、代表物:铁的化学性质(与氧气、酸、盐反应); 3、金属活动性顺序。
1、物质的分类观; 2、氧化 还原反应观。
学生
方法储备
知识储备
理论储备
二、说学情
三、说学法
1、分组探究
实验操作员
实验观察员
实验记录员
实验报告员
实验监督员
人人参与,自由分工
宗旨:将课堂还给学生
1、学案导学法
四、说教法
3、实验探究法
4、归纳比较法
2、启发式教学法
实验探究
观察现象
→
提出问题
→
分析讨论
→
练习巩固
→
得出结论
→
指导学生复习回顾,明确学习目标。
创设情境
四、说教学过程
五、说教学过程
一、图片展示,激发兴趣
二、创设情景,提出问题
三、动手实验,观察引导
四、学以致用,巧解疑惑
五、自主思考,科学探究
六、对比归纳,总结提升
七、当堂反馈,巩固所学
日常生活中常见的金属
(一)图片展示 激发兴趣
古代的炊具
甗
鬲
簋
常见的矿石
赤铁矿
主要成分是Fe2O3
黄铁矿
主要成分是FeS2
菱铁矿
主要成分是FeCO3
铝土矿
主要成分是Al2O3
黄铜矿
主要成分是CuFeS2
辉铜矿
主要成分是Cu2S3
地球上绝大多数金属是
以化合态存在于自然界
金属光泽,不透明,易导电导热,有延展性等。
金属有哪些共同物理性质?
思考与交流
金属所同有的化学性质?
2Al + 3CuSO4 = 3Cu + Al2 (SO4) 3
Cu + 2AgNO3 = Cu(NO3) 2 + 2Ag
2Mg + O2 点燃 2MgO
Mg + 2HCl = H2 ↑+ MgCl2
在广州市珠江河段曾经发生过惊险神秘的“水雷”,6个装满金属钠的铁皮水桶浮在水面上,其中3个发生剧烈爆炸,另三个被成功打捞。据现场的同志讲,早上10点多,河内突然冒起一股白烟,在水面上漂浮的一个铁桶内窜出黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。群众议论说,“没想到水里的东西也能着火爆炸。”打捞上来的桶被打开盖子后,马上冒出白烟,而且,一旦人们接触了桶内的物质,双手感到剧烈的疼痛……
(二)创设情境,提出问题
珠江河段“水雷”剧烈爆炸 元凶竟是金属钠
1.为什么装满金属钠的铁桶不下沉?
2.消防队员将打捞上来的铁桶如何处理?
3.为什么“水里的东西也能着火爆炸”?
4.为什么打捞上来的桶被打开盖子后,马上冒出白烟,而且一旦人们接触了桶内的物质,双手感到剧烈的疼痛?
设计意图:创设社会型的学习环境
(二)创设情境,提出问题
用镊子取钠块置于玻璃片上,用滤纸吸干表面的煤油后,并用小刀切下绿豆大的一块钠,放置观察断面的光泽和颜色以及相关变化。
可以用小刀切割 说明什么?
观察颜色变化
钠的保存方法及原因
1
(三)动手实验,观察引导
一、金属与非金属反应:
1、钠与氧气的反应
钠与氧气常温就能反应,如果温度升高会怎样呢?——引出钠在氧气中燃烧的反应。
(三)动手实验,观察引导
将黄豆大的一块钠放入玻璃燃烧匙中,加热。当钠熔成小球并开始燃烧时,停止加热,这样改进便于观察钠的熔化、反应产物的颜色、状态。
钠在氧气中燃烧——改进实验
2
(三)动手实验,观察引导
学完钠的性质后,解决前面情景中提出的问题: (1)为什么装满金属钠的铁桶不下沉? (2)消防队员将打捞上来的铁桶如何处理?
(3)为什么“水里的东西也能着火爆炸”?
设计意图:让学生利用所获取的知识,解释前面提出的问题:加深学生对钠性质的认识。
(四)学以致用,巧解疑惑
(五)自主思考,科学探究
用镊子夹住一块铝箔,在酒精灯上加热,观察现象。
现象:不燃烧,铝箔熔化但不滴落,
2、铝与氧气的反应探究
好像有一层膜兜着
3
(五)自主思考,科学探究
思考与交流 1
是什么因素造成了铝箔在空气中和氧气中均不能燃烧?
铝箔表面有一层致密的氧化物保护膜,保护了内层铝不被氧化,所以不能燃烧。
如果将铝箔表面打磨,破坏其氧化膜,结果又将如何?
设疑
(五)自主思考,科学探究
4
取一块铝箔,用砂纸小心打磨后,在酒精灯上加热,观察现象。
思考与交流 2
打磨过的铝箔在空气中很快又生成了新的氧化膜,有效保护了内层金属,从而不能燃烧。
(五)自主思考,科学探究
演示实验
银
金
学生实验
铜丝
(五)自主思考,科学探究
设计意图:培养学生的动手实验、现象观察、逻辑推理能力及小组合作意识。
Na Mg Al Fe Cu Ag Au
与氧气反应 常 温
加 热
结论
学生活动
填表自主总结
物质
现象
及产物
反
应
发现共性 和差异性
金属单质 + 氧气 金属氧化物
结论:金属与氧气反应的情况与金属的活泼性有关,金属越活泼就越容易与氧气反应。
设计意图:培养学生的知识归纳和评价能力;回扣落实三维教学目标。
(六)对比归纳,总结提升
(七)当堂反馈,巩固所学
设计意图:通过练习,当场反馈,解决问题,巩固所学。
教学反思
“主动参与、乐于探究,交流与合作”
孔子曰:“知之者不如好知者,好知者不如乐知者。”
2Na + Cl2 = 2NaCl
点燃
板书设计
第一节 金属的化学性质
一、钠的物理性质
一、金属与非金属的反应
1、钠与氧气的反应
2、铝与氧气的反应
4Na + O2 === 2Na2O(白色)
2Na + O2 === Na2O2(淡黄色)
△
点燃
4Al+3O2===2Al2O3
2Na + S = Na2S
点燃
