第八章 化学与可持续发展 第一节 自然资源的开发利用 说课金属矿物的开发利用(共37张PPT)
文档属性
| 名称 | 第八章 化学与可持续发展 第一节 自然资源的开发利用 说课金属矿物的开发利用(共37张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-03 19:58:53 | ||
图片预览








文档简介
(共37张PPT)
金属矿物的开发利用
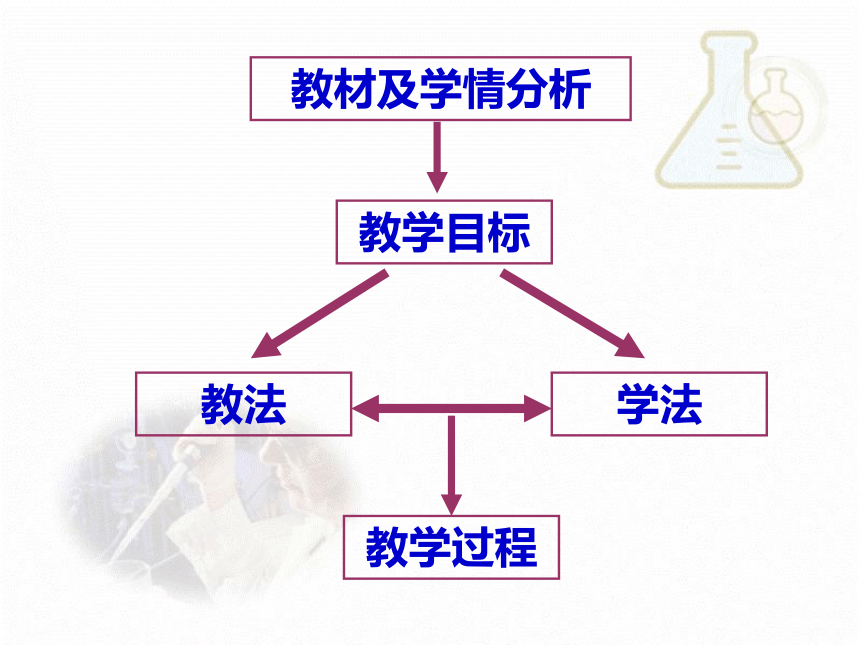
说课题目:
教材及学情分析
教学目标
教法
学法
教学过程
能力具备:一定自学能力
查阅资料、归纳整理
制作幻灯片
知识储备:金属活动性顺序
金属冶炼的有关反应
氧化还原反应原理。
学情分析
知识整合、迁移概括能力有待提高
不了解金属冶炼的历史,金属活动顺序表与金属冶炼方法的关系
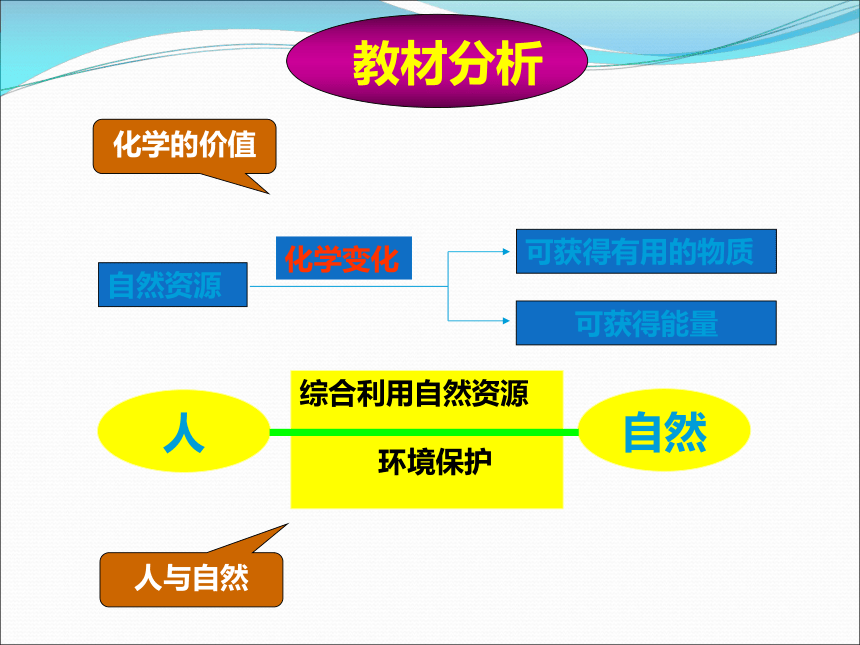
自然资源
可获得有用的物质
可获得能量
化学变化
人
自然
综合利用自然资源
环境保护
化学的价值
人与自然
教材分析
本课时是以金属活动顺序表、氧化还原反应为依托
探究金属的冶炼原理、金属资源的回收和利用。
帮助学生认识和体会化学在自然资源开发和利用中的意义和作用。
揭示化学与可持续发展的重要关系,树立资源保护意识几合理开发意识。
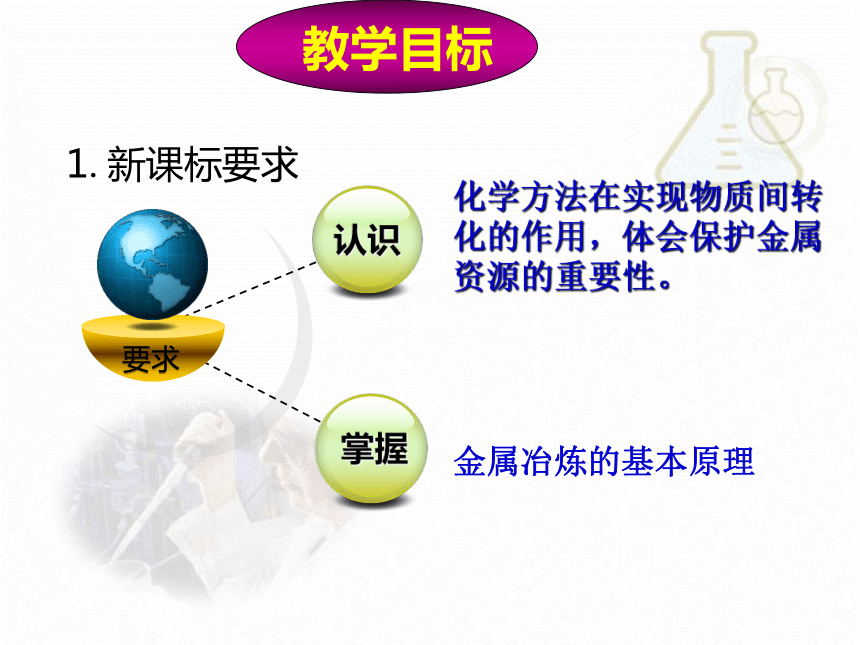
1.新课标要求
要求
掌握
认识
金属冶炼的基本原理
化学方法在实现物质间转化的作用,体会保护金属资源的重要性。
教学目标
2.三维目标
知识技能
(1)了解金属元素在自然界的存在形态。
(2)掌握金属冶炼的一般原理基础及不同金属的冶炼方法。
过程方法
(1)通过学生自学和查阅相关资料,培养学生分析概括的能力 。
(2)通过实验培养学生学会运用观察、实验、比较、分类归纳、概括等方法对获取的信息进行加工,同时训练学生的口头表达能力和交流能力。
情感态度
价值观
(1)体会化学在自然资源开发和利用中的意义和作用,解释化学与可持续发展的重要关系,树立资源保护意识及合理开发意识。
(2) 了解金属冶炼的历史增强学生的民族自豪感。
3.教学重、难点
①了解化学方法在金属矿物开发(主要是金属冶炼)的作用。
②学生在掌握金属冶炼的一般原理基础上,了解适用于不同金属的冶炼方法。
实验促学法:通过教师的演示,观察分析实验现象,理解并掌握金属冶炼的方法。
情景激学法:创设问题的意境,激发学习兴趣。
多媒体辅助教学法:运用先进的教学手段,有助于学生对于化学反应的认识
教法
(1)课前布置学案作业,帮助学生自学,为学生的自主学习打造空间。
(2)查阅常见几种金属的存在、冶炼方法、用途及回收途径。
学生以小组形式通过合作、对问题的探究、讨论、归纳,最终掌握金属冶炼的方法。
学 法
沿着金属开发、利用的历史脉络。归纳金属冶炼方法,总结金属冶炼方法选择依据,从金属冶炼方法的变革体现化学技术的发展。
教学过程
1.我国有丰富的矿产资源,你知道从金属矿物中提炼金属,一般要经过哪些步骤?
2. 金属的存在形态有什么规律?要将化合态的金属矿物转化为金属单质,有哪些方法?其实质是什么?
3.在金属的冶炼中对环境会有怎样的影响?
*
金矿
Au
铂矿
Pt
少数不活泼金属以游离态存在(如金和铂)
*
白云石
CaMg[CO3]2
辰砂
HgS
黄铜矿
CuFeS2
菱镁矿
MgCO3
大多数金属以化合态存在
如果需要金属单质,那怎么办?
——冶炼金属
常见的金属矿物资源
*
在富集好的矿石中利用不同方法将金属还原出来,最后进行提纯。
大多数金属矿石里含有杂质,如石英、石灰石等,因此在冶炼金属时首先需要富集矿石。
金属的冶炼:
将金属从其化合物中还原出来用
于生产和制造各种金属材料的过程在
工业上称为金属的冶炼
一、金属矿物的开发利用
辉铜矿Cu2S
青铜时期中国始于3800年前,兴于商周时期。
主要用于制礼器、乐器、兵器。
制陶工艺后期改进了
窑的结构,加深了火膛
,缩小了火口使空气更
加充足,温度更高。这
时无意中闻到了刺激性
气味的气体,发现了金
属铜。原来是因为建窑
的过程中用到了辉铜矿。
根据资料写出制出铜的反应?
Cu2S + O2 2Cu + SO2
高温
殷墟考古发现, 3000多年前我国古代劳动人民就掌握了孔雀石炼铜工艺,他们将孔雀石,主要成分
Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写出化学反应原理
孔雀石Cu2(OH)2CO3
Cu2(OH)2CO3 = 2CuO + H2O + CO2↑
孔雀石
C + 2CuO == CO2 ↑ + 2Cu
高温
青铜时期
我国古代炼铁工业长期领先于世界,我国在西汉初时已经懂得将铁矿石(Fe2O3)和木炭一层一层的堆放在炼铁炉中,点火燃烧产生CO从而使铁矿石中的铁还原为单质。领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。
铁器时代
Fe2O3+3CO 2Fe+3CO2
高温
宋代时期,人们发现江西上饶有一口
苦泉,蒸发这种苦泉水会得到胆矾,熬苦泉水
的铁锅用久了会变成铜锅。这就是最早的湿法炼铜请写出该反应的离子方程式
。
Fe+Cu2+ = Cu+Fe2+
铁器时代
最早的湿法炼铜为什么出现在铁器时代呢?
自从美国青年化学家
霍尔发明电解制铝法后,
制铝工 艺不断改进,现在
人们已经熟练掌握了从铝
土矿(主要成 分是Al2O3)
中冶炼铝的技术,使得制
铝成本大大下降,使铝走
入千家万户。
近代铝的冶炼
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
铝土矿
100多年前,为了表彰门捷列夫对化学的杰出贡献,英国皇家学会不惜重金制作了一个比黄金还要贵重的奖杯——铝杯,赠送给门捷列夫。
思考:为什么这个时期铝比金还贵重呢?
近代铝的冶炼19世纪后期到20世纪初
由于早期炼铝十分困难,所以铝的价格十分昂贵,一度超越金银之上,直至19世纪上半叶,铝还是欧洲许多高级珠宝店的高档货。这也是铝在地壳中含量比铜、铁多,而应用比铜 、铁晚的多的原因。
金属冶炼的原理在现代应用
火车道上的钢轨有了缝隙怎么办?
铝热反应的应用:
2Al+Fe2O3 2Fe+Al2O3
高温
实验现象:
剧烈反应,
放出大量的热,
发出耀眼的光芒,
有黑色铁块生成
铝热反应:
反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
Fe2O3+2Al = 2Fe + Al2O3
高温
1、镁条的作用是什么?
2、氯酸钾的作用是什么?
铝热剂
问题:
与氧气反应放出大量的热,为铝热反应提供热量。
受热分解产生氧气,使镁条继续燃烧提供热量。
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等。
开阔视野:
铝+某些金属氧化物 Al2O3+金属
高温
试写出分别Al与MnO2、Cr2O3反应的铝热方程式
3MnO2+4Al === 3Mn+ 2Al2O3
高温
Cr2O3+2Al === 2Cr + Al2O3
高温
二、金属冶炼的一般方法:
(2)热分解法(适合一些不活泼金属)
2HgO === 2Hg + O2 ↑
加热
2Ag2O === 4Ag + O2 ↑
加热
(1)物理提取法
(适用于极不活泼的金属——Pt、Au)
(3)电解法(适合一些非常活泼金属)
MgCl2 (熔融) === Mg + Cl2 ↑
电解
2Al2O3 (熔融) === 4Al + 3O2 ↑
电解
冰晶石
2NaCl (熔融) === 2Na + Cl2 ↑
电解
思考:电解氯化钠溶液能制得钠吗?
(4)热还原法(适用于大部分金属)
CuO+H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2 ↑
高温
注:除了CO、H2、C等做还原剂外,一
些活泼金属如Al等也可做还原剂还原金属
由于不同的金属离子的得电子能力不同,所以要采用不同强度的冶炼方法
K Ca Na Mg Al Zn Fe…Cu Hg Ag Pt Au
电解法
热还原法
热分解法
*
物理提取法
结论:①金属位置越靠后,越易被还原,用一般 的还原方法即可;
②金属位置越靠前,越难被还原,要用较 强的还原手段来还原
一些金属资源还能开采多久?
金属资源日渐减少,如何解决这一难题呢?
问题延伸——金属资源的合理开发利用
金属铝的回收与利用
(1)废旧钢铁用于炼钢;
(2)废铁屑用于制铁盐;
(3)定影液用于回收银
回收金属的实例
回收金属的意义:
(1)节约矿物资源(2)节约能源(3)减少环境污染
板书设计
第一节 开发利用金属矿物和海水资源
一、金属矿物的开发和利用
1.金属冶炼的实质 :
根据金属阳离子的电子的能力不同,采用不同的冶炼方法。
2.金属冶炼的方法
(1)热分解法:2HgO ==2Hg+O2↑ 2Ag2O== 4Ag+O2↑
(2)电解法:MgCl2(熔融)==Mg+Cl2↑ (电解)
(3)热还原法:
1、常是用还原剂:C、CO、H2、活泼金属等
2、铝热反应: Fe2O3+2Al==2Fe+Al2O3 (高温)
应用: 1、野外焊接。2、冶炼难熔金属
3、金属的回收与环境、资源保护
作业设计
请查阅资料,了解我国矿产资源利用的现状。 并制作一张海报。
金属矿物的开发利用
说课题目:
教材及学情分析
教学目标
教法
学法
教学过程
能力具备:一定自学能力
查阅资料、归纳整理
制作幻灯片
知识储备:金属活动性顺序
金属冶炼的有关反应
氧化还原反应原理。
学情分析
知识整合、迁移概括能力有待提高
不了解金属冶炼的历史,金属活动顺序表与金属冶炼方法的关系
自然资源
可获得有用的物质
可获得能量
化学变化
人
自然
综合利用自然资源
环境保护
化学的价值
人与自然
教材分析
本课时是以金属活动顺序表、氧化还原反应为依托
探究金属的冶炼原理、金属资源的回收和利用。
帮助学生认识和体会化学在自然资源开发和利用中的意义和作用。
揭示化学与可持续发展的重要关系,树立资源保护意识几合理开发意识。
1.新课标要求
要求
掌握
认识
金属冶炼的基本原理
化学方法在实现物质间转化的作用,体会保护金属资源的重要性。
教学目标
2.三维目标
知识技能
(1)了解金属元素在自然界的存在形态。
(2)掌握金属冶炼的一般原理基础及不同金属的冶炼方法。
过程方法
(1)通过学生自学和查阅相关资料,培养学生分析概括的能力 。
(2)通过实验培养学生学会运用观察、实验、比较、分类归纳、概括等方法对获取的信息进行加工,同时训练学生的口头表达能力和交流能力。
情感态度
价值观
(1)体会化学在自然资源开发和利用中的意义和作用,解释化学与可持续发展的重要关系,树立资源保护意识及合理开发意识。
(2) 了解金属冶炼的历史增强学生的民族自豪感。
3.教学重、难点
①了解化学方法在金属矿物开发(主要是金属冶炼)的作用。
②学生在掌握金属冶炼的一般原理基础上,了解适用于不同金属的冶炼方法。
实验促学法:通过教师的演示,观察分析实验现象,理解并掌握金属冶炼的方法。
情景激学法:创设问题的意境,激发学习兴趣。
多媒体辅助教学法:运用先进的教学手段,有助于学生对于化学反应的认识
教法
(1)课前布置学案作业,帮助学生自学,为学生的自主学习打造空间。
(2)查阅常见几种金属的存在、冶炼方法、用途及回收途径。
学生以小组形式通过合作、对问题的探究、讨论、归纳,最终掌握金属冶炼的方法。
学 法
沿着金属开发、利用的历史脉络。归纳金属冶炼方法,总结金属冶炼方法选择依据,从金属冶炼方法的变革体现化学技术的发展。
教学过程
1.我国有丰富的矿产资源,你知道从金属矿物中提炼金属,一般要经过哪些步骤?
2. 金属的存在形态有什么规律?要将化合态的金属矿物转化为金属单质,有哪些方法?其实质是什么?
3.在金属的冶炼中对环境会有怎样的影响?
*
金矿
Au
铂矿
Pt
少数不活泼金属以游离态存在(如金和铂)
*
白云石
CaMg[CO3]2
辰砂
HgS
黄铜矿
CuFeS2
菱镁矿
MgCO3
大多数金属以化合态存在
如果需要金属单质,那怎么办?
——冶炼金属
常见的金属矿物资源
*
在富集好的矿石中利用不同方法将金属还原出来,最后进行提纯。
大多数金属矿石里含有杂质,如石英、石灰石等,因此在冶炼金属时首先需要富集矿石。
金属的冶炼:
将金属从其化合物中还原出来用
于生产和制造各种金属材料的过程在
工业上称为金属的冶炼
一、金属矿物的开发利用
辉铜矿Cu2S
青铜时期中国始于3800年前,兴于商周时期。
主要用于制礼器、乐器、兵器。
制陶工艺后期改进了
窑的结构,加深了火膛
,缩小了火口使空气更
加充足,温度更高。这
时无意中闻到了刺激性
气味的气体,发现了金
属铜。原来是因为建窑
的过程中用到了辉铜矿。
根据资料写出制出铜的反应?
Cu2S + O2 2Cu + SO2
高温
殷墟考古发现, 3000多年前我国古代劳动人民就掌握了孔雀石炼铜工艺,他们将孔雀石,主要成分
Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写出化学反应原理
孔雀石Cu2(OH)2CO3
Cu2(OH)2CO3 = 2CuO + H2O + CO2↑
孔雀石
C + 2CuO == CO2 ↑ + 2Cu
高温
青铜时期
我国古代炼铁工业长期领先于世界,我国在西汉初时已经懂得将铁矿石(Fe2O3)和木炭一层一层的堆放在炼铁炉中,点火燃烧产生CO从而使铁矿石中的铁还原为单质。领先欧洲一千余年,南宋末年的工匠又掌握了用焦炭炼铁,而欧洲最早的英国直到500年后(相当于清朝乾隆末年),才掌握这一技术。
铁器时代
Fe2O3+3CO 2Fe+3CO2
高温
宋代时期,人们发现江西上饶有一口
苦泉,蒸发这种苦泉水会得到胆矾,熬苦泉水
的铁锅用久了会变成铜锅。这就是最早的湿法炼铜请写出该反应的离子方程式
。
Fe+Cu2+ = Cu+Fe2+
铁器时代
最早的湿法炼铜为什么出现在铁器时代呢?
自从美国青年化学家
霍尔发明电解制铝法后,
制铝工 艺不断改进,现在
人们已经熟练掌握了从铝
土矿(主要成 分是Al2O3)
中冶炼铝的技术,使得制
铝成本大大下降,使铝走
入千家万户。
近代铝的冶炼
2Al2O3 (熔融) 4Al + 3O2 ↑
电解
冰晶石
铝土矿
100多年前,为了表彰门捷列夫对化学的杰出贡献,英国皇家学会不惜重金制作了一个比黄金还要贵重的奖杯——铝杯,赠送给门捷列夫。
思考:为什么这个时期铝比金还贵重呢?
近代铝的冶炼19世纪后期到20世纪初
由于早期炼铝十分困难,所以铝的价格十分昂贵,一度超越金银之上,直至19世纪上半叶,铝还是欧洲许多高级珠宝店的高档货。这也是铝在地壳中含量比铜、铁多,而应用比铜 、铁晚的多的原因。
金属冶炼的原理在现代应用
火车道上的钢轨有了缝隙怎么办?
铝热反应的应用:
2Al+Fe2O3 2Fe+Al2O3
高温
实验现象:
剧烈反应,
放出大量的热,
发出耀眼的光芒,
有黑色铁块生成
铝热反应:
反应现象:镁条剧烈燃烧,放出大量的热,发出耀眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
Fe2O3+2Al = 2Fe + Al2O3
高温
1、镁条的作用是什么?
2、氯酸钾的作用是什么?
铝热剂
问题:
与氧气反应放出大量的热,为铝热反应提供热量。
受热分解产生氧气,使镁条继续燃烧提供热量。
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等。
开阔视野:
铝+某些金属氧化物 Al2O3+金属
高温
试写出分别Al与MnO2、Cr2O3反应的铝热方程式
3MnO2+4Al === 3Mn+ 2Al2O3
高温
Cr2O3+2Al === 2Cr + Al2O3
高温
二、金属冶炼的一般方法:
(2)热分解法(适合一些不活泼金属)
2HgO === 2Hg + O2 ↑
加热
2Ag2O === 4Ag + O2 ↑
加热
(1)物理提取法
(适用于极不活泼的金属——Pt、Au)
(3)电解法(适合一些非常活泼金属)
MgCl2 (熔融) === Mg + Cl2 ↑
电解
2Al2O3 (熔融) === 4Al + 3O2 ↑
电解
冰晶石
2NaCl (熔融) === 2Na + Cl2 ↑
电解
思考:电解氯化钠溶液能制得钠吗?
(4)热还原法(适用于大部分金属)
CuO+H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2 ↑
高温
注:除了CO、H2、C等做还原剂外,一
些活泼金属如Al等也可做还原剂还原金属
由于不同的金属离子的得电子能力不同,所以要采用不同强度的冶炼方法
K Ca Na Mg Al Zn Fe…Cu Hg Ag Pt Au
电解法
热还原法
热分解法
*
物理提取法
结论:①金属位置越靠后,越易被还原,用一般 的还原方法即可;
②金属位置越靠前,越难被还原,要用较 强的还原手段来还原
一些金属资源还能开采多久?
金属资源日渐减少,如何解决这一难题呢?
问题延伸——金属资源的合理开发利用
金属铝的回收与利用
(1)废旧钢铁用于炼钢;
(2)废铁屑用于制铁盐;
(3)定影液用于回收银
回收金属的实例
回收金属的意义:
(1)节约矿物资源(2)节约能源(3)减少环境污染
板书设计
第一节 开发利用金属矿物和海水资源
一、金属矿物的开发和利用
1.金属冶炼的实质 :
根据金属阳离子的电子的能力不同,采用不同的冶炼方法。
2.金属冶炼的方法
(1)热分解法:2HgO ==2Hg+O2↑ 2Ag2O== 4Ag+O2↑
(2)电解法:MgCl2(熔融)==Mg+Cl2↑ (电解)
(3)热还原法:
1、常是用还原剂:C、CO、H2、活泼金属等
2、铝热反应: Fe2O3+2Al==2Fe+Al2O3 (高温)
应用: 1、野外焊接。2、冶炼难熔金属
3、金属的回收与环境、资源保护
作业设计
请查阅资料,了解我国矿产资源利用的现状。 并制作一张海报。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
