内蒙古部分名校2023-2024学年高二上学期期中联合考试化学试题(含答案)
文档属性
| 名称 | 内蒙古部分名校2023-2024学年高二上学期期中联合考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 285.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 07:23:48 | ||
图片预览


文档简介
高二化学考试
考生注意:
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:人教版选择性必修1。
4.可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cu64 Zn65 Pb207
第I卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.化学与生产、生活密切相关。下列过程主要将化学能转化为电能的是
A.电动汽车充电 B.钻木取火 C.蜡烛燃烧 D.强光手电筒照明
2.常温下,下列物质显酸性的是
A.NH4Cl溶液 B.K2SO4溶液
C.Na2CO3溶液 D.Ca(NO3)2溶液
3.下列反应能量的变化与如图所示相符的是
A.碳酸氢钠固体溶于水 B.大理石的分解反应
C.金属镁与稀硫酸的反应 D.稀盐酸与碳酸氢钠溶液的反应
4.下列有关原电池的说法正确的是
A.活泼的金属不一定作负极
B.电池工作时,正极失去电子
C.电池工作时,负极发生还原反应
D.电解质溶液一定不能为浓硝酸
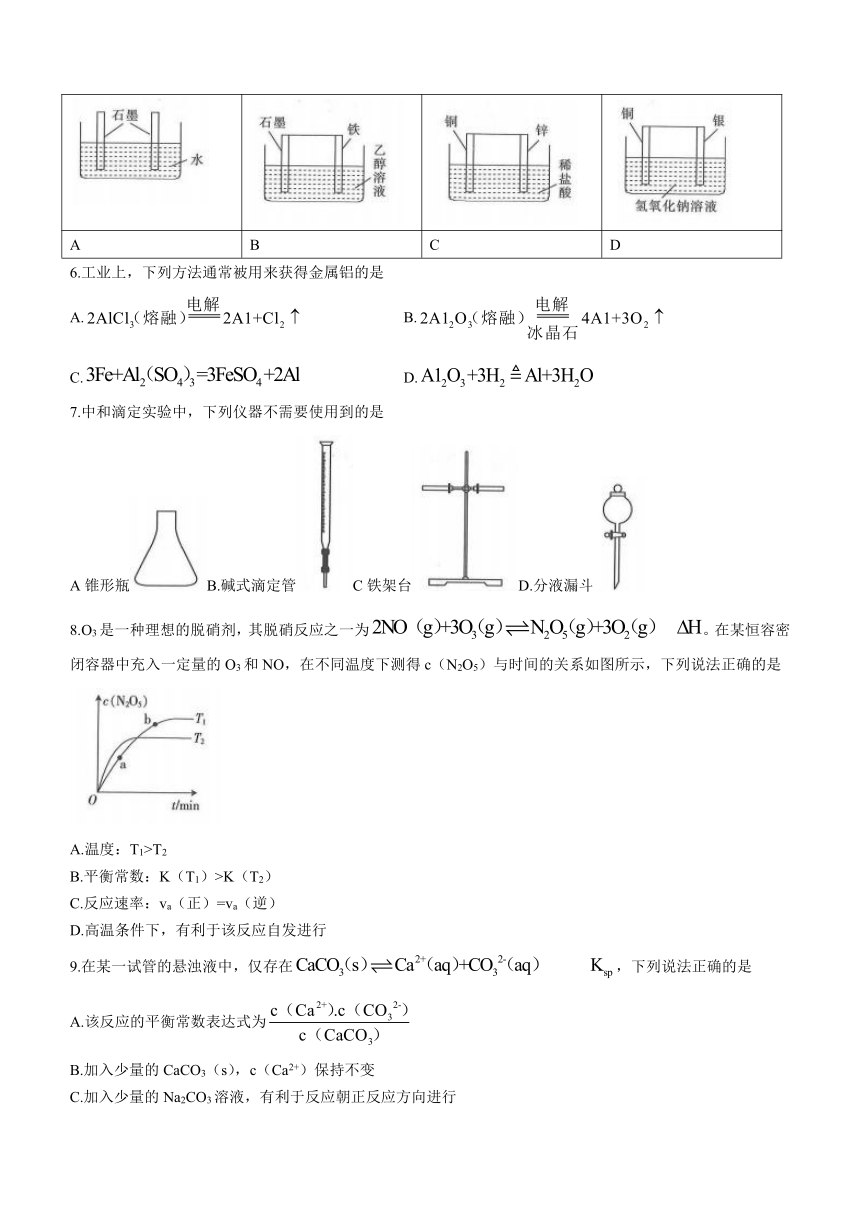
5.如图所示的装置中,能形成原电池的是
A B C D
6.工业上,下列方法通常被用来获得金属铝的是
A. B.
C. D.
7.中和滴定实验中,下列仪器不需要使用到的是
A锥形瓶B.碱式滴定管C铁架台D.分液漏斗
8.O3是一种理想的脱硝剂,其脱硝反应之一为。在某恒容密闭容器中充入一定量的O3和NO,在不同温度下测得c(N2O5)与时间的关系如图所示,下列说法正确的是
A.温度:T1>T2
B.平衡常数:K(T1)>K(T2)
C.反应速率:va(正)=va(逆)
D.高温条件下,有利于该反应自发进行
9.在某一试管的悬浊液中,仅存在,下列说法正确的是
A.该反应的平衡常数表达式为
B.加入少量的CaCO3(s),c(Ca2+)保持不变
C.加入少量的Na2CO3溶液,有利于反应朝正反应方向进行
D.加入少量的CaCl2溶液,反应达到平衡后,Ksp(CaCO3)增大
10.常温下,在0.1mol·L-1的Al2(SO4)3溶液中,下列离子浓度关系正确的是
A. B.
C. D.
11.设NA为阿伏加德罗常数的值,下列说法正确的是
A.pH=2的硫酸溶液中,所含的H+总数为0.01NA
B.1L0.1mol·L-1NH4Cl溶液中,所含的阳离子总数大于0.1NA
C.1L0.1mol·L-1Fe(NO3)2溶液中,所含的Fe2+总数为0.1NA
D.1L0.3mol·L-1NaOH溶液中,所含的OH-总数为0.3NA
12.将浓度为0.1mol·L-1的HCN溶液加水稀释到0.01mol·L-1的过程中,下列各量始终保持增大的是(不考虑溶液温度和体积的变化)
A. B.
C.Ka(HCN) D.
13.草酸锌可应用于有机合成、电子工业等。工业上制取ZnC2O4的原理如图所示(电解液不参加反应,假设起始时两电极的质量相同),下列说法正确的是
A.电池工作时,Zn电极上发生还原反应
B.每消耗5.6LCO2,同时转移的电子数为0.25NA
C.电池工作时,电路中电子的流动方向为Pb→电解液→Zn→电源→Pb
D.每消耗6.5gZn,两电极的质量相差6.5g
14.常温下,用0.100mol·L-1盐酸滴定20.00mL0.100mol·L-1NH3·H2O溶液,溶液的pH与所加盐酸体积的关系如图所示(不考虑溶液的体积和温度变化)。下列说法错误的是
已知:。
A.a点对应的pH约为11.1
B.b点溶液中,
C.a→c的过程中,水的电离程度先减小后增大
D.NH3·H2O溶液属于混合物,不属于电解质
第Ⅱ卷 (非选择题 共58分)
二、非选择题(本题包括4小题,共58分)
15.(15分)研究金属腐蚀和防腐的原理很有现实意义,回答下列问题:
(1)某化学实验兴趣小组同学利用如图所示装置进行实验:
①该实验为______________(填“析氢”或“吸氧”)腐蚀。
②实验进行一段时间后,在右侧小试管中,可观察到的现象为__________________。
③在左侧大试管中,正极上发生反应的电极反应式为_________________。
(2)实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):
①a为电源的________________(填“正极”或“负极”),判断的理由为_________________。
②电镀时,Fe电极上发生反应的电极反应式为_________________。
③电镀过程中,电解质溶液的pH将_________________(填“增大”、“减小”或“不变”)。
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为________________g(假设起始两电极的质量相等)。
16.(13分)“84”消毒液是一种以次氯酸(NaClO)为有效成分的高效消毒剂,它的灭菌消毒能力用有效氯(HClO与ClO-的总量)来衡量,有效氯含量越高,消毒能力越强。间接碘量法是测定有效氯的经典方法,实验步骤如下:
i.取5.00mL“84”消毒液,置于磨口具塞锥形瓶中,加入20mL碘化钾溶液(过量,易被空气氧化)和适量稀硫酸,塞上瓶塞;在暗处振荡5分钟。
ⅱ.加入几滴指示剂,用0.1mol·L-1硫代硫酸钠(Na2S2O3)标准溶液(pH>7)滴定至终点,记下消耗硫代硫酸钠标准溶液的体积,平行测定四次。
已知:①。
②实验所得数据如表所示:
实验次数 1 2 3 4
标准溶液初始读数/mL 0.00 0.10 4.40 0.50
滴定终点时标准溶液读数/mL 31.80 31.95 31.95 32.25
回答下列问题:
(1)使用磨口具塞锥形瓶的原因是_________________;使用硫酸而不使用盐酸酸化的原因是_________________。
(2)滴定时,盛装标准液的滴定管在使用前需要________________,水洗之后需要进行的操作是_________________。在滴定管中装入标准溶液后,要先赶出滴定管尖嘴处的气泡,其操作正确的图示为________________(填标号)。
A. B. C. D.
(3)步骤ⅱ选用的指示剂为_________________,滴定终点的现象为_________________。
(4)该“84”消毒液中ClO-与HClO的总浓度为________________mol·L-1,测得的结果小于该“84”消毒液标签上的浓度,可能原因为_________________(填标号)。
a.滴定终点读数时仰视刻度线
b.该“84”消毒液在光照下放置时间过长
c.滴定振荡时,有少量待测液溅出
d,滴定前,盛装标准溶液的滴定管下端有气泡未赶出
17.(15分)二氧化氯(C1O2)是国内公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被认为是“第四代消毒剂”。电解法是目前最为热门的生产ClO2的方法之一。直接电解氯酸钠(NaClO3)溶液自动催化循环制备高纯ClO2的实验装置示意图如图所示。
已知:①不考虑H+放电;
②亚氯酸盐具有强氧化性。
回答下列问题:
(1)NaClO3中氯元素的化合价为_________________价,NaClO3在水中的电离方程式为_________________。
(2)电解氯酸钠溶液时,H+穿过质子交换膜移向________________(填“N”或“M”)电极。
(3)已知铅酸蓄电池的工作原理为;
①电解氯酸钠溶液时,M电极上发生________________(填“氧化”或“还原”)反应。
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与________________(填“Pb”或“PbO2”)电极相连,N电极上的电极反应式为________________。
③电解氯酸钠溶液时,若以铅酸蓄电池作为电源,每消耗4.14gPb,此时生成气体B的体积为_______________mL(换算为标准状况下)。
(4)用CO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______________(填标号)。
A.明矾 B.氯化钾 C.盐酸 D.硫酸亚铁
18.(15分)一定条件下,HCOOH(g)在某密闭容器中发生的反应有:
回答下列问题:
(1)对于反应,△H3=_______________(用含△H1、△H2的式子表示),K3=_______________(用含K1、K2的式子表示)。
(2)常温下,0.1mol·L-1 HCOOH(甲酸)溶液中【已知:】:
①HCOOH的电离方程式为_______________。
②该溶液中c(H+)≈_______________mol·L-1。
③此温度下,若将0.1mol·L-1 HCOOH溶液加水稀释至0.01mol·L-1,此时Ka(HCOOH)______________(填“变大”、“变小”或“不变”,下同),n(HCOO-)_______________。
(3)某温度下,往某一恒容密闭容器中通入amol·L-1 HCOOH(g),仅发生反应I和反应Ⅱ,t1min后反应达到平衡,此时测得CO、HCOOH的浓度分别为bmol·L-1、cmol·L-1(不考虑碳元素的其他存在形式,a≠b≠c)。则0~t1min内v(CO2)=_______________mol·L-1·min-1(用含a、b、c的式子表示,下同),H2的物质的量分数为_______________,反应Ⅱ的平衡常数为_______________。
高二化学考试参考答案
1.D 2.A 3.C 4.A 5.C 6.B 7.D 8.B 9.B 10.D 11.B 12.D 13.D 14.C
15.(1)①吸氧(2分)
②导气管有一段水柱(或其他合理答案,2分)
③(2分)
(2)①正极(1分);待镀的金属与电源的负极相连(或其他合理答案,2分)
②(2分)
③不变(2分) ④12.8(2分)
16.(1)防止I-被空气氧化干扰实验(2分);盐酸会与C1O-反应生成氯气,干扰实验(1分)
(2)检验是否漏液(1分);用0.1mol·L-1硫代硫酸钠标准溶液润洗(1分);B(1分)
(3)淀粉溶液(1分);加入最后半滴标准溶液时,溶液蓝色消失且30s内不恢复原来的颜色(2分)
(4)0.318(2分);bc(2分)
17.(1)+5(2分);(2分)
(2)M(2分)
(3)①还原(1分)
②Pb(2分);(2分) ③224(2分)
(4)D(2分)
18.(1)△H2-△H1(1分);(2分)
(2)①(2分)
②4×10-3(或4.0×10-3,2分)
③不变(1分);变大(1分)
(3)(2分);(2分);(2分)
考生注意:
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间75分钟。
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:人教版选择性必修1。
4.可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cu64 Zn65 Pb207
第I卷(选择题 共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.化学与生产、生活密切相关。下列过程主要将化学能转化为电能的是
A.电动汽车充电 B.钻木取火 C.蜡烛燃烧 D.强光手电筒照明
2.常温下,下列物质显酸性的是
A.NH4Cl溶液 B.K2SO4溶液
C.Na2CO3溶液 D.Ca(NO3)2溶液
3.下列反应能量的变化与如图所示相符的是
A.碳酸氢钠固体溶于水 B.大理石的分解反应
C.金属镁与稀硫酸的反应 D.稀盐酸与碳酸氢钠溶液的反应
4.下列有关原电池的说法正确的是
A.活泼的金属不一定作负极
B.电池工作时,正极失去电子
C.电池工作时,负极发生还原反应
D.电解质溶液一定不能为浓硝酸
5.如图所示的装置中,能形成原电池的是
A B C D
6.工业上,下列方法通常被用来获得金属铝的是
A. B.
C. D.
7.中和滴定实验中,下列仪器不需要使用到的是
A锥形瓶B.碱式滴定管C铁架台D.分液漏斗
8.O3是一种理想的脱硝剂,其脱硝反应之一为。在某恒容密闭容器中充入一定量的O3和NO,在不同温度下测得c(N2O5)与时间的关系如图所示,下列说法正确的是
A.温度:T1>T2
B.平衡常数:K(T1)>K(T2)
C.反应速率:va(正)=va(逆)
D.高温条件下,有利于该反应自发进行
9.在某一试管的悬浊液中,仅存在,下列说法正确的是
A.该反应的平衡常数表达式为
B.加入少量的CaCO3(s),c(Ca2+)保持不变
C.加入少量的Na2CO3溶液,有利于反应朝正反应方向进行
D.加入少量的CaCl2溶液,反应达到平衡后,Ksp(CaCO3)增大
10.常温下,在0.1mol·L-1的Al2(SO4)3溶液中,下列离子浓度关系正确的是
A. B.
C. D.
11.设NA为阿伏加德罗常数的值,下列说法正确的是
A.pH=2的硫酸溶液中,所含的H+总数为0.01NA
B.1L0.1mol·L-1NH4Cl溶液中,所含的阳离子总数大于0.1NA
C.1L0.1mol·L-1Fe(NO3)2溶液中,所含的Fe2+总数为0.1NA
D.1L0.3mol·L-1NaOH溶液中,所含的OH-总数为0.3NA
12.将浓度为0.1mol·L-1的HCN溶液加水稀释到0.01mol·L-1的过程中,下列各量始终保持增大的是(不考虑溶液温度和体积的变化)
A. B.
C.Ka(HCN) D.
13.草酸锌可应用于有机合成、电子工业等。工业上制取ZnC2O4的原理如图所示(电解液不参加反应,假设起始时两电极的质量相同),下列说法正确的是
A.电池工作时,Zn电极上发生还原反应
B.每消耗5.6LCO2,同时转移的电子数为0.25NA
C.电池工作时,电路中电子的流动方向为Pb→电解液→Zn→电源→Pb
D.每消耗6.5gZn,两电极的质量相差6.5g
14.常温下,用0.100mol·L-1盐酸滴定20.00mL0.100mol·L-1NH3·H2O溶液,溶液的pH与所加盐酸体积的关系如图所示(不考虑溶液的体积和温度变化)。下列说法错误的是
已知:。
A.a点对应的pH约为11.1
B.b点溶液中,
C.a→c的过程中,水的电离程度先减小后增大
D.NH3·H2O溶液属于混合物,不属于电解质
第Ⅱ卷 (非选择题 共58分)
二、非选择题(本题包括4小题,共58分)
15.(15分)研究金属腐蚀和防腐的原理很有现实意义,回答下列问题:
(1)某化学实验兴趣小组同学利用如图所示装置进行实验:
①该实验为______________(填“析氢”或“吸氧”)腐蚀。
②实验进行一段时间后,在右侧小试管中,可观察到的现象为__________________。
③在左侧大试管中,正极上发生反应的电极反应式为_________________。
(2)实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):
①a为电源的________________(填“正极”或“负极”),判断的理由为_________________。
②电镀时,Fe电极上发生反应的电极反应式为_________________。
③电镀过程中,电解质溶液的pH将_________________(填“增大”、“减小”或“不变”)。
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为________________g(假设起始两电极的质量相等)。
16.(13分)“84”消毒液是一种以次氯酸(NaClO)为有效成分的高效消毒剂,它的灭菌消毒能力用有效氯(HClO与ClO-的总量)来衡量,有效氯含量越高,消毒能力越强。间接碘量法是测定有效氯的经典方法,实验步骤如下:
i.取5.00mL“84”消毒液,置于磨口具塞锥形瓶中,加入20mL碘化钾溶液(过量,易被空气氧化)和适量稀硫酸,塞上瓶塞;在暗处振荡5分钟。
ⅱ.加入几滴指示剂,用0.1mol·L-1硫代硫酸钠(Na2S2O3)标准溶液(pH>7)滴定至终点,记下消耗硫代硫酸钠标准溶液的体积,平行测定四次。
已知:①。
②实验所得数据如表所示:
实验次数 1 2 3 4
标准溶液初始读数/mL 0.00 0.10 4.40 0.50
滴定终点时标准溶液读数/mL 31.80 31.95 31.95 32.25
回答下列问题:
(1)使用磨口具塞锥形瓶的原因是_________________;使用硫酸而不使用盐酸酸化的原因是_________________。
(2)滴定时,盛装标准液的滴定管在使用前需要________________,水洗之后需要进行的操作是_________________。在滴定管中装入标准溶液后,要先赶出滴定管尖嘴处的气泡,其操作正确的图示为________________(填标号)。
A. B. C. D.
(3)步骤ⅱ选用的指示剂为_________________,滴定终点的现象为_________________。
(4)该“84”消毒液中ClO-与HClO的总浓度为________________mol·L-1,测得的结果小于该“84”消毒液标签上的浓度,可能原因为_________________(填标号)。
a.滴定终点读数时仰视刻度线
b.该“84”消毒液在光照下放置时间过长
c.滴定振荡时,有少量待测液溅出
d,滴定前,盛装标准溶液的滴定管下端有气泡未赶出
17.(15分)二氧化氯(C1O2)是国内公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被认为是“第四代消毒剂”。电解法是目前最为热门的生产ClO2的方法之一。直接电解氯酸钠(NaClO3)溶液自动催化循环制备高纯ClO2的实验装置示意图如图所示。
已知:①不考虑H+放电;
②亚氯酸盐具有强氧化性。
回答下列问题:
(1)NaClO3中氯元素的化合价为_________________价,NaClO3在水中的电离方程式为_________________。
(2)电解氯酸钠溶液时,H+穿过质子交换膜移向________________(填“N”或“M”)电极。
(3)已知铅酸蓄电池的工作原理为;
①电解氯酸钠溶液时,M电极上发生________________(填“氧化”或“还原”)反应。
②电解氯酸钠溶液时,若以铅酸蓄电池作为电源,则R应与________________(填“Pb”或“PbO2”)电极相连,N电极上的电极反应式为________________。
③电解氯酸钠溶液时,若以铅酸蓄电池作为电源,每消耗4.14gPb,此时生成气体B的体积为_______________mL(换算为标准状况下)。
(4)用CO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______________(填标号)。
A.明矾 B.氯化钾 C.盐酸 D.硫酸亚铁
18.(15分)一定条件下,HCOOH(g)在某密闭容器中发生的反应有:
回答下列问题:
(1)对于反应,△H3=_______________(用含△H1、△H2的式子表示),K3=_______________(用含K1、K2的式子表示)。
(2)常温下,0.1mol·L-1 HCOOH(甲酸)溶液中【已知:】:
①HCOOH的电离方程式为_______________。
②该溶液中c(H+)≈_______________mol·L-1。
③此温度下,若将0.1mol·L-1 HCOOH溶液加水稀释至0.01mol·L-1,此时Ka(HCOOH)______________(填“变大”、“变小”或“不变”,下同),n(HCOO-)_______________。
(3)某温度下,往某一恒容密闭容器中通入amol·L-1 HCOOH(g),仅发生反应I和反应Ⅱ,t1min后反应达到平衡,此时测得CO、HCOOH的浓度分别为bmol·L-1、cmol·L-1(不考虑碳元素的其他存在形式,a≠b≠c)。则0~t1min内v(CO2)=_______________mol·L-1·min-1(用含a、b、c的式子表示,下同),H2的物质的量分数为_______________,反应Ⅱ的平衡常数为_______________。
高二化学考试参考答案
1.D 2.A 3.C 4.A 5.C 6.B 7.D 8.B 9.B 10.D 11.B 12.D 13.D 14.C
15.(1)①吸氧(2分)
②导气管有一段水柱(或其他合理答案,2分)
③(2分)
(2)①正极(1分);待镀的金属与电源的负极相连(或其他合理答案,2分)
②(2分)
③不变(2分) ④12.8(2分)
16.(1)防止I-被空气氧化干扰实验(2分);盐酸会与C1O-反应生成氯气,干扰实验(1分)
(2)检验是否漏液(1分);用0.1mol·L-1硫代硫酸钠标准溶液润洗(1分);B(1分)
(3)淀粉溶液(1分);加入最后半滴标准溶液时,溶液蓝色消失且30s内不恢复原来的颜色(2分)
(4)0.318(2分);bc(2分)
17.(1)+5(2分);(2分)
(2)M(2分)
(3)①还原(1分)
②Pb(2分);(2分) ③224(2分)
(4)D(2分)
18.(1)△H2-△H1(1分);(2分)
(2)①(2分)
②4×10-3(或4.0×10-3,2分)
③不变(1分);变大(1分)
(3)(2分);(2分);(2分)
同课章节目录
