化学人教版(2019)选择性必修1 4.2.1电解池(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2.1电解池(共41张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 09:28:09 | ||
图片预览







文档简介
(共41张PPT)
电 解 池
学习目标
1.能描述电解池的工作原理,会设计简单的电解池。
2.会写电解池的电极反应式和总反应方程式。
3.知道电极上离子的放电顺序,会判断电解产物。
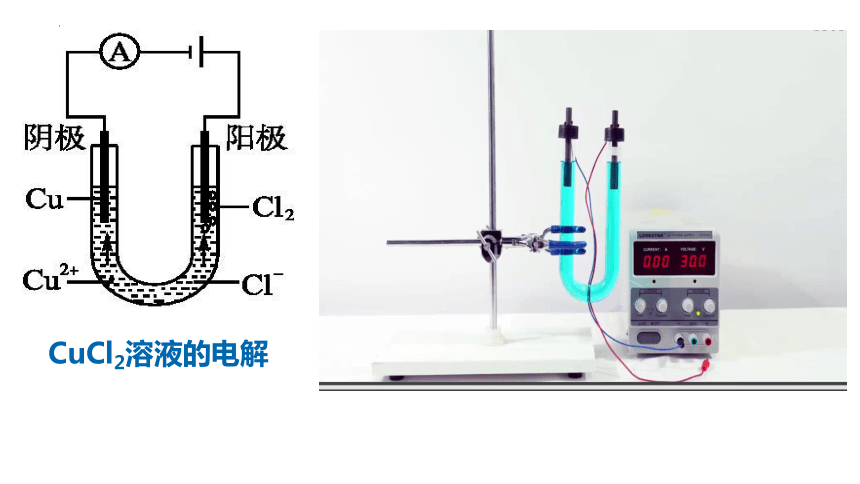
CuCl2溶液的电解
电解池的相关知识
1、概念。
2、构成条件。
5、书写电极式。
3、电子移动方向。
4、阴阳离子移动方向。
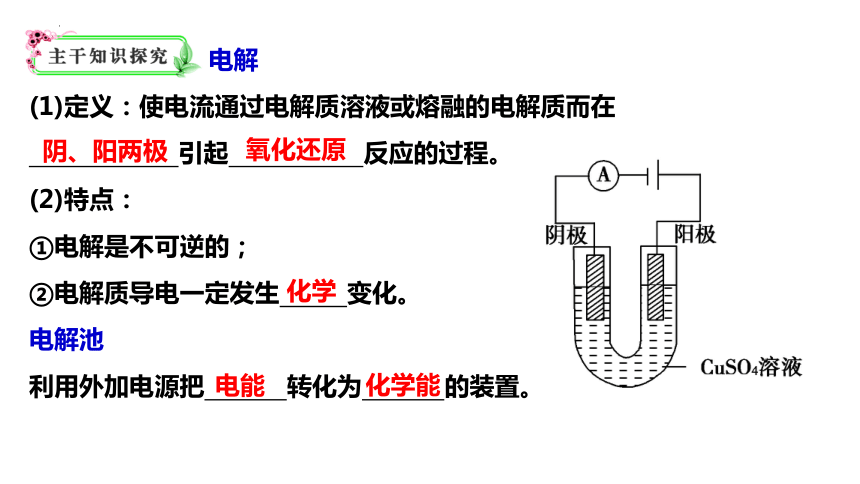
电解
(1)定义:使电流通过电解质溶液或熔融的电解质而在
引起 反应的过程。
(2)特点:
①电解是不可逆的;
②电解质导电一定发生 变化。
电解池
利用外加电源把 转化为 的装置。
阴、阳两极
氧化还原
化学
化学能
电能
电解质溶液导电时,一定会有化学反应发生吗
提示:一定有。因为电解池就是由电能转变成化学能的装置,
溶液导电,电极上一定有电极反应。
思考感悟
能用电解原理说明的问题是( )
①电解是把电能转化成化学能
②电解是把化学能转化成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
D
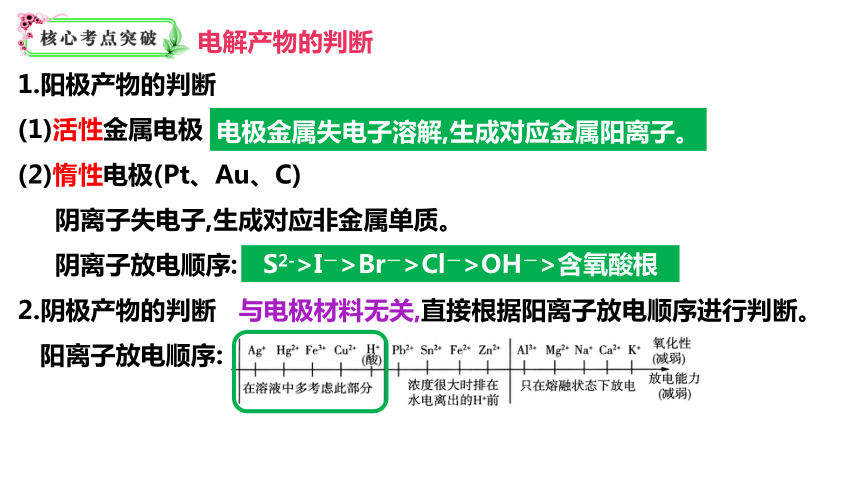
1.阳极产物的判断
(1)活性金属电极
(2)惰性电极(Pt、Au、C)
阴离子失电子,生成对应非金属单质。
阴离子放电顺序:
2.阴极产物的判断 与电极材料无关,直接根据阳离子放电顺序进行判断。
阳离子放电顺序:
电极金属失电子溶解,生成对应金属阳离子。
S2->I->Br->Cl->OH->含氧酸根
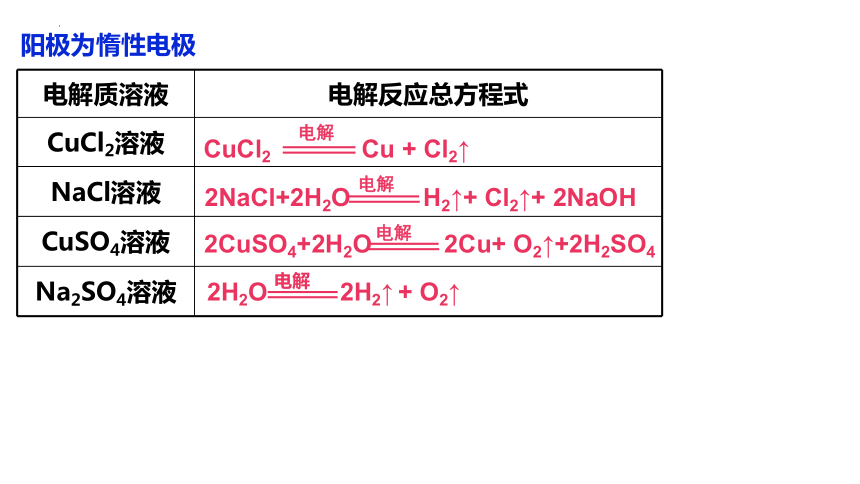
电解产物的判断
电解质溶液 电解反应总方程式
CuCl2溶液
NaCl溶液
CuSO4溶液
Na2SO4溶液
2CuSO4+2H2O 2Cu+ O2↑+2H2SO4
电解
2NaCl+2H2O H2↑+ Cl2↑+ 2NaOH
电解
CuCl2 Cu + Cl2↑
电解
2H2O 2H2↑ + O2↑
电解
阳极为惰性电极
电解质溶液恢复原状的方法:
“析出什么元素加入什么化合物”
类型 电极反应特点 实例 电解对象 电解质浓度 电解质溶液复原
电解 电解质型
放H2生碱型
放O2生酸型
电解水型
电解质电离出的阴、阳
离子分别在两极放电
CuCl2
HCl
电解质
减小
CuCl2
HCl
阴: 2H2O+2e-=H2↑+2OH-
阳:电解质阴离子放电
NaCl
电解质和水
生成新电解质
HCl
阴:电解质阳离子放电
阳:2H2O-4e-=4H++O2↑
CuSO4
AgNO3
电解质和水
生成新电解质
CuO CuCO3
阴:2H2O+2e-=H2↑+2OH-
阳:2H2O-4e-=4H++O2↑
NaOH
H2SO4
Na2SO4
水
增大
水
电解规律
用石墨棒作电极,在Na+、Cu2+、Cl- 、SO42- 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是 ; (2)当阴极析出金属,阳极放出O2时,电解质是 ; (3)当阴极放出H2,阳极放出Cl2时,电解质是 ; (4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质的化学式是 。
(1)Na2SO4 (2)CuSO4 (3)NaCl (4)CuSO4
在水中加等物质的量的Ag+、Pb2+、Na+ 、Cl- 、SO42- 、NO3-,该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为( )A.35.5∶108 B.16∶207C.8∶1 D.108∶35.5
C
1.怎样实现反应Cu+H2SO4══CuSO4+H2↑
提示:用铜作电极,用稀硫酸作电解液,通过电解池实现。
2.含等物质的量的CuSO4和MgCl2的混合溶液,用惰性电极进行电解,
试分析两个电极可能的产物。
提示:混合溶液中,含有的阳离子放电顺序为Cu2+>H+>Mg2+,阴离子放电顺序为Cl->OH-> SO42-,等物质的量的CuSO4和MgCl2相当于等物质的量的CuCl2和MgSO4,电解第一阶段:阴极上Cu2+放电得产物Cu,阳极上Cl-放电得Cl2;第二阶段:相当于电解水,阴极上H+放电得产物H2,阳极上OH-放电得产物O2。
下列说法错误的是( )
A.电解质的导电过程是化学变化,而金属的导电是物理变化
B.电解质溶液导电的过程,就是电解质被电解的过程
C.电解质在任何条件下均可以导电
D.电解质溶液导电过程中一定有新物质生成
C
用石墨作电极电解1 mol·L-1 CuSO4溶液,当c(Cu2+)为0.5 mol·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
B
注意 电解后有关电解质溶液恢复原态的问题应该用质量守恒法分析。
一般是加入阳极产物和阴极产物的化合物,但也有特殊情况,
如用惰性电极电解CuSO4溶液,Cu2+完全放电之前,可加入CuO或CuCO3复原,
而Cu2+完全放电之后,应加入Cu(OH)2或Cu2(OH)2CO3复原。
用Pt电极电解物质的量均为0.1 mol 的Cu2+和X3+的混合溶液,阴极析出固体物质的质量m(g)与导线中通过电子的物质的量n(mol)的关系如图所示,则离子的氧化能力由大到小排列正确的是( )
A.Cu2+>X3+>H+B.H+>X3+>Cu2+C.Cu2+>H+>X3+D.X3+>H+>Cu2+
C
将两个铂电极插入500 mL AgNO3溶液中进行电解,通电一段时间后,某一电极增重0.108 g,若电解时该电极无气体生成,且不考虑离子的水解和溶液体积变化,则此时溶液中氢离子浓度为( )A.4×10-3 mol·L-1B.2×10-3 mol·L-1C.1×10-3 mol·L-1D.1×10-7 mol·L-1
B
如图为用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是( )
A.阳极的电极反应式为2Cl--2e-=Cl2↑B.阴极的电极反应式为TiO2+4e-=Ti+2O2-C.通电后,O2-、Cl-均向阴极移动D.石墨电极的质量不发生变化
B
C
用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
设NA为阿伏加德罗常数的值。用石墨棒作电极电解CuSO4溶液,一段时间后,需加入98 g Cu(OH)2固体才能使电解质溶液复原,则这段时间整个电路中转移的电子为( )A.2 molB.4 molC.8NA个D.NA个
B
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解池串联,用直流电源电解一段时间后,理论上在某一极析出钾、镁、铝的质量之比为( )A.1∶2∶3B.3∶2∶1C.6∶3∶2D.13∶4∶3
D
判断正误,正确的画“√”,错误的画“×”。
(1)电解质溶液的导电过程就是电解质溶液被电解的过程。( )
(2)电解池的阳极发生氧化反应,阴极发生还原反应。( )
(3)电解池中,电子从外接电源负极流向电解池阳极。( )
(4)用石墨电极电解CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色。( )
(5)给稀醋酸通电,在电流的作用下CH3COOH可以发生电离。( )
(6)电解质溶液导电时,一定会有化学反应发生。( )
(7)用石墨电极电解稀硫酸,H+放电,溶液的pH逐渐增大。( )
(8)电解过程,外接电源的电能会100%转化为化学能。( )
√
√
√
×
×
×
×
×
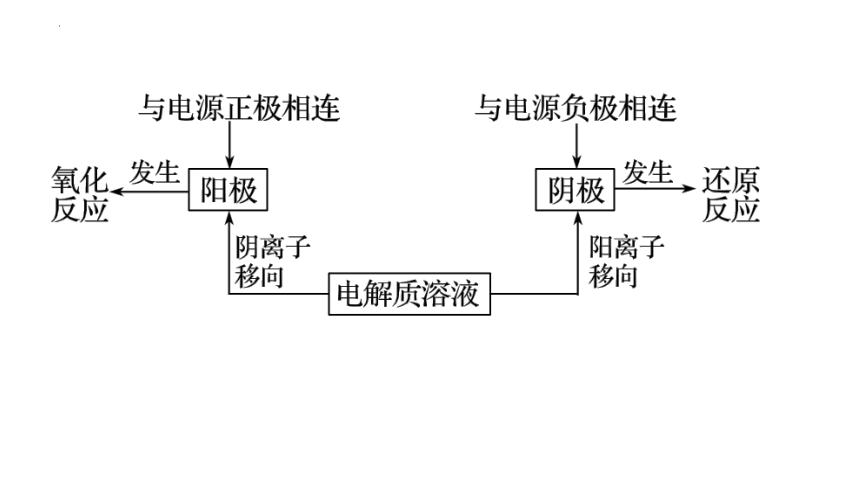
原电池 电解池 一个概念 将化学能转变为电能的装置 将电能转变为化学能的装置 两个电极 负极 较活泼金属—失电子—发生氧化反应 阳极 与电源正极相连—失电子—发生氧化反应
正极 不活泼金属或非金属导体— 得电子—发生还原反应 阴极 与电源负极相连—得电子—发生还原反应
三个流向 电子 负极→外电路→正极 阳极→外电路→阴极 电流 正极→外电路→负极 阴极→外电路→阳极 离子 阳离子→正极,阴离子→负极 阳离子→阴极,阴离子→阳极 四个条件 ①活动性不同的两个电极 ②电解质溶液 ③闭合电路 ④自发进行的氧化还原反应 ①两个电极 ②电解质溶液 ③闭合电路 ④外加直流电源 相同点 氧化还原反应 CuI是一种不溶于水的白色固体,它可由反应:
2Cu2++4I- =2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞溶液和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈蓝色,对这个现象的正确解释是( )①阴极:2H++2e- =H2↑使c(OH-)>c(H+)②阳极:2Cu+4I--4e- =2CuI↓+I2,淀粉遇I2变蓝③阳极:Cu-2e- =Cu2+,Cu2+显蓝色 ④阳极:2I--2e- =I2,淀粉遇I2变蓝A.①② B.①③ C.①④ D.③④
A
陌生电解池装置图的知识迁移
电解池
如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
A
【2019·全国卷Ⅱ,27(4)】环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为 ],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
该电解池的阳极为_______,
总反应为__________________________________________。
电解制备需要在无水条件下进行,原因为
_________________________
________________________________________________。
Fe电极
Fe+2
+H2↑ [或Fe+2C5H6=Fe(C5H5)2+H2↑]
水会阻碍中间物Na的生成;
水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2
【2019·全国卷Ⅲ,28(4)】在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
负极区发生的反应有_________________________________________________
(写反应方程式)。电路中转移1 mol电子,需消耗氧气_____L(标准状况)。
Fe3++e-===Fe2+,4Fe2++O2+4H+===4Fe3++2H2O
5.6
【2019·北京理综,27节选】可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接 或 ,可交替得到 和 。
①. 制 时,连接________。产生 的电极反应式是_________________________。
②改变开关连接方式,可得 。
③. 结合①和②中电极3的电极反应式,说明电极3的作用:_______________________________________________________________。
制H2时,消耗电极1产生的OH-,
制O2时,补充电极2消耗的OH-
K1
一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
A.甲为正极,丙为阴极B.丁极的电极反应式为MnO42--e- =MnO4-
C.KOH溶液的质量分数:c%>a%>b%D.标准状况下,甲电极上每消耗22.4 L气体时,理论上有4 mol K+移入阴极区
C
电解池电极反应式书写集训
1.按要求书写电极反应式
(1)用惰性电极电解NaCl溶液:
阳极: 。
阴极: 。
总: 。
(2)用惰性电极电解CuSO4溶液:
阳极: 。
阴极: 。
总: 。
(3)用惰性电极电解FeCl2溶液:
阳极: 。
阴极: 。
总: 。
(4)用惰性电极电解AlCl3溶液:
阳极: 。
阴极: 。
总: 。
(5)用惰性电极电解熔融MgCl2:
总: 。
阳极: 。
阴极: 。
(6)用惰性电极电解熔融Al2O3:
总: 。
阳极: 。
阴极: 。
(7)铁作阳极,石墨作阴极电解NaOH溶液:
阳极: 。
阴极: 。
总: 。
(8)用铜电极电解H2SO4 溶液:
阳极: 。
阴极: 。
总: 。
提取“信息”书写电极反应式
1.按要求书写电极反应式
(1)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
。
(2)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q,写出阳极生成R的电极反应式:_______________________
。
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、 组成的离子液体作电解液时,可在钢制品上电镀铝。已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,则电极反应式为
阳极: 。阴极: 。
2Al-6e-+3H2O===Al2O3+6H+
Al(OH)3↓+3CO2↑
(4)用惰性电极电解K2MnO4溶液能得到化合物KMnO4,则电极反应式为
阳极: 。
阴极: 。
(5)将一定浓度的磷酸二氢铵(NH4H2PO4)、氯化锂混合液作为电解液,以铁棒作阳极,石墨为阴极,电解析出LiFePO4沉淀,则阳极反应式为______________________
2H++2e-===H2↑
LiFePO4↓+2H+
阳极产物
阴极产物
名师点拨
正确书写电极反应式,做到“三看”.
(1)一看电极材料,若是金属( 、 除外)作阳极,金属一定被电解(注: 生成 而不是生成 )。
(2)二看介质,介质是否参与电极反应。
(3)三看电解质状态,若是熔融状态,通常为金属的电冶炼。
电 解 池
学习目标
1.能描述电解池的工作原理,会设计简单的电解池。
2.会写电解池的电极反应式和总反应方程式。
3.知道电极上离子的放电顺序,会判断电解产物。
CuCl2溶液的电解
电解池的相关知识
1、概念。
2、构成条件。
5、书写电极式。
3、电子移动方向。
4、阴阳离子移动方向。
电解
(1)定义:使电流通过电解质溶液或熔融的电解质而在
引起 反应的过程。
(2)特点:
①电解是不可逆的;
②电解质导电一定发生 变化。
电解池
利用外加电源把 转化为 的装置。
阴、阳两极
氧化还原
化学
化学能
电能
电解质溶液导电时,一定会有化学反应发生吗
提示:一定有。因为电解池就是由电能转变成化学能的装置,
溶液导电,电极上一定有电极反应。
思考感悟
能用电解原理说明的问题是( )
①电解是把电能转化成化学能
②电解是把化学能转化成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
D
1.阳极产物的判断
(1)活性金属电极
(2)惰性电极(Pt、Au、C)
阴离子失电子,生成对应非金属单质。
阴离子放电顺序:
2.阴极产物的判断 与电极材料无关,直接根据阳离子放电顺序进行判断。
阳离子放电顺序:
电极金属失电子溶解,生成对应金属阳离子。
S2->I->Br->Cl->OH->含氧酸根
电解产物的判断
电解质溶液 电解反应总方程式
CuCl2溶液
NaCl溶液
CuSO4溶液
Na2SO4溶液
2CuSO4+2H2O 2Cu+ O2↑+2H2SO4
电解
2NaCl+2H2O H2↑+ Cl2↑+ 2NaOH
电解
CuCl2 Cu + Cl2↑
电解
2H2O 2H2↑ + O2↑
电解
阳极为惰性电极
电解质溶液恢复原状的方法:
“析出什么元素加入什么化合物”
类型 电极反应特点 实例 电解对象 电解质浓度 电解质溶液复原
电解 电解质型
放H2生碱型
放O2生酸型
电解水型
电解质电离出的阴、阳
离子分别在两极放电
CuCl2
HCl
电解质
减小
CuCl2
HCl
阴: 2H2O+2e-=H2↑+2OH-
阳:电解质阴离子放电
NaCl
电解质和水
生成新电解质
HCl
阴:电解质阳离子放电
阳:2H2O-4e-=4H++O2↑
CuSO4
AgNO3
电解质和水
生成新电解质
CuO CuCO3
阴:2H2O+2e-=H2↑+2OH-
阳:2H2O-4e-=4H++O2↑
NaOH
H2SO4
Na2SO4
水
增大
水
电解规律
用石墨棒作电极,在Na+、Cu2+、Cl- 、SO42- 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是 ; (2)当阴极析出金属,阳极放出O2时,电解质是 ; (3)当阴极放出H2,阳极放出Cl2时,电解质是 ; (4)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质的化学式是 。
(1)Na2SO4 (2)CuSO4 (3)NaCl (4)CuSO4
在水中加等物质的量的Ag+、Pb2+、Na+ 、Cl- 、SO42- 、NO3-,该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为( )A.35.5∶108 B.16∶207C.8∶1 D.108∶35.5
C
1.怎样实现反应Cu+H2SO4══CuSO4+H2↑
提示:用铜作电极,用稀硫酸作电解液,通过电解池实现。
2.含等物质的量的CuSO4和MgCl2的混合溶液,用惰性电极进行电解,
试分析两个电极可能的产物。
提示:混合溶液中,含有的阳离子放电顺序为Cu2+>H+>Mg2+,阴离子放电顺序为Cl->OH-> SO42-,等物质的量的CuSO4和MgCl2相当于等物质的量的CuCl2和MgSO4,电解第一阶段:阴极上Cu2+放电得产物Cu,阳极上Cl-放电得Cl2;第二阶段:相当于电解水,阴极上H+放电得产物H2,阳极上OH-放电得产物O2。
下列说法错误的是( )
A.电解质的导电过程是化学变化,而金属的导电是物理变化
B.电解质溶液导电的过程,就是电解质被电解的过程
C.电解质在任何条件下均可以导电
D.电解质溶液导电过程中一定有新物质生成
C
用石墨作电极电解1 mol·L-1 CuSO4溶液,当c(Cu2+)为0.5 mol·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
B
注意 电解后有关电解质溶液恢复原态的问题应该用质量守恒法分析。
一般是加入阳极产物和阴极产物的化合物,但也有特殊情况,
如用惰性电极电解CuSO4溶液,Cu2+完全放电之前,可加入CuO或CuCO3复原,
而Cu2+完全放电之后,应加入Cu(OH)2或Cu2(OH)2CO3复原。
用Pt电极电解物质的量均为0.1 mol 的Cu2+和X3+的混合溶液,阴极析出固体物质的质量m(g)与导线中通过电子的物质的量n(mol)的关系如图所示,则离子的氧化能力由大到小排列正确的是( )
A.Cu2+>X3+>H+B.H+>X3+>Cu2+C.Cu2+>H+>X3+D.X3+>H+>Cu2+
C
将两个铂电极插入500 mL AgNO3溶液中进行电解,通电一段时间后,某一电极增重0.108 g,若电解时该电极无气体生成,且不考虑离子的水解和溶液体积变化,则此时溶液中氢离子浓度为( )A.4×10-3 mol·L-1B.2×10-3 mol·L-1C.1×10-3 mol·L-1D.1×10-7 mol·L-1
B
如图为用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是( )
A.阳极的电极反应式为2Cl--2e-=Cl2↑B.阴极的电极反应式为TiO2+4e-=Ti+2O2-C.通电后,O2-、Cl-均向阴极移动D.石墨电极的质量不发生变化
B
C
用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
设NA为阿伏加德罗常数的值。用石墨棒作电极电解CuSO4溶液,一段时间后,需加入98 g Cu(OH)2固体才能使电解质溶液复原,则这段时间整个电路中转移的电子为( )A.2 molB.4 molC.8NA个D.NA个
B
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解池串联,用直流电源电解一段时间后,理论上在某一极析出钾、镁、铝的质量之比为( )A.1∶2∶3B.3∶2∶1C.6∶3∶2D.13∶4∶3
D
判断正误,正确的画“√”,错误的画“×”。
(1)电解质溶液的导电过程就是电解质溶液被电解的过程。( )
(2)电解池的阳极发生氧化反应,阴极发生还原反应。( )
(3)电解池中,电子从外接电源负极流向电解池阳极。( )
(4)用石墨电极电解CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色。( )
(5)给稀醋酸通电,在电流的作用下CH3COOH可以发生电离。( )
(6)电解质溶液导电时,一定会有化学反应发生。( )
(7)用石墨电极电解稀硫酸,H+放电,溶液的pH逐渐增大。( )
(8)电解过程,外接电源的电能会100%转化为化学能。( )
√
√
√
×
×
×
×
×
原电池 电解池 一个概念 将化学能转变为电能的装置 将电能转变为化学能的装置 两个电极 负极 较活泼金属—失电子—发生氧化反应 阳极 与电源正极相连—失电子—发生氧化反应
正极 不活泼金属或非金属导体— 得电子—发生还原反应 阴极 与电源负极相连—得电子—发生还原反应
三个流向 电子 负极→外电路→正极 阳极→外电路→阴极 电流 正极→外电路→负极 阴极→外电路→阳极 离子 阳离子→正极,阴离子→负极 阳离子→阴极,阴离子→阳极 四个条件 ①活动性不同的两个电极 ②电解质溶液 ③闭合电路 ④自发进行的氧化还原反应 ①两个电极 ②电解质溶液 ③闭合电路 ④外加直流电源 相同点 氧化还原反应 CuI是一种不溶于水的白色固体,它可由反应:
2Cu2++4I- =2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞溶液和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈蓝色,对这个现象的正确解释是( )①阴极:2H++2e- =H2↑使c(OH-)>c(H+)②阳极:2Cu+4I--4e- =2CuI↓+I2,淀粉遇I2变蓝③阳极:Cu-2e- =Cu2+,Cu2+显蓝色 ④阳极:2I--2e- =I2,淀粉遇I2变蓝A.①② B.①③ C.①④ D.③④
A
陌生电解池装置图的知识迁移
电解池
如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
A
【2019·全国卷Ⅱ,27(4)】环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为 ],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
该电解池的阳极为_______,
总反应为__________________________________________。
电解制备需要在无水条件下进行,原因为
_________________________
________________________________________________。
Fe电极
Fe+2
+H2↑ [或Fe+2C5H6=Fe(C5H5)2+H2↑]
水会阻碍中间物Na的生成;
水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2
【2019·全国卷Ⅲ,28(4)】在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
负极区发生的反应有_________________________________________________
(写反应方程式)。电路中转移1 mol电子,需消耗氧气_____L(标准状况)。
Fe3++e-===Fe2+,4Fe2++O2+4H+===4Fe3++2H2O
5.6
【2019·北京理综,27节选】可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接 或 ,可交替得到 和 。
①. 制 时,连接________。产生 的电极反应式是_________________________。
②改变开关连接方式,可得 。
③. 结合①和②中电极3的电极反应式,说明电极3的作用:_______________________________________________________________。
制H2时,消耗电极1产生的OH-,
制O2时,补充电极2消耗的OH-
K1
一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是( )
A.甲为正极,丙为阴极B.丁极的电极反应式为MnO42--e- =MnO4-
C.KOH溶液的质量分数:c%>a%>b%D.标准状况下,甲电极上每消耗22.4 L气体时,理论上有4 mol K+移入阴极区
C
电解池电极反应式书写集训
1.按要求书写电极反应式
(1)用惰性电极电解NaCl溶液:
阳极: 。
阴极: 。
总: 。
(2)用惰性电极电解CuSO4溶液:
阳极: 。
阴极: 。
总: 。
(3)用惰性电极电解FeCl2溶液:
阳极: 。
阴极: 。
总: 。
(4)用惰性电极电解AlCl3溶液:
阳极: 。
阴极: 。
总: 。
(5)用惰性电极电解熔融MgCl2:
总: 。
阳极: 。
阴极: 。
(6)用惰性电极电解熔融Al2O3:
总: 。
阳极: 。
阴极: 。
(7)铁作阳极,石墨作阴极电解NaOH溶液:
阳极: 。
阴极: 。
总: 。
(8)用铜电极电解H2SO4 溶液:
阳极: 。
阴极: 。
总: 。
提取“信息”书写电极反应式
1.按要求书写电极反应式
(1)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
。
(2)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q,写出阳极生成R的电极反应式:_______________________
。
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、 组成的离子液体作电解液时,可在钢制品上电镀铝。已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,则电极反应式为
阳极: 。阴极: 。
2Al-6e-+3H2O===Al2O3+6H+
Al(OH)3↓+3CO2↑
(4)用惰性电极电解K2MnO4溶液能得到化合物KMnO4,则电极反应式为
阳极: 。
阴极: 。
(5)将一定浓度的磷酸二氢铵(NH4H2PO4)、氯化锂混合液作为电解液,以铁棒作阳极,石墨为阴极,电解析出LiFePO4沉淀,则阳极反应式为______________________
2H++2e-===H2↑
LiFePO4↓+2H+
阳极产物
阴极产物
名师点拨
正确书写电极反应式,做到“三看”.
(1)一看电极材料,若是金属( 、 除外)作阳极,金属一定被电解(注: 生成 而不是生成 )。
(2)二看介质,介质是否参与电极反应。
(3)三看电解质状态,若是熔融状态,通常为金属的电冶炼。
