第二章第二节分子空间结构(含解析)专项训练2023-2024学年高二化学人教版(2019)选择性必修二
文档属性
| 名称 | 第二章第二节分子空间结构(含解析)专项训练2023-2024学年高二化学人教版(2019)选择性必修二 |

|
|
| 格式 | docx | ||
| 文件大小 | 500.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 10:44:39 | ||
图片预览




文档简介
分子空间结构基础达标训练
时间:75分钟 满分:100分
一、单选题(15题,45分)
1.下列物质中碳原子是以sp3杂化轨道与其他原子成键的是
A.乙烯 B.苯 C.乙炔 D.乙烷
2.下列分子中,杂化类型相同,空间结构也相同的是
A.H2O、SO2 B.BeCl2、CO2
C.H2O、NH3 D.NH3、HCHO
3.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是
A.三角锥形、sp3 B.平面三角形、sp3
C.平面三角形、sp2 D.三角锥形、sp2
4.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。下列说法正确的是
A.H2O2分子中的O为sp2杂化
B.CO2分子中C原子为sp杂化
C.BF3分子中的B原子sp3杂化
D.CH3COOH分子中C原子均为sp3杂化
5.甲醛分子的结构式如图所示,用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是( )
A.甲醛分子中有4个σ键
B.碳酰氯分子中的C原子为sp3杂化
C.甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D.碳酰氯分子为平面三角形,分子中存在一个π键
6.氯元素有多种化合价,可形成等微粒。下列说法错误的是
A.中Cl原子的杂化方式均为杂化
B.基态原子核外电子的空间运动状态有9种
C.键角:
D.的空间构型为V形,分子中的化学键的键长和键角可以通过X射线衍射实验获得
7.六氟化硫分子呈正八面体结构(如图所示),在高电压下仍有良好的绝缘性,性质稳定,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是
A.各原子均为8电子稳定结构 B.S原子轨道杂化方式与中的S一样
C.六氟化硫分子中只含极性键 D.键是键,键长可能不相等
8.下列说法正确的是
A.SO2的VSEPR模型与分子的空间结构相同
B.H2S、NF3、CH4这一组粒子的中心原子杂化类型相同,分子或离子的键角不相等
C.的电子式为,离子呈平面正方形结构,SF6分子是正八面体形
D.SO中心S原子的孤电子对数为0,故其结构为平面三角形
9.下列各组分子的中心原子杂化轨道类型相同,分子的空间结构不相同的是
A.、、 B.、、
C.、、环己烷 D.、、
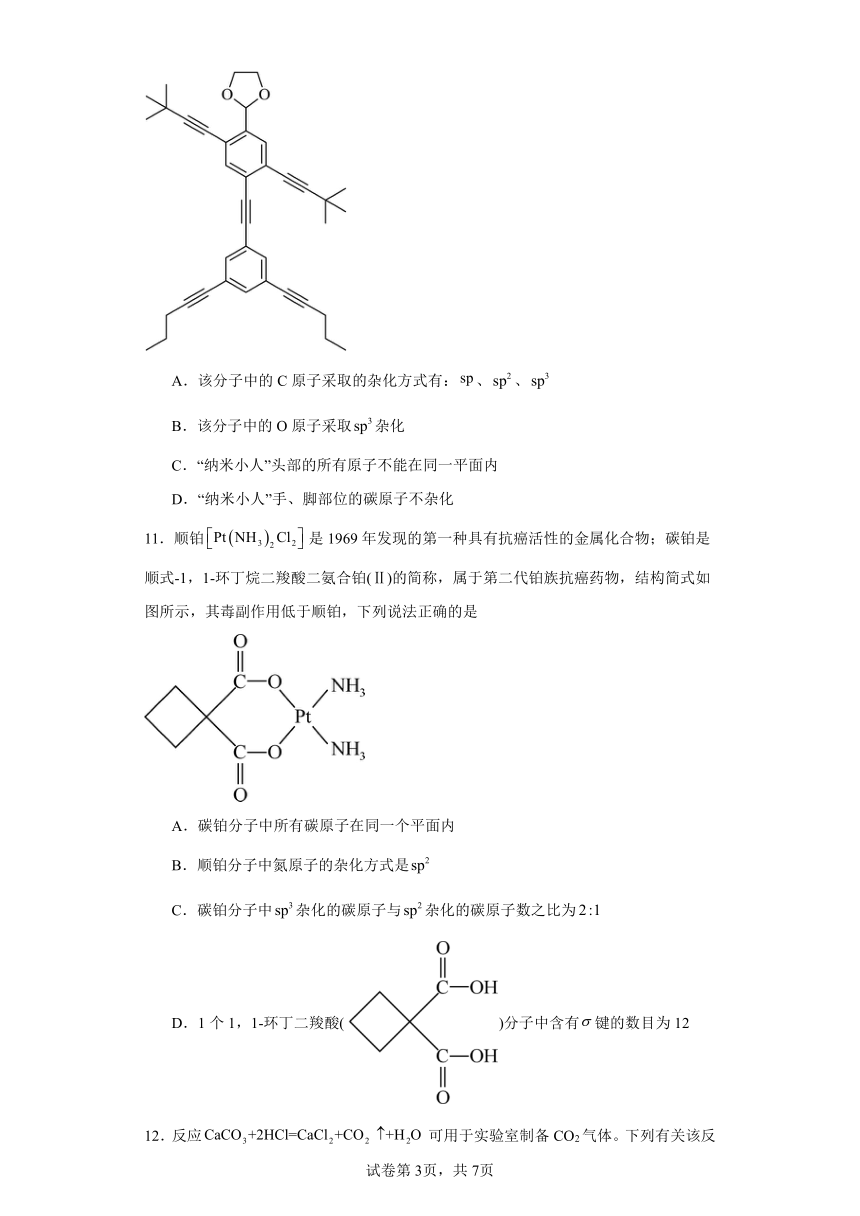
10.多位化学家用简单的偶联反应合成了如下这个有趣的“纳米小人”分子。有关该分子的结构说法不正确的是
A.该分子中的C原子采取的杂化方式有:、、
B.该分子中的O原子采取杂化
C.“纳米小人”头部的所有原子不能在同一平面内
D.“纳米小人”手、脚部位的碳原子不杂化
11.顺铂是1969年发现的第一种具有抗癌活性的金属化合物;碳铂是顺式-1,1-环丁烷二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂,下列说法正确的是
A.碳铂分子中所有碳原子在同一个平面内
B.顺铂分子中氮原子的杂化方式是
C.碳铂分子中杂化的碳原子与杂化的碳原子数之比为
D.1个1,1-环丁二羧酸()分子中含有键的数目为12
12.反应可用于实验室制备CO2气体。下列有关该反应中各物质的说法正确的是
A.和均为三原子分子,二者空间结构相同
B.中阴离子的模型为四面体
C.键角由大到小的顺序为
D.根据模型可知,CaCl2的空间结构为直线形
13.下列说法中正确的是
A.、、、分子中原子的最外层都不满足8电子稳定结构
B.和都是正四面体形分子且键角都为
C.的电子式为,离子呈平面正方形结构
D.分子中中心原子上有一个未成键的孤电子对,它对成键电子对的排斥作用较强
14.用模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A.分子中三个共价键的键能、键长、键角都相等
B.、、键角由大到小的顺序为
C.分子的键角是
D.、都是三角锥形的分子
15.化合物A是近年来采用的锅炉水添加剂,其结构式如图所示,A能除去锅炉水中溶解的氧气。下列说法正确的是
A.A分子中所有原子都在同一平面内
B.A分子中所含的σ键与π键个数之比为10:1
C.A分子中C、N均为sp2杂化
D.A与足量O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
二、结构与性质(4大题,55分)
16.N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N (填“”或“”,下同)O,电负性:S Cl。
(2)前四周期元素中,未成对电子数为5的元素符号是 ;
(3)SO3的空间构型是 ,分子中的大键可用符号表示,其中m代表参与形成的大键原子数,n代表参与形成大键的电子数如苯分子中的大键可表示为,则SO3中的大键应表示为 。
(4)亚硒酸根离子()的VSEPR模型为 ;
(5)与互为等电子体的微粒有 任写两种
17.回答下列问题:
(1)是有机合成中常用的还原剂,中的阴离子空间构型是 、中心原子的杂化形式为 。
(2)①根据价层电子对互斥理论,的气态分子中,中心原子价层电子对数不同于其他分子的是 。
②气态三氧化硫以单分子形式存在,其分子的立体构型为 形,其中共价键的类型有 种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为 。
(3)《中华本草》等中医典籍中,记载了炉甘石入药,可用于治疗皮肤炎症或表面创伤。中,阴离子空间构型为 ,C原子的杂化形式为 。
18.(1)臭氧(O3)在催化下能将烟气中的、分别氧化为和,也可在其他条件下被还原为。中心原子轨道的杂化类型为 ;的空间结构为 (用文字描述)。
(2)钒()是我国的丰产元素,广泛用于催化及钢铁工业。
①常用作转化为的催化剂。分子中S原子价电子对数是 ,分子的空间结构为 ;气态为单分子,该分子中S原子的杂化轨道类型为 ;的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为 ;该结构中键长有两类,一类键长约为,另一类键长约为,较短的键为 (填图中字母),该分子中含有 个σ键。
②溶解在溶液中,可得到钒酸钠(),该盐阴离子的空间结构为 。
19.磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(2)分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 。
(3)乙二胺()是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。
(4)元素与N同族。预测的氢化物分子的立体结构为 ,其沸点比的 (填“高”或“低”),其判断理由是 。
(5)中,电负性最高的元素是 ;P的 杂化轨道与O的轨道形成 键。
(6)的空间构型为 (用文字描述);抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为 ;推测抗坏血酸在水中的溶解性: (填“难溶于水”或“易溶于水”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.乙烯是平面形结构,碳原子是sp2杂化,A不符合;
B.苯是平面形结构,碳原子是sp2杂化,B不符合;
C.乙炔是直线形结构,碳原子是sp杂化,C不符合;
D.乙烷属于链状烷烃,碳原子是sp3杂化轨道,D符合;
答案选D。
2.B
【详解】A.水中O原子价层电子对数为4,采取sp3杂化方式,含有的孤对电子对数=(6-2×1)÷2=2,水是V型结构;SO2中S原子价层电子对数为3,采取 sp2杂化方式,含有的孤对电子对数=(6-2×2)÷2=1,SO2是V形结构,A不符合题意;
B.Be原子是sp杂化,是直线型结构,CO2是直线型结构,碳原子是sp杂化,B符合题意;
C.氨气中氮原子是sp3杂化,含有1对孤对电子,因此氨气是三角锥形结构,C不符合题意;
D.甲醛中碳原子是sp2杂化,属于平面型结构,D不符合题意;
故选:B。
3.A
【详解】根据价层电子对互斥模型确定微粒的空间结构,SOCl2中原子形成2个S-Cl键,1个S=O键,价层电子对数=σ键个数+孤电子对数为:,杂化轨道数是4,故原子采取sp3杂化,由于中心S原子上有一个孤电子对,分子空间结构为三角锥形,故合理选项是A。
4.B
【详解】A.H2O2分子中氧原子形成2个σ键,含有2对孤电子对,采取sp3杂化,A错误;
B.CO2分子中C原子形成2个σ键,没有孤电子对,采取sp杂化,B正确;
C.BF3分子中的B原子的最外层电子数3形成3个σ键,没有孤电子对,采取sp2杂化,C错误;
D.CH3COOH分子中有2个碳原子,其中甲基上的碳原子形成4个σ键,没有孤对电子,采取sp3杂化,D错误;
故选B。
5.D
【详解】A.甲醛分子中有3个σ键,A不正确;
B.碳酰氯分子中的C原子为sp2杂化,B不正确;
C.根据价层电子对互斥理论可知,碳酰氯分子中的氯原子有3对孤对电子,孤电子对对成键电子对有更强的排斥作用,所以,甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl不相等,C不正确;
D.碳酰氯分子为平面三角形,碳与氧形成的双键中有一个π键,D正确。
本题选D。
6.C
【详解】A.的结构式为:,的结构式为:,的结构式为,VSEPR模型均为四面体,中心原子价层电子对数均为4,因此Cl的杂化方式都是sp3,A正确;
B.量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cl原子的核外电子排布式为:1s22s22p63s23p5,s能级各有一个轨道,p能级各有3个轨道,共9个轨道。因此基态Cl原子的核外电子的空间运动状态有9种,B正确;
C.三种离子的Cl原子均为sp3杂化,中心原子孤电子对越多,对成键电子排斥越强,键角越小,有2对孤电子对,空间结构呈V形,键角为105,有1对孤电子对,空间结构呈三角锥形,键角为107,没有孤电子对,空间结构呈四面体形,键角为10928,键角关系为:,C错误;
D.中心原子为O原子,杂化方式为sp3,结构式为 ,因此空间构型为V形,分子中的化学键的键长和键角可以通过X射线衍射实验获得,D正确;
故选C。
7.C
【详解】A.根据题图知,每个F原子和1个S原子形成1个共用电子对,每个S原子和6个F原子形成6个共用电子对,所以F原子都达到8电子稳定结构,但S原子最外层不满足8电子稳定结构,A错误;
B. SO3中S原子孤电子对数=、价层电子对数=3+0=3,故为sp2杂化、空间构型为平面正三角形;SF6中S原子孤电子对数=、价层电子对数=6+0=6,空间构型为正八面体形、不可能为sp2杂化,B错误;
C.同种原子间形成非极性键,不同种原子间形成极性键,六氟化硫分子中的键均为极性键,不含非极性键,C正确;
D.六氟化硫分子中的键都是键,六氟化硫分子为正八面体形结构,所以各键的键长与键能都相等,D错误;
故选C。
8.B
【详解】A.SO2中S原子的价层电子对数=2+=3,含一对孤电子对,VSEPR模型为平面三角形,空间结构为V形,故A错误;
B.H2S中S原子杂化轨道数=σ键数+孤对电子对数=2+=4,所以采取sp3杂化,分子构型为V型,NF3中氮原子杂化轨道数=σ键数+孤对电子对数=3+=4,所以采取sp3杂化,分子构型为四面体型,CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,分子构型为正四面体型,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同,故B正确;
C.铵根离子与甲烷分子结构相似,都是正四面体结构,故C错误;
D.中S原子孤电子对数==1,价层电子对数=1+3=4,空间构型为三角锥形;故D错误;
故选:B。
9.B
【详解】A.中心原子都是杂化,其空间结构相同,A不符合题意;
B.中心原子都是杂化,孤电子对数不同,分子的空间结构不相同,B符合题意;
C.三氯化硼和氯乙烯的中心原子都是杂化,环己烷中碳原子为杂化,C不符合题意;
D.三氧化硫和苯分子的中心原子为杂化,而丙炔中碳原子存在和杂化,D不符合题意;
故选B。
10.D
【详解】A.该分子中碳碳三键上的C原子采取杂化,苯环上的C原子采取杂化,其他碳原子采取杂化,A正确;
B.该分子中的O原子有2对σ键电子对,有2对孤电子对,故其采取杂化,B正确;
C.“纳米小人”头部的C原子均为杂化,C原子与周围的H原子形成四面体,不在同一平面上,C正确;
D.“纳米小人”手、脚部位的碳原子都属于饱和碳原子,均采取杂化,D错误;
故选D。
11.C
【详解】A.碳铂中含饱和碳原子,6个碳原子不可能共平面,A错误;
B.顺铂分子中氮原子有3对σ键电子对,有1对孤电子对,其杂化方式是,B错误;
C.碳铂分子中酯基碳原子为杂化,而其他4个碳原子为杂化,C正确;
D.1,1-环丁二羧酸的结构中有4个饱和碳原子,和2个不饱和碳原子,则1个1,1-环丁二羧酸分子中含有18个键,D错误;
故选C。
12.C
【详解】A.二氧化碳分子中碳原子的价层电子对数为2,孤对电子对数为0,分子的空间构型为直线形,水分子中氧原子的价层电子对数为4,孤对电子对数为2,分子的空间构型为V形,二者空间结构不同,故A错误;
B.碳酸根离子中碳原子的的价层电子对数为3,分子的VSEPR模型为平面三角形,故B错误;
C.二氧化碳分子中碳原子的价层电子对数为2,孤对电子对数为0,分子的空间构型为直线形,键角为180°,碳酸根离子中碳原子的的价层电子对数为3,分子的VSEPR模型为平面三角形,键角为120°,水分子中氧原子的价层电子对数为4,孤对电子对数为2,分子的空间构型为V形,键角约为105°,则二氧化碳、碳酸根离子、水的键角依次减小,故C正确;
D.氯化钙为离子化合物,不能用VSEPR模型预测氯化钙的空间结构,故D错误;
故选C。
13.D
【详解】A.N原子最外层有5个电子,与3个Cl原子形成3对共用电子对,所以分子中N原子最外层满足8电子稳定结构,Cl原子最外层也满足8电子稳定结构,故A错误;
B.白磷分子和甲烷分子都是正四面体形,但白磷分子的键角是,故B错误;
C.的电子式为,但铵根离子的空间结构为正四面体形,故C错误;
D.氨气分子中N原子与3个H原子形成3个共价单键,还有一个孤电子对,它对成键电子对的排斥作用较强,所以键角小于,故D正确;
选D。
14.A
【详解】A.是三角锥形的分子,其结构类似于氨气,分子中三个共价键的键能、键长、键角都相等,A正确;
B.、、中中心原子都是杂化,都有1个孤电子对,分子的中心原子的电负性最大,成键电子对距离中心原子最近,键角最大,键角由大到小的顺序为,B错误;
C.是直线形分子,键角是,C错误;
D.是三角锥形的分子,分子中中心原子的价层电子对数,没有孤电子对,是三角双锥形结构,D错误;
故选A。
15.D
【详解】A.由于氨气分子空间结构为三角锥形,即氮原子与所连的三个原子不在同一平面,所以A分子中所有原子不可能共平面,A错误;
B.共价单键都是σ,共价双键中一个是σ键,一个是π键。根据A结构式可知:在1个A分子中含有11个σ键和1个π键,σ键与π键个数之比为11:1,B错误;
C.A分子中N原子价层电子对数为3+=4,所以N原子杂化类型为sp3杂化,C错误;
D.根据质量守恒定律可知:1 mol A与足量O2反应生成CO2、N2、H2O的物质的量分别为1 mol、2 mol、3 mol,则A与足量O2反应生成CO2、N2、H2O的物质的量之比为1:2:3,D正确;
故合理选项是D。
16.(1)
(2)Mn
(3) 平面正三角形
(4)四面体形
(5)BF3、SO3(合理即可)
【详解】(1)N、O位于同一周期相邻位置,N原子的2p能级电子数达到了半满结构,比较稳定,则第一电离能N>O,元素的电负性与非金属性有关,非金属性越强,电负性越大,则电负性S(2)前四周期元素中,未成对电子数为5的元素的外围电子构型为3d54s2,元素符号为Mn。
(3)SO3的中心原子为S原子,形成3个键,孤电子对为=0,则空间构型为平面正三角形,三氧化硫中,有一个硫氧双键,还有两个配位键,四个原子均达到了8电子的稳定结构,硫的两对孤对电子分别配位给两个氧原子。三氧化硫中有两个配位键,配位氧的四个电子与硫氧双键的π键的两个电子形成一个四中心六电子的大π键,应表示为。
(4)亚硒酸根离子SeO的中心原子为Se,形成3个键,孤电子对为=1,则VSEPR模型为四面体形。
(5)为四个原子的离子,价电子总数为24,互为等电子体的是BF3、SO3(合理即可)。
17.(1) 正四面体形
(2) 平面三角形 2
(3) 平面三角形
【详解】(1)四氢合铝酸锂中四氢合铝酸根离子中铝原子的价层电子对数为4,孤对电子对数为0,所以离子中铝原子的杂化方式为sp3杂化,离子的空间构型为正四面体形,故答案为:sp3;正四面体形;
(2)①硫化氢分子中硫原子的价层电子对数为4,三氧化硫和二氧化硫中硫原子的价层电子对数都为3,则中心原子价层电子对数不同于其他分子的是硫化氢,故答案为:H2S;
②三氧化硫分子中硫原子的价层电子对数为3,孤对电子对数为0,所以分子的立体构型为平面三角形,分子中硫氧单键为σ键,硫氧双键中含有1个σ键和1个π键,所以分子中共价键的类型有2种;由图可知,三聚三氧化硫分子中每个硫原子与4个氧原子形成4个σ键,硫原子的的杂化方式为sp3杂化,故答案为:平面三角形;2;sp3;
(3)碳酸锌中碳酸根离子的价层电子对数为3,孤对电子对数为0,所以离子中碳原子的的杂化方式为sp2杂化,离子的空间构型为平面三角形,故答案为:平面三角形;sp2。
18. sp3 平面三角形 3 V形 sp2 sp3 a 12 正四面体形
【详解】(1)中S原子的价电子对数为,所以S原子采取sp3杂化。中氮原子上的价层电子对数为,即N采取sp2杂化,的空间结构为平面三角形;
(2)①分子中S的价电子对数为,分子的空间结构为V形;
分子中S的价电子对数为,硫原子采用sp2杂化;
由图可知的三聚体环状结构中每个S原子连有4个O原子,形成4个σ键,S原子采用sp3杂化。a处为硫氧双键,b处为硫氧单键,故a处键长较短。1个双键中包括1个σ键和1个π键,单键均为σ键,故该分子中含有12个σ键;
②中阴离子为,V的价电子对数为,则V采用sp3杂化,的空间结构为正四面体形。
19. 正四面体 4 三角锥形 低 分子间存在氢键 O 正四面体形 易溶于水
【详解】(1)中中心P原子的价层电子对数为,不含孤电子对,因此其空间构型为正四面体,P原子采取杂化方式,形成4个杂化轨道,故答案为:正四面体;4;;
(2)中中心N原子的孤电子对数为,价层电子对数为,杂化类型为杂化,同周期元素从左到右第一电离能呈增大趋势,但基态N原子的轨道为半充满稳定结构,N元素的第一电离能大于同周期相邻元素的第一电离能,故第一电离能:,故答案为:;;
(3)乙二胺中N原子形成3个键,有1个孤电子对,杂化轨道数为4,采取杂化,C原子形成4个键,杂化轨道数为4,采取杂化,故答案为:;;
(4)元素与N位于同主族,的氢化物()分子的立体结构与N的氢化物()分子的立体结构相同,均为三角锥形;的沸点比的沸点低,是因为分子间存在氢键,故答案为:三角锥形;低;分子间存在氢键;
(5)同周期主族元素从左到右,电负性逐渐增大,则电负性:;同主族元素从上到下,电负性逐渐减小,则电负性:;中H元素显正价,P元素显负价,则电负性:,由此可得电负性:,故中,电负性最高的是氧(O),P与O原子形成4个键,且无孤电子对,则P采用杂化,P的杂化轨道与O的轨道形成键,故答案为:O;;;
(6)的中心S原子最外层有6个电子,按照模型,价层电子对数为4,故中的S原子为杂化,空间构型为正四面体形,形成双键的碳原子为杂化,四个键均为单键的碳原子为杂化;抗坏血酸分子中有四个羟基,羟基为亲水性基团,则抗坏血酸易溶于水,故答案为:正四面体形;;易溶于水。
答案第1页,共2页
答案第1页,共2页
时间:75分钟 满分:100分
一、单选题(15题,45分)
1.下列物质中碳原子是以sp3杂化轨道与其他原子成键的是
A.乙烯 B.苯 C.乙炔 D.乙烷
2.下列分子中,杂化类型相同,空间结构也相同的是
A.H2O、SO2 B.BeCl2、CO2
C.H2O、NH3 D.NH3、HCHO
3.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式的说法正确的是
A.三角锥形、sp3 B.平面三角形、sp3
C.平面三角形、sp2 D.三角锥形、sp2
4.徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。下列说法正确的是
A.H2O2分子中的O为sp2杂化
B.CO2分子中C原子为sp杂化
C.BF3分子中的B原子sp3杂化
D.CH3COOH分子中C原子均为sp3杂化
5.甲醛分子的结构式如图所示,用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是( )
A.甲醛分子中有4个σ键
B.碳酰氯分子中的C原子为sp3杂化
C.甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D.碳酰氯分子为平面三角形,分子中存在一个π键
6.氯元素有多种化合价,可形成等微粒。下列说法错误的是
A.中Cl原子的杂化方式均为杂化
B.基态原子核外电子的空间运动状态有9种
C.键角:
D.的空间构型为V形,分子中的化学键的键长和键角可以通过X射线衍射实验获得
7.六氟化硫分子呈正八面体结构(如图所示),在高电压下仍有良好的绝缘性,性质稳定,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是
A.各原子均为8电子稳定结构 B.S原子轨道杂化方式与中的S一样
C.六氟化硫分子中只含极性键 D.键是键,键长可能不相等
8.下列说法正确的是
A.SO2的VSEPR模型与分子的空间结构相同
B.H2S、NF3、CH4这一组粒子的中心原子杂化类型相同,分子或离子的键角不相等
C.的电子式为,离子呈平面正方形结构,SF6分子是正八面体形
D.SO中心S原子的孤电子对数为0,故其结构为平面三角形
9.下列各组分子的中心原子杂化轨道类型相同,分子的空间结构不相同的是
A.、、 B.、、
C.、、环己烷 D.、、
10.多位化学家用简单的偶联反应合成了如下这个有趣的“纳米小人”分子。有关该分子的结构说法不正确的是
A.该分子中的C原子采取的杂化方式有:、、
B.该分子中的O原子采取杂化
C.“纳米小人”头部的所有原子不能在同一平面内
D.“纳米小人”手、脚部位的碳原子不杂化
11.顺铂是1969年发现的第一种具有抗癌活性的金属化合物;碳铂是顺式-1,1-环丁烷二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,结构简式如图所示,其毒副作用低于顺铂,下列说法正确的是
A.碳铂分子中所有碳原子在同一个平面内
B.顺铂分子中氮原子的杂化方式是
C.碳铂分子中杂化的碳原子与杂化的碳原子数之比为
D.1个1,1-环丁二羧酸()分子中含有键的数目为12
12.反应可用于实验室制备CO2气体。下列有关该反应中各物质的说法正确的是
A.和均为三原子分子,二者空间结构相同
B.中阴离子的模型为四面体
C.键角由大到小的顺序为
D.根据模型可知,CaCl2的空间结构为直线形
13.下列说法中正确的是
A.、、、分子中原子的最外层都不满足8电子稳定结构
B.和都是正四面体形分子且键角都为
C.的电子式为,离子呈平面正方形结构
D.分子中中心原子上有一个未成键的孤电子对,它对成键电子对的排斥作用较强
14.用模型可以判断许多分子或离子的空间结构,有时也能用来推测键角大小,下列判断正确的是
A.分子中三个共价键的键能、键长、键角都相等
B.、、键角由大到小的顺序为
C.分子的键角是
D.、都是三角锥形的分子
15.化合物A是近年来采用的锅炉水添加剂,其结构式如图所示,A能除去锅炉水中溶解的氧气。下列说法正确的是
A.A分子中所有原子都在同一平面内
B.A分子中所含的σ键与π键个数之比为10:1
C.A分子中C、N均为sp2杂化
D.A与足量O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
二、结构与性质(4大题,55分)
16.N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N (填“”或“”,下同)O,电负性:S Cl。
(2)前四周期元素中,未成对电子数为5的元素符号是 ;
(3)SO3的空间构型是 ,分子中的大键可用符号表示,其中m代表参与形成的大键原子数,n代表参与形成大键的电子数如苯分子中的大键可表示为,则SO3中的大键应表示为 。
(4)亚硒酸根离子()的VSEPR模型为 ;
(5)与互为等电子体的微粒有 任写两种
17.回答下列问题:
(1)是有机合成中常用的还原剂,中的阴离子空间构型是 、中心原子的杂化形式为 。
(2)①根据价层电子对互斥理论,的气态分子中,中心原子价层电子对数不同于其他分子的是 。
②气态三氧化硫以单分子形式存在,其分子的立体构型为 形,其中共价键的类型有 种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为 。
(3)《中华本草》等中医典籍中,记载了炉甘石入药,可用于治疗皮肤炎症或表面创伤。中,阴离子空间构型为 ,C原子的杂化形式为 。
18.(1)臭氧(O3)在催化下能将烟气中的、分别氧化为和,也可在其他条件下被还原为。中心原子轨道的杂化类型为 ;的空间结构为 (用文字描述)。
(2)钒()是我国的丰产元素,广泛用于催化及钢铁工业。
①常用作转化为的催化剂。分子中S原子价电子对数是 ,分子的空间结构为 ;气态为单分子,该分子中S原子的杂化轨道类型为 ;的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为 ;该结构中键长有两类,一类键长约为,另一类键长约为,较短的键为 (填图中字母),该分子中含有 个σ键。
②溶解在溶液中,可得到钒酸钠(),该盐阴离子的空间结构为 。
19.磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(2)分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 。
(3)乙二胺()是一种有机化合物,分子中氮、碳的杂化类型分别是 、 。
(4)元素与N同族。预测的氢化物分子的立体结构为 ,其沸点比的 (填“高”或“低”),其判断理由是 。
(5)中,电负性最高的元素是 ;P的 杂化轨道与O的轨道形成 键。
(6)的空间构型为 (用文字描述);抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为 ;推测抗坏血酸在水中的溶解性: (填“难溶于水”或“易溶于水”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.乙烯是平面形结构,碳原子是sp2杂化,A不符合;
B.苯是平面形结构,碳原子是sp2杂化,B不符合;
C.乙炔是直线形结构,碳原子是sp杂化,C不符合;
D.乙烷属于链状烷烃,碳原子是sp3杂化轨道,D符合;
答案选D。
2.B
【详解】A.水中O原子价层电子对数为4,采取sp3杂化方式,含有的孤对电子对数=(6-2×1)÷2=2,水是V型结构;SO2中S原子价层电子对数为3,采取 sp2杂化方式,含有的孤对电子对数=(6-2×2)÷2=1,SO2是V形结构,A不符合题意;
B.Be原子是sp杂化,是直线型结构,CO2是直线型结构,碳原子是sp杂化,B符合题意;
C.氨气中氮原子是sp3杂化,含有1对孤对电子,因此氨气是三角锥形结构,C不符合题意;
D.甲醛中碳原子是sp2杂化,属于平面型结构,D不符合题意;
故选:B。
3.A
【详解】根据价层电子对互斥模型确定微粒的空间结构,SOCl2中原子形成2个S-Cl键,1个S=O键,价层电子对数=σ键个数+孤电子对数为:,杂化轨道数是4,故原子采取sp3杂化,由于中心S原子上有一个孤电子对,分子空间结构为三角锥形,故合理选项是A。
4.B
【详解】A.H2O2分子中氧原子形成2个σ键,含有2对孤电子对,采取sp3杂化,A错误;
B.CO2分子中C原子形成2个σ键,没有孤电子对,采取sp杂化,B正确;
C.BF3分子中的B原子的最外层电子数3形成3个σ键,没有孤电子对,采取sp2杂化,C错误;
D.CH3COOH分子中有2个碳原子,其中甲基上的碳原子形成4个σ键,没有孤对电子,采取sp3杂化,D错误;
故选B。
5.D
【详解】A.甲醛分子中有3个σ键,A不正确;
B.碳酰氯分子中的C原子为sp2杂化,B不正确;
C.根据价层电子对互斥理论可知,碳酰氯分子中的氯原子有3对孤对电子,孤电子对对成键电子对有更强的排斥作用,所以,甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl不相等,C不正确;
D.碳酰氯分子为平面三角形,碳与氧形成的双键中有一个π键,D正确。
本题选D。
6.C
【详解】A.的结构式为:,的结构式为:,的结构式为,VSEPR模型均为四面体,中心原子价层电子对数均为4,因此Cl的杂化方式都是sp3,A正确;
B.量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态Cl原子的核外电子排布式为:1s22s22p63s23p5,s能级各有一个轨道,p能级各有3个轨道,共9个轨道。因此基态Cl原子的核外电子的空间运动状态有9种,B正确;
C.三种离子的Cl原子均为sp3杂化,中心原子孤电子对越多,对成键电子排斥越强,键角越小,有2对孤电子对,空间结构呈V形,键角为105,有1对孤电子对,空间结构呈三角锥形,键角为107,没有孤电子对,空间结构呈四面体形,键角为10928,键角关系为:,C错误;
D.中心原子为O原子,杂化方式为sp3,结构式为 ,因此空间构型为V形,分子中的化学键的键长和键角可以通过X射线衍射实验获得,D正确;
故选C。
7.C
【详解】A.根据题图知,每个F原子和1个S原子形成1个共用电子对,每个S原子和6个F原子形成6个共用电子对,所以F原子都达到8电子稳定结构,但S原子最外层不满足8电子稳定结构,A错误;
B. SO3中S原子孤电子对数=、价层电子对数=3+0=3,故为sp2杂化、空间构型为平面正三角形;SF6中S原子孤电子对数=、价层电子对数=6+0=6,空间构型为正八面体形、不可能为sp2杂化,B错误;
C.同种原子间形成非极性键,不同种原子间形成极性键,六氟化硫分子中的键均为极性键,不含非极性键,C正确;
D.六氟化硫分子中的键都是键,六氟化硫分子为正八面体形结构,所以各键的键长与键能都相等,D错误;
故选C。
8.B
【详解】A.SO2中S原子的价层电子对数=2+=3,含一对孤电子对,VSEPR模型为平面三角形,空间结构为V形,故A错误;
B.H2S中S原子杂化轨道数=σ键数+孤对电子对数=2+=4,所以采取sp3杂化,分子构型为V型,NF3中氮原子杂化轨道数=σ键数+孤对电子对数=3+=4,所以采取sp3杂化,分子构型为四面体型,CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,分子构型为正四面体型,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同,故B正确;
C.铵根离子与甲烷分子结构相似,都是正四面体结构,故C错误;
D.中S原子孤电子对数==1,价层电子对数=1+3=4,空间构型为三角锥形;故D错误;
故选:B。
9.B
【详解】A.中心原子都是杂化,其空间结构相同,A不符合题意;
B.中心原子都是杂化,孤电子对数不同,分子的空间结构不相同,B符合题意;
C.三氯化硼和氯乙烯的中心原子都是杂化,环己烷中碳原子为杂化,C不符合题意;
D.三氧化硫和苯分子的中心原子为杂化,而丙炔中碳原子存在和杂化,D不符合题意;
故选B。
10.D
【详解】A.该分子中碳碳三键上的C原子采取杂化,苯环上的C原子采取杂化,其他碳原子采取杂化,A正确;
B.该分子中的O原子有2对σ键电子对,有2对孤电子对,故其采取杂化,B正确;
C.“纳米小人”头部的C原子均为杂化,C原子与周围的H原子形成四面体,不在同一平面上,C正确;
D.“纳米小人”手、脚部位的碳原子都属于饱和碳原子,均采取杂化,D错误;
故选D。
11.C
【详解】A.碳铂中含饱和碳原子,6个碳原子不可能共平面,A错误;
B.顺铂分子中氮原子有3对σ键电子对,有1对孤电子对,其杂化方式是,B错误;
C.碳铂分子中酯基碳原子为杂化,而其他4个碳原子为杂化,C正确;
D.1,1-环丁二羧酸的结构中有4个饱和碳原子,和2个不饱和碳原子,则1个1,1-环丁二羧酸分子中含有18个键,D错误;
故选C。
12.C
【详解】A.二氧化碳分子中碳原子的价层电子对数为2,孤对电子对数为0,分子的空间构型为直线形,水分子中氧原子的价层电子对数为4,孤对电子对数为2,分子的空间构型为V形,二者空间结构不同,故A错误;
B.碳酸根离子中碳原子的的价层电子对数为3,分子的VSEPR模型为平面三角形,故B错误;
C.二氧化碳分子中碳原子的价层电子对数为2,孤对电子对数为0,分子的空间构型为直线形,键角为180°,碳酸根离子中碳原子的的价层电子对数为3,分子的VSEPR模型为平面三角形,键角为120°,水分子中氧原子的价层电子对数为4,孤对电子对数为2,分子的空间构型为V形,键角约为105°,则二氧化碳、碳酸根离子、水的键角依次减小,故C正确;
D.氯化钙为离子化合物,不能用VSEPR模型预测氯化钙的空间结构,故D错误;
故选C。
13.D
【详解】A.N原子最外层有5个电子,与3个Cl原子形成3对共用电子对,所以分子中N原子最外层满足8电子稳定结构,Cl原子最外层也满足8电子稳定结构,故A错误;
B.白磷分子和甲烷分子都是正四面体形,但白磷分子的键角是,故B错误;
C.的电子式为,但铵根离子的空间结构为正四面体形,故C错误;
D.氨气分子中N原子与3个H原子形成3个共价单键,还有一个孤电子对,它对成键电子对的排斥作用较强,所以键角小于,故D正确;
选D。
14.A
【详解】A.是三角锥形的分子,其结构类似于氨气,分子中三个共价键的键能、键长、键角都相等,A正确;
B.、、中中心原子都是杂化,都有1个孤电子对,分子的中心原子的电负性最大,成键电子对距离中心原子最近,键角最大,键角由大到小的顺序为,B错误;
C.是直线形分子,键角是,C错误;
D.是三角锥形的分子,分子中中心原子的价层电子对数,没有孤电子对,是三角双锥形结构,D错误;
故选A。
15.D
【详解】A.由于氨气分子空间结构为三角锥形,即氮原子与所连的三个原子不在同一平面,所以A分子中所有原子不可能共平面,A错误;
B.共价单键都是σ,共价双键中一个是σ键,一个是π键。根据A结构式可知:在1个A分子中含有11个σ键和1个π键,σ键与π键个数之比为11:1,B错误;
C.A分子中N原子价层电子对数为3+=4,所以N原子杂化类型为sp3杂化,C错误;
D.根据质量守恒定律可知:1 mol A与足量O2反应生成CO2、N2、H2O的物质的量分别为1 mol、2 mol、3 mol,则A与足量O2反应生成CO2、N2、H2O的物质的量之比为1:2:3,D正确;
故合理选项是D。
16.(1)
(2)Mn
(3) 平面正三角形
(4)四面体形
(5)BF3、SO3(合理即可)
【详解】(1)N、O位于同一周期相邻位置,N原子的2p能级电子数达到了半满结构,比较稳定,则第一电离能N>O,元素的电负性与非金属性有关,非金属性越强,电负性越大,则电负性S
(3)SO3的中心原子为S原子,形成3个键,孤电子对为=0,则空间构型为平面正三角形,三氧化硫中,有一个硫氧双键,还有两个配位键,四个原子均达到了8电子的稳定结构,硫的两对孤对电子分别配位给两个氧原子。三氧化硫中有两个配位键,配位氧的四个电子与硫氧双键的π键的两个电子形成一个四中心六电子的大π键,应表示为。
(4)亚硒酸根离子SeO的中心原子为Se,形成3个键,孤电子对为=1,则VSEPR模型为四面体形。
(5)为四个原子的离子,价电子总数为24,互为等电子体的是BF3、SO3(合理即可)。
17.(1) 正四面体形
(2) 平面三角形 2
(3) 平面三角形
【详解】(1)四氢合铝酸锂中四氢合铝酸根离子中铝原子的价层电子对数为4,孤对电子对数为0,所以离子中铝原子的杂化方式为sp3杂化,离子的空间构型为正四面体形,故答案为:sp3;正四面体形;
(2)①硫化氢分子中硫原子的价层电子对数为4,三氧化硫和二氧化硫中硫原子的价层电子对数都为3,则中心原子价层电子对数不同于其他分子的是硫化氢,故答案为:H2S;
②三氧化硫分子中硫原子的价层电子对数为3,孤对电子对数为0,所以分子的立体构型为平面三角形,分子中硫氧单键为σ键,硫氧双键中含有1个σ键和1个π键,所以分子中共价键的类型有2种;由图可知,三聚三氧化硫分子中每个硫原子与4个氧原子形成4个σ键,硫原子的的杂化方式为sp3杂化,故答案为:平面三角形;2;sp3;
(3)碳酸锌中碳酸根离子的价层电子对数为3,孤对电子对数为0,所以离子中碳原子的的杂化方式为sp2杂化,离子的空间构型为平面三角形,故答案为:平面三角形;sp2。
18. sp3 平面三角形 3 V形 sp2 sp3 a 12 正四面体形
【详解】(1)中S原子的价电子对数为,所以S原子采取sp3杂化。中氮原子上的价层电子对数为,即N采取sp2杂化,的空间结构为平面三角形;
(2)①分子中S的价电子对数为,分子的空间结构为V形;
分子中S的价电子对数为,硫原子采用sp2杂化;
由图可知的三聚体环状结构中每个S原子连有4个O原子,形成4个σ键,S原子采用sp3杂化。a处为硫氧双键,b处为硫氧单键,故a处键长较短。1个双键中包括1个σ键和1个π键,单键均为σ键,故该分子中含有12个σ键;
②中阴离子为,V的价电子对数为,则V采用sp3杂化,的空间结构为正四面体形。
19. 正四面体 4 三角锥形 低 分子间存在氢键 O 正四面体形 易溶于水
【详解】(1)中中心P原子的价层电子对数为,不含孤电子对,因此其空间构型为正四面体,P原子采取杂化方式,形成4个杂化轨道,故答案为:正四面体;4;;
(2)中中心N原子的孤电子对数为,价层电子对数为,杂化类型为杂化,同周期元素从左到右第一电离能呈增大趋势,但基态N原子的轨道为半充满稳定结构,N元素的第一电离能大于同周期相邻元素的第一电离能,故第一电离能:,故答案为:;;
(3)乙二胺中N原子形成3个键,有1个孤电子对,杂化轨道数为4,采取杂化,C原子形成4个键,杂化轨道数为4,采取杂化,故答案为:;;
(4)元素与N位于同主族,的氢化物()分子的立体结构与N的氢化物()分子的立体结构相同,均为三角锥形;的沸点比的沸点低,是因为分子间存在氢键,故答案为:三角锥形;低;分子间存在氢键;
(5)同周期主族元素从左到右,电负性逐渐增大,则电负性:;同主族元素从上到下,电负性逐渐减小,则电负性:;中H元素显正价,P元素显负价,则电负性:,由此可得电负性:,故中,电负性最高的是氧(O),P与O原子形成4个键,且无孤电子对,则P采用杂化,P的杂化轨道与O的轨道形成键,故答案为:O;;;
(6)的中心S原子最外层有6个电子,按照模型,价层电子对数为4,故中的S原子为杂化,空间构型为正四面体形,形成双键的碳原子为杂化,四个键均为单键的碳原子为杂化;抗坏血酸分子中有四个羟基,羟基为亲水性基团,则抗坏血酸易溶于水,故答案为:正四面体形;;易溶于水。
答案第1页,共2页
答案第1页,共2页
