山西省襄垣县第一中学校2014-2015学年高二上学期三校联考(期中)化学(理科)试题
文档属性
| 名称 | 山西省襄垣县第一中学校2014-2015学年高二上学期三校联考(期中)化学(理科)试题 |  | |
| 格式 | zip | ||
| 文件大小 | 88.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-04-25 11:55:20 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
绝密★启用前
2014-2015学年度第一学期期中三校联考
高 二 年级 化学 试题(理科)
命题学校 山西黎城一中 命题人 李晓平 审核人 王翠红
考试范围:新人教版选修4《化学反应原理》第一、二章内容 考试时间: 90 分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的相对原子质量:H:1 O:1 ( http: / / www.21cnjy.com )6 N:14 S:32 Cl:35.5 C:12 Na:23 Ba:137 Fe:56 Cu:64 【来源:21cnj*y.co*m】
第Ⅰ卷
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )【出处:21教育名师】
①天然气 ②太阳能 ③核能 ④石油 ⑤煤 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.②⑥⑦⑧
C.①③⑤⑥⑦⑧ D.②③⑥⑦⑧
2.下列说法中正确的是( )
A.能自发进行的反应都是放热反应
B.凡是熵增加的反应一定能自发进行
C.在一定条件下,吸热反应可以自发进行
D.放热的熵增加的反应不一定能够自发进行
3.下列事实中,不能用勒夏特列原理解释的是( )
A.对熟石灰的悬浊液加热,悬浊液中固体质量增加
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
4. 在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,
已知2 vB =3vA、3vC=2 vB ,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C21·世纪*教育网
5. 对于反应2C4H10(g) + 13O2(g) == 8CO2(g) + 10H2O(l);△H= -5800kJ/mol下列叙述错误的是( )
A. 该反应的反应热为△H= -5800kJ/mol,是放热反应;
B. 该反应的△H与各物质的状态有关,与化学计量数也有关;
C. 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ;
D. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。
6. 已知常温时红磷比白磷稳定,在下列反应中:
P4(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
7. 下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动21教育名师原创作品
②已达平衡的反应N2(g)+3H2(g)2NH3(g),当增大N2的浓度时,平衡
向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
8. 一定温度下容积恒定的密闭容器中,有可逆反应:A(s)+2B(g) C(g)+D(g)。当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强
③混合气体的总物质的量 ④B物质的量浓度
A.①和④ B.②和③ C.②③④ D.只有④
9. 从下列实验事实所引起的相应结论不正确的是( )
选项 实 验 事 实 结 论
A 其它条件不变, 0.01mol/L的KMn ( http: / / www.21cnjy.com )O4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短。 当其它条件不变时,增大反应物浓度可以使化学反应速率加快
B 其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊。 当其它条件不变时,反应体系的温度越高、化学反应速率越快
C 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变。 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程
D 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)2HI(g),获得等量HI时需要的时间前者少。 当其它条件不变时,气态反应体系的压强越大,化学反应速率越快
10. 已知某可逆反应:mA(g)+nB(g) pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
A. T1P2,m+n>p,△H>0
B. T1>T2,P1p,△H>0
C. T1>T2,P1D. T1>T2,P1>P2,m+n>p,△H<0
11. 已知 :2SO2(g)+ O2(g)2SO3(g) △H= -QKJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:21世纪教育网版权所有
实验编号 SO2(g) O2(g) SO3(g)
1. 2mol 1mol 0mol
2. 1mol 0.5mol 1mol
3. 1mol 0.8mol 1.4mol
充分作用后,测得实验1反应放出的热量为Q1KJ,实验2没有热量变化,则下列说法中不正确的是( )
A. 实验1放出的热量值为Q1=0.5Q B. 该条件下的平衡常数为4
C. 实验1中O2的转化率为50% D. 实验3反应放出热量
12.已知反应:mX(g)+nY(g)??qZ(g) ΔH<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )21·cn·jy·com
A.通入稀有气体,压强增大,平衡正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
13.在一定条件下,发生C ( http: / / www.21cnjy.com )O + NO2 CO2 + NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )www.21-cn-jy.com
A.正反应为吸热反应 B.正反应为放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
14.已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为( )
A.488.3 kJ/mol B.-224.15 kJ/mol
C.-488.3 kJ/mol D.244.15 kJ/mol
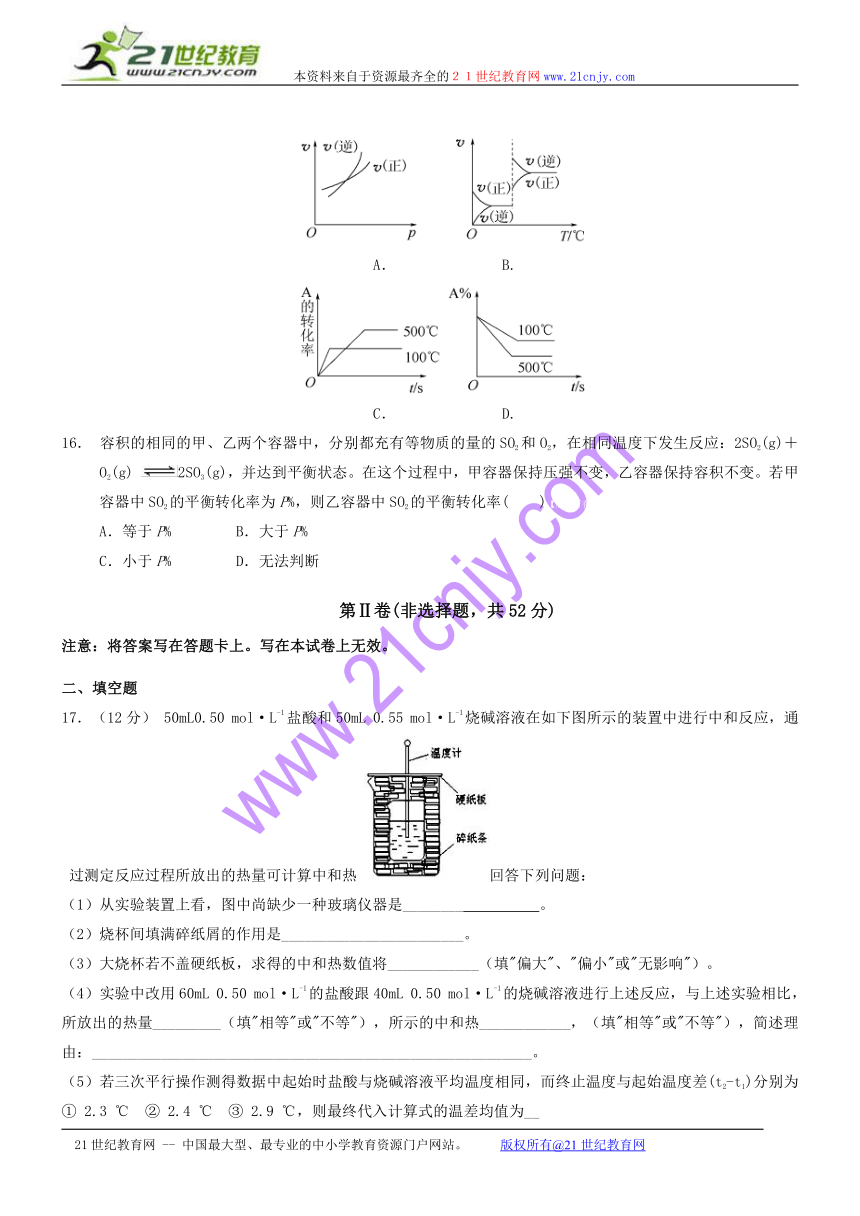
15.对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应),下列图像中正确的是( )
( http: / / www.21cnjy.com )
A. B.
( http: / / www.21cnjy.com )
C. D.
16. 容积的相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡状态。在这个过程中,甲容器保持压强不变,乙容器保持容积不变。若甲容器中SO2的平衡转化率为P%,则乙容器中SO2的平衡转化率( )【版权所有:21教育】
A.等于P% B.大于P%
C.小于P% D.无法判断
第Ⅱ卷(非选择题,共52分)
注意:将答案写在答题卡上。写在本试卷上无效。
二、填空题
17.(12分) 50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如下图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热 ( http: / / www.21cnjy.com )回答下列问题: 21教育网
(1)从实验装置上看,图中尚缺少一种玻璃仪器是________ 。
(2)烧杯间填满碎纸屑的作用是________________________。
(3)大烧杯若不盖硬纸板,求得的中和热数值将____________(填"偏大"、"偏小"或"无影响")。
(4)实验中改用60mL 0.50 m ( http: / / www.21cnjy.com )ol·L-1的盐酸跟40mL 0.50 mol·L-1的烧碱溶液进行上述反应,与上述实验相比,所放出的热量_________(填"相等"或"不等"),所示的中和热____________,(填"相等"或"不等"),简述理由:__________________________________________________________。21*cnjy*com
(5)若三次平行操作测得数据中起始 ( http: / / www.21cnjy.com )时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为① 2.3 ℃ ② 2.4 ℃ ③ 2.9 ℃,则最终代入计算式的温差均值为__
℃。(保留2位小数)
18.(8分) 在如图所示的三个容积相同的三个容器①、②、③中进行如下的反应:
3A(g) + B(g) 2C(g);△H<0
( http: / / www.21cnjy.com )
(1)若起始温度相同,分别向三个容 ( http: / / www.21cnjy.com )器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 (填容器编号)2-1-c-n-j-y
(2)达到平衡时,在②和③两容器中分别通入等 ( http: / / www.21cnjy.com )量的氦气。③中的化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)②中的化学反应速率 (填“增大”“减小”“不变 ”)
(3)起始时在②中投入3 ( http: / / www.21cnjy.com )mol A和1 mol B,在③中投入a mol A和b mol B及c mol C,若达平衡时②和③压强恰好相同,且欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料必须满足 (用含a、b、c的关系式表达)
19.(8分) 已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物 ( http: / / www.21cnjy.com )的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时N的转化率为__________; 21*cnjy*com
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度 ( http: / / www.21cnjy.com )分别为: c(M)=4 mol/L,c(N)=a mol/L;达到平衡后, c(P)=2 mol/L,a=______。www-2-1-cnjy-com
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L;达到平衡后,M的转化率为________。
20.(9分) 氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g) H2(g)+CO(g)
该反应的平衡常数表达式为
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K′=0.5。
①2NH3(g) N2(g)+3H2(g)的K=__________(填数值)。
②400℃时,在0.5 L的反应容器中 ( http: / / www.21cnjy.com )进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正__________v(N2)逆(填“>”、“<”、“=”或“不确定”)。
21.(10分)(1)已知在常温常压下:
① CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8KJ/mol
② 2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(2)已知合成氨的热化学方程式为:N2(g)+3H2(g)2NH3(g);ΔH= -92.2KJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
时间(h)
物质的量(mol) 0 1 2 3 4
N2 1.50 n1 1.20 n3 1.00
H2 4.50 4.20 3.60 n4 3.00
NH3 0.00 0.20 n2 1.00 1.00
根据表中数据计算:
① 反应进行到2小时时放出的热量为 KJ。
② 0 ~ 1小时内N2的平均反应速率为
③ 此条件下该反应的化学平衡常数K ( http: / / www.21cnjy.com )= (保留两位小数)。
④ 反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向
方向移动(填“正反应”或“逆反应”或“不移动”)
三、计算题(5分)
22. 有A、B两个容器,A为恒压容器,B为恒容容器。在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2 。此时VA=2VB 。维持温度不变,A、B中的反应均达到平衡。平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的。21cnjy.com
( http: / / www.21cnjy.com )
(1)平衡时A容器中NH3的体积分数是__________。
(2)已知在该温度下:N2(g)+3H2(g) 2NH3(g) △H= –Q kJ/mol。则QA、2QB、
Q三者由小到大的顺序为___________________ 。
2014-2015学年度第一学期期中三校联考
高 二 年级 化学 答案(理科)
1、 选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8 9
答案 B C D A D C D A C
题号 10 11 12 13 14 15 16
答案 B D B B C D C
2、 填空题
17. (12分)
(1)环形玻璃搅拌棒 (2分)
(2)减少实验过程中放出热量的损失(2分)
(3)偏小(2分)
(4) 不等(1分)相等(1分)因为中和热是指酸跟碱发生中和反应生成1molH2O时候所放出的能量,与酸碱的用量无关(2分) 2·1·c·n·j·y
(5)2.35(2分)
18. (8分)
(1)③>②>①
(2)逆反应 不变
(3)a=3b (c≧0) (每空2分)
19. (8分)
(1)25℅
(2)增大
(3)6
(4)41℅ (每空2分)
20. (9分)
(1) K=
(2)2
(3)= (每空3分)
21. (10分)
(1)CH3OH(l) +3/2 O2(g)===CO2(g) + 2H2O(l) △H=-725.8kJ/mol【来源:21·世纪·教育·网】
(2)① 27.66 ② 0.05mol·L-1·h-1 (不写单位计0分)
③ 0.15 ④ 正反应 (每空2分)
三、计算题
22. (5分)
(1)25℅(2分)
(2)2QB<QA<Q(3分)
C(CO)·C(H2)
C(H2O)
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
绝密★启用前
2014-2015学年度第一学期期中三校联考
高 二 年级 化学 试题(理科)
命题学校 山西黎城一中 命题人 李晓平 审核人 王翠红
考试范围:新人教版选修4《化学反应原理》第一、二章内容 考试时间: 90 分钟
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的相对原子质量:H:1 O:1 ( http: / / www.21cnjy.com )6 N:14 S:32 Cl:35.5 C:12 Na:23 Ba:137 Fe:56 Cu:64 【来源:21cnj*y.co*m】
第Ⅰ卷
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )【出处:21教育名师】
①天然气 ②太阳能 ③核能 ④石油 ⑤煤 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.②⑥⑦⑧
C.①③⑤⑥⑦⑧ D.②③⑥⑦⑧
2.下列说法中正确的是( )
A.能自发进行的反应都是放热反应
B.凡是熵增加的反应一定能自发进行
C.在一定条件下,吸热反应可以自发进行
D.放热的熵增加的反应不一定能够自发进行
3.下列事实中,不能用勒夏特列原理解释的是( )
A.对熟石灰的悬浊液加热,悬浊液中固体质量增加
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
4. 在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,
已知2 vB =3vA、3vC=2 vB ,则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C21·世纪*教育网
5. 对于反应2C4H10(g) + 13O2(g) == 8CO2(g) + 10H2O(l);△H= -5800kJ/mol下列叙述错误的是( )
A. 该反应的反应热为△H= -5800kJ/mol,是放热反应;
B. 该反应的△H与各物质的状态有关,与化学计量数也有关;
C. 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ;
D. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。
6. 已知常温时红磷比白磷稳定,在下列反应中:
P4(白磷,s)+5O2(g)====2P2O5(s);△H=== -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H=== -b kJ/mol
若a、b均大于零,则a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
7. 下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动21教育名师原创作品
②已达平衡的反应N2(g)+3H2(g)2NH3(g),当增大N2的浓度时,平衡
向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
8. 一定温度下容积恒定的密闭容器中,有可逆反应:A(s)+2B(g) C(g)+D(g)。当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强
③混合气体的总物质的量 ④B物质的量浓度
A.①和④ B.②和③ C.②③④ D.只有④
9. 从下列实验事实所引起的相应结论不正确的是( )
选项 实 验 事 实 结 论
A 其它条件不变, 0.01mol/L的KMn ( http: / / www.21cnjy.com )O4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短。 当其它条件不变时,增大反应物浓度可以使化学反应速率加快
B 其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊。 当其它条件不变时,反应体系的温度越高、化学反应速率越快
C 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变。 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程
D 一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)2HI(g),获得等量HI时需要的时间前者少。 当其它条件不变时,气态反应体系的压强越大,化学反应速率越快
10. 已知某可逆反应:mA(g)+nB(g) pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
A. T1
B. T1>T2,P1
C. T1>T2,P1
11. 已知 :2SO2(g)+ O2(g)2SO3(g) △H= -QKJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:21世纪教育网版权所有
实验编号 SO2(g) O2(g) SO3(g)
1. 2mol 1mol 0mol
2. 1mol 0.5mol 1mol
3. 1mol 0.8mol 1.4mol
充分作用后,测得实验1反应放出的热量为Q1KJ,实验2没有热量变化,则下列说法中不正确的是( )
A. 实验1放出的热量值为Q1=0.5Q B. 该条件下的平衡常数为4
C. 实验1中O2的转化率为50% D. 实验3反应放出热量
12.已知反应:mX(g)+nY(g)??qZ(g) ΔH<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )21·cn·jy·com
A.通入稀有气体,压强增大,平衡正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
13.在一定条件下,发生C ( http: / / www.21cnjy.com )O + NO2 CO2 + NO 的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )www.21-cn-jy.com
A.正反应为吸热反应 B.正反应为放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
14.已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应④2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为( )
A.488.3 kJ/mol B.-224.15 kJ/mol
C.-488.3 kJ/mol D.244.15 kJ/mol
15.对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应),下列图像中正确的是( )
( http: / / www.21cnjy.com )
A. B.
( http: / / www.21cnjy.com )
C. D.
16. 容积的相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡状态。在这个过程中,甲容器保持压强不变,乙容器保持容积不变。若甲容器中SO2的平衡转化率为P%,则乙容器中SO2的平衡转化率( )【版权所有:21教育】
A.等于P% B.大于P%
C.小于P% D.无法判断
第Ⅱ卷(非选择题,共52分)
注意:将答案写在答题卡上。写在本试卷上无效。
二、填空题
17.(12分) 50mL0.50 mol·L-1盐酸和50mL 0.55 mol·L-1烧碱溶液在如下图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热 ( http: / / www.21cnjy.com )回答下列问题: 21教育网
(1)从实验装置上看,图中尚缺少一种玻璃仪器是________ 。
(2)烧杯间填满碎纸屑的作用是________________________。
(3)大烧杯若不盖硬纸板,求得的中和热数值将____________(填"偏大"、"偏小"或"无影响")。
(4)实验中改用60mL 0.50 m ( http: / / www.21cnjy.com )ol·L-1的盐酸跟40mL 0.50 mol·L-1的烧碱溶液进行上述反应,与上述实验相比,所放出的热量_________(填"相等"或"不等"),所示的中和热____________,(填"相等"或"不等"),简述理由:__________________________________________________________。21*cnjy*com
(5)若三次平行操作测得数据中起始 ( http: / / www.21cnjy.com )时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为① 2.3 ℃ ② 2.4 ℃ ③ 2.9 ℃,则最终代入计算式的温差均值为__
℃。(保留2位小数)
18.(8分) 在如图所示的三个容积相同的三个容器①、②、③中进行如下的反应:
3A(g) + B(g) 2C(g);△H<0
( http: / / www.21cnjy.com )
(1)若起始温度相同,分别向三个容 ( http: / / www.21cnjy.com )器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为 (填容器编号)2-1-c-n-j-y
(2)达到平衡时,在②和③两容器中分别通入等 ( http: / / www.21cnjy.com )量的氦气。③中的化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”)②中的化学反应速率 (填“增大”“减小”“不变 ”)
(3)起始时在②中投入3 ( http: / / www.21cnjy.com )mol A和1 mol B,在③中投入a mol A和b mol B及c mol C,若达平衡时②和③压强恰好相同,且欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料必须满足 (用含a、b、c的关系式表达)
19.(8分) 已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物 ( http: / / www.21cnjy.com )的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时N的转化率为__________; 21*cnjy*com
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度 ( http: / / www.21cnjy.com )分别为: c(M)=4 mol/L,c(N)=a mol/L;达到平衡后, c(P)=2 mol/L,a=______。www-2-1-cnjy-com
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L;达到平衡后,M的转化率为________。
20.(9分) 氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g) H2(g)+CO(g)
该反应的平衡常数表达式为
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K′=0.5。
①2NH3(g) N2(g)+3H2(g)的K=__________(填数值)。
②400℃时,在0.5 L的反应容器中 ( http: / / www.21cnjy.com )进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正__________v(N2)逆(填“>”、“<”、“=”或“不确定”)。
21.(10分)(1)已知在常温常压下:
① CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H1=-442.8KJ/mol
② 2CO(g)+O2(g)=2CO2(g);ΔH2 =-566.0kJ/mol
写出表示甲醇燃烧热的热化学方程式__________________________________________
(2)已知合成氨的热化学方程式为:N2(g)+3H2(g)2NH3(g);ΔH= -92.2KJ·mol-1
下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
时间(h)
物质的量(mol) 0 1 2 3 4
N2 1.50 n1 1.20 n3 1.00
H2 4.50 4.20 3.60 n4 3.00
NH3 0.00 0.20 n2 1.00 1.00
根据表中数据计算:
① 反应进行到2小时时放出的热量为 KJ。
② 0 ~ 1小时内N2的平均反应速率为
③ 此条件下该反应的化学平衡常数K ( http: / / www.21cnjy.com )= (保留两位小数)。
④ 反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡向
方向移动(填“正反应”或“逆反应”或“不移动”)
三、计算题(5分)
22. 有A、B两个容器,A为恒压容器,B为恒容容器。在相同温度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2 。此时VA=2VB 。维持温度不变,A、B中的反应均达到平衡。平衡时,两容器中反应放出的热量分别为QAkJ、QBkJ,A容器中气体体积为起始时的。21cnjy.com
( http: / / www.21cnjy.com )
(1)平衡时A容器中NH3的体积分数是__________。
(2)已知在该温度下:N2(g)+3H2(g) 2NH3(g) △H= –Q kJ/mol。则QA、2QB、
Q三者由小到大的顺序为___________________ 。
2014-2015学年度第一学期期中三校联考
高 二 年级 化学 答案(理科)
1、 选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
题号 1 2 3 4 5 6 7 8 9
答案 B C D A D C D A C
题号 10 11 12 13 14 15 16
答案 B D B B C D C
2、 填空题
17. (12分)
(1)环形玻璃搅拌棒 (2分)
(2)减少实验过程中放出热量的损失(2分)
(3)偏小(2分)
(4) 不等(1分)相等(1分)因为中和热是指酸跟碱发生中和反应生成1molH2O时候所放出的能量,与酸碱的用量无关(2分) 2·1·c·n·j·y
(5)2.35(2分)
18. (8分)
(1)③>②>①
(2)逆反应 不变
(3)a=3b (c≧0) (每空2分)
19. (8分)
(1)25℅
(2)增大
(3)6
(4)41℅ (每空2分)
20. (9分)
(1) K=
(2)2
(3)= (每空3分)
21. (10分)
(1)CH3OH(l) +3/2 O2(g)===CO2(g) + 2H2O(l) △H=-725.8kJ/mol【来源:21·世纪·教育·网】
(2)① 27.66 ② 0.05mol·L-1·h-1 (不写单位计0分)
③ 0.15 ④ 正反应 (每空2分)
三、计算题
22. (5分)
(1)25℅(2分)
(2)2QB<QA<Q(3分)
C(CO)·C(H2)
C(H2O)
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
