2023年哈尔滨市第九中高二化学上期中考试卷(图片版无答案)
文档属性
| 名称 | 2023年哈尔滨市第九中高二化学上期中考试卷(图片版无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 11:22:23 | ||
图片预览



文档简介
2。高纯破酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿广(还
含Fe、A、Mg、Si等元素)制备,工艺如下图所示。回答下列问题:
H,SO
Mno,
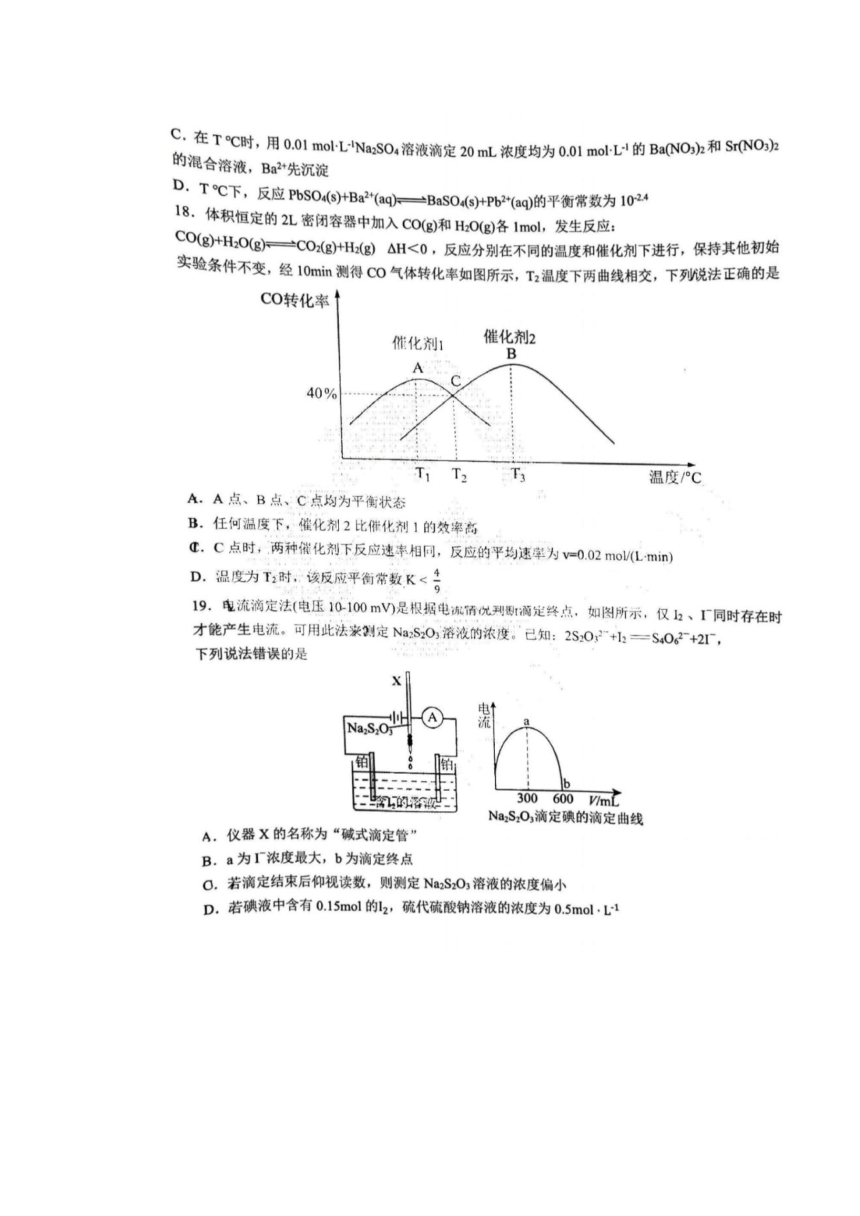
氨水
试剂aNH,HCO,
MnS矿
溶浸
氧化
调pH
除杂
MnC,粉
沉锰
+MnCO,-
O.MnSO,
Si02、S
滤渣1
滤渣2
常温下,相关金属离子[c(M)=0.1moL-]形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2
Fe2+
Fe3+
A13+
Mg2+
开始沉淀的pH
8.0
6.3
1.5
3.4
8.9
沉淀完全的pH
8.3
2.8
4.7
10.9
(I)“氧化”过程中添加适黨的MnO2,其作用是将溶液中的
(2)通过表格中数据分析,通过“调pH可以除铁和铝,溶液的pH范围为
(3)根据表格中所给的信总,计算KsMn(OH)2=
,Mn2+沉淀完全的pH值,x=
(4)“除杂”是为了使溶液中的Mg2+变成沉淀从而除去,“除杂”的最佳试剂a为
(已知KpMg(OH2]=5.6×10-12,Kn[MgF2]=7.1×10)
A.NaOH
B.NaF
C.Na2SO4
(5)在“沉锰”过程中用到NH4HCO3溶液将Mn2*转化为MnCO,根据表格所给信息,按要求完成下
列问题。
电解质
电离平衡常数(25C)
H2CO3
K1=4.5×107
K2=4.7×1011
NH3H2O
K=1.8×105
①试求出HCO,的水解平衡常数K
(保留小数点后一位)。
②在“沉锰”中用到的NH4HCO,溶液呈
性(填“酸”、“碱”或“中”)。
③写出NH HCO,溶液中的元素守恒关系式:
23.环戊二烯(
)是爪要的有机化工原料,广泛用于农药、橡胶、塑料答生产。
回答下列问题:
(1)已知:反应①:
△H=+100.3 kJ.mol-
反应②:H(g)+1(g)2HI(g)
△H2=-11.0 kJ.mol-
①对于反应③:
(g+g)-g+2Hg)△H-
kJ.mol-1
②该反应在
时可自发进行。(填“高温”、“低温”或“任意温度”)
(2)某温度下,等物质的景的环戊烯(“)和碘单质在恒容密闭容器中发生反应③,起始总压为
100KPa,2h后达到平衡,环戊烯的转化率为40%。
①用环戊烯的分压表示平均速率为
KPah,平衡后的总压为
KPa。
②该反应的平衡常数K=
KPa(保留小数点后一位)。
(3)达到平衡后,欲提高环戊烯的平衡转化率和该反应的化学反应速率,可采取的措施有
A.升高温度,B.:及时分离产物
C.增加碘单质的浓度
D.增加环戊烯的浓度
(4)环戊二烯的氢化过程中发生如下反应
反应1:CsH6(g环戊二烯)+H(g)一CsHs(g,环戊烯)
反应山:CsHx(g,环戊烯)+H(g)=CsH1o(g,环戊烷)
为研究不同温度下的催化剂活性,测得不同温度(其他条件相同)下反应4h时环戊二烯的转化率和环
戊烯的选择性的数据如图所示。
选择性=生成目标产物所消耗的原料量
100%
原料消耗的总量
1.00
1.00
0.80
0.80
0.60
1
0.40
40
0.20
◆环戊二烯的转化率
0.20
环戊烯的选择性
25
30
35
4045
温度/°C
①环戊二烯氢化制环戊烯的最佳反应温度为
②升高温度,环戊二烯的转化率提高而环戊烯的选择性降低,其原因是
含Fe、A、Mg、Si等元素)制备,工艺如下图所示。回答下列问题:
H,SO
Mno,
氨水
试剂aNH,HCO,
MnS矿
溶浸
氧化
调pH
除杂
MnC,粉
沉锰
+MnCO,-
O.MnSO,
Si02、S
滤渣1
滤渣2
常温下,相关金属离子[c(M)=0.1moL-]形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2
Fe2+
Fe3+
A13+
Mg2+
开始沉淀的pH
8.0
6.3
1.5
3.4
8.9
沉淀完全的pH
8.3
2.8
4.7
10.9
(I)“氧化”过程中添加适黨的MnO2,其作用是将溶液中的
(2)通过表格中数据分析,通过“调pH可以除铁和铝,溶液的pH范围为
(3)根据表格中所给的信总,计算KsMn(OH)2=
,Mn2+沉淀完全的pH值,x=
(4)“除杂”是为了使溶液中的Mg2+变成沉淀从而除去,“除杂”的最佳试剂a为
(已知KpMg(OH2]=5.6×10-12,Kn[MgF2]=7.1×10)
A.NaOH
B.NaF
C.Na2SO4
(5)在“沉锰”过程中用到NH4HCO3溶液将Mn2*转化为MnCO,根据表格所给信息,按要求完成下
列问题。
电解质
电离平衡常数(25C)
H2CO3
K1=4.5×107
K2=4.7×1011
NH3H2O
K=1.8×105
①试求出HCO,的水解平衡常数K
(保留小数点后一位)。
②在“沉锰”中用到的NH4HCO,溶液呈
性(填“酸”、“碱”或“中”)。
③写出NH HCO,溶液中的元素守恒关系式:
23.环戊二烯(
)是爪要的有机化工原料,广泛用于农药、橡胶、塑料答生产。
回答下列问题:
(1)已知:反应①:
△H=+100.3 kJ.mol-
反应②:H(g)+1(g)2HI(g)
△H2=-11.0 kJ.mol-
①对于反应③:
(g+g)-g+2Hg)△H-
kJ.mol-1
②该反应在
时可自发进行。(填“高温”、“低温”或“任意温度”)
(2)某温度下,等物质的景的环戊烯(“)和碘单质在恒容密闭容器中发生反应③,起始总压为
100KPa,2h后达到平衡,环戊烯的转化率为40%。
①用环戊烯的分压表示平均速率为
KPah,平衡后的总压为
KPa。
②该反应的平衡常数K=
KPa(保留小数点后一位)。
(3)达到平衡后,欲提高环戊烯的平衡转化率和该反应的化学反应速率,可采取的措施有
A.升高温度,B.:及时分离产物
C.增加碘单质的浓度
D.增加环戊烯的浓度
(4)环戊二烯的氢化过程中发生如下反应
反应1:CsH6(g环戊二烯)+H(g)一CsHs(g,环戊烯)
反应山:CsHx(g,环戊烯)+H(g)=CsH1o(g,环戊烷)
为研究不同温度下的催化剂活性,测得不同温度(其他条件相同)下反应4h时环戊二烯的转化率和环
戊烯的选择性的数据如图所示。
选择性=生成目标产物所消耗的原料量
100%
原料消耗的总量
1.00
1.00
0.80
0.80
0.60
1
0.40
40
0.20
◆环戊二烯的转化率
0.20
环戊烯的选择性
25
30
35
4045
温度/°C
①环戊二烯氢化制环戊烯的最佳反应温度为
②升高温度,环戊二烯的转化率提高而环戊烯的选择性降低,其原因是
同课章节目录
