第五单元化学方程式基础题(含答案)2023-2024学年九年级化学人教版上册
文档属性
| 名称 | 第五单元化学方程式基础题(含答案)2023-2024学年九年级化学人教版上册 |  | |
| 格式 | docx | ||
| 文件大小 | 122.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 13:34:12 | ||
图片预览


文档简介
第五单元化学方程式基础题---2023-2024学年九年级化学人教版上册
一、单选题
1.我国使用“长征3号甲”运载火箭的动力由高氯酸铵(NH4ClO4)分解所提供,反应方程式为2NH4ClO4 N2↑+Cl2↑+4X↑+2O2↑,则X的化学式为( )
A.NH3 B.H2O C.H2 D.HCl
2.发射“婵娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式为C2H8N2 + 2N2O4 = 3X + 2CO2 + 4H2O ,则X的化学式为( )
A.H2 B.O2 C.N2 D.CO
3.科学家发现在特殊条件下水能表现出有趣的结构和性质。例如,在一定条件下给水施加弱电场,能使水在常温常压下结成冰(结构见图)。下列说法正确的是( )
A.由于分子的运动性,在弱电场下,水分子的排列不可能从无序转变为有序
B.水结成“热冰”的过程中,水分子的体积发生变化
C.上述变化过程中分子之间的间隔没有发生变化
D.利用该性质,人们可能在常温常压下建成溜冰场
4.“84消毒剂”是以次氯酸钠为主要有效成分的消毒液。制备次氯酸钠的原理可表示为:2NaOH + Cl2 = NaClO+X+H2O,则X的化学式是( )
A.Na2O B.NaCl C.NaH D.NaClO3
5.根据化学方程式不能获得的信息是( )
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对质量
6.工业上利用下列反应制取金属Hg:4HgS+4CaO=4Hg+3X+CaSO4。该反应中X的化学式为()
A.CaS B.SO2 C.SO3 D.CaSO3
7.铜和盐酸、稀硫酸不发生反应,但与稀硝酸能发生如下反应: ,可推测X的化学式是( )
A.N2O3 B.NO C.NO2 D.N2O
8.一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前质量/g 1 30 17 2
反应后质量/g m 39 0 10
关于此反应,下列认识不正确的是( )
A.表中m为1 B.甲可能是该反应的催化剂
C.该反应是化合反应 D.反应中乙、丁的质量比为9:8
9.下列关于质量守恒定律的说法错误的是( )
A.木炭在空气中燃烧成灰,虽然固体质量减少,但这并不违背质量守恒定律。
B.煤块燃烧后,变成质量小得多的煤灰,说明煤燃烧的反应不符合质量守恒定律。
C.根据质量守恒定律,镁条在空气中燃烧生成氧化镁的质量一定大于反应的镁条质量。
D.化学反应的实质是原子的重新组合,不存在原子的得失,因此化学反应前后质量守恒。
10.宏观辨识与微观探析是化学学科的核心素养之一。对下列事实的微观解释不正确的是( )
A.金刚石和石墨的物理性质差异大——碳原子的排列方式不同
B.夏天汽车轮胎爆炸——轮胎内气体分子变大
C.化学反应前后各物质质量总和不变——反应前后原子的种类、数目、质量均不改变
D.氯化钠溶液能导电——溶液中存在可自由移动的离子
11.常温下,向一定质量的CaO和CaCO3的固体混合物中,加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应,得到不饱和溶液甲。向溶液甲中滴加溶质质量分数为10%的Na2CO3溶液,至恰好完全反应,过滤,得到溶液乙和沉淀丙。下列有关说法中,错误的是( )
A.固体混合物中钙元素的质量为4g
B.反应过程中生成的CO2质量为4.4g
C.加入碳酸钠溶液的质量为106g
D.溶液乙中只含一种溶质
12.实验室有一包含杂质的碳酸氢钠样品100g(杂质不含钠元素,受热不变化),其中钠元素质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为87.6g,则分解的碳酸氢钠占原碳酸氢钠的质量分数为(2NaHCO3 Na2CO3 + H2O + CO2↑)( )
A.33.6% B.40%
C.47.3% D.60%
二、填空题
13.空气是重要的自然资源。
(1)人类每时每刻都离不开空气,因为空气中的氧气具有的性质是 。
(2)下列关于空气的说法正确的是______。
A.空气由空气分子构成
B.N2、O2等均匀地混合
C.N2、O2不再保持各自的化学性质
(3)同温同压下,气体的体积比等于分子个数比。若空气中其它成分忽略不计,下图可表示空气微观模型的是 。
14.写出下列反应的化学方程式:
(1)氯化钡溶液和硫酸钠溶液 ;
(2)“曾青(CuSO4)得铁化为铜” ;
(3)高炉炼铁中,一氧化碳与氧化铁在高温下反应 。
三、计算题
15.某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当恰好中和时,消耗的稀硫酸的质量为 g。
(2)计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
四、实验探究题
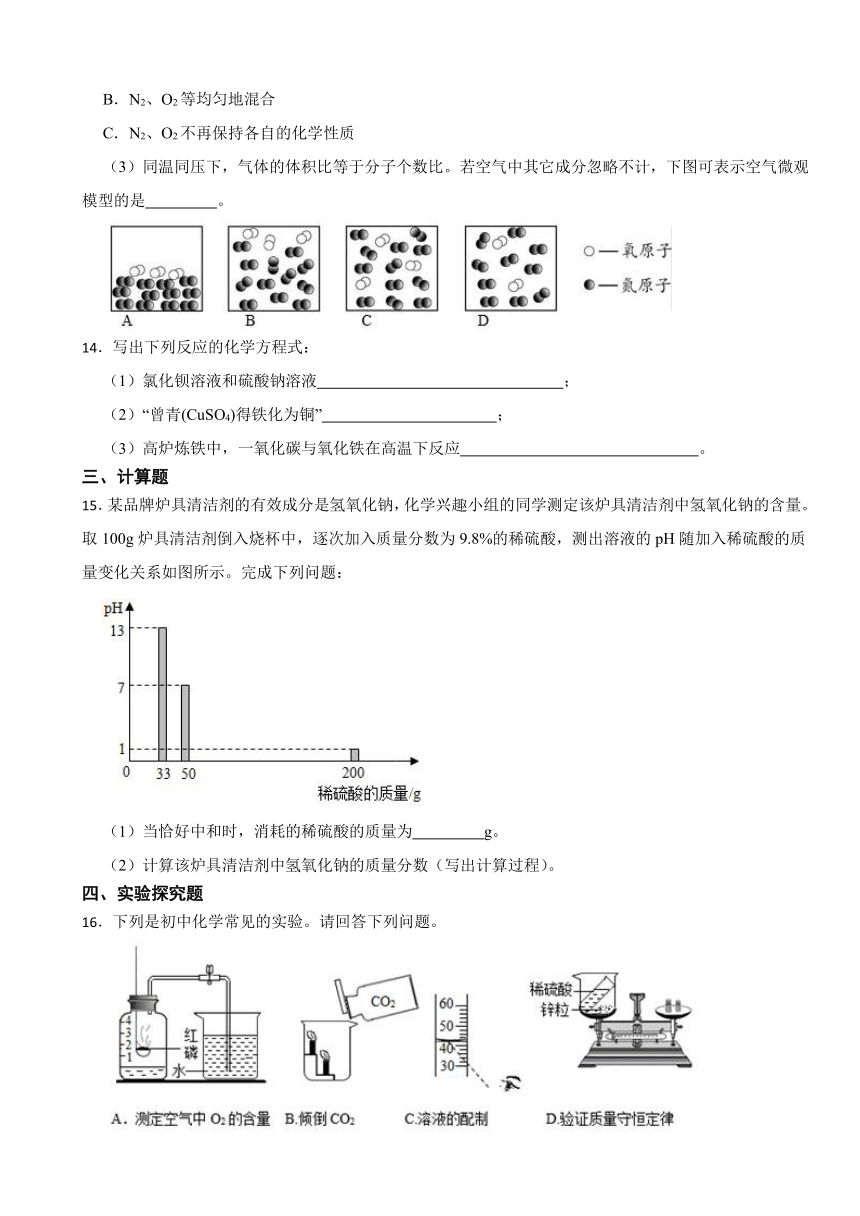
16.下列是初中化学常见的实验。请回答下列问题。
(1)图A实验中,红磷必须足量的原因是 。
(2)图B实验中可观察到的现象是 。
(3)配制一定质量分数的氯化钠溶液,按图C所示量取溶剂,其它操作均正确,最终导致配制的溶液溶质的质量分数 (填“偏大”、“偏小”或“不变”)。
(4)图D所示实验不能验证质量守恒定律的原因是 。
17.使用如图所示装置制取氧气.
(1)写出加热高锰酸钾制氧气的化学方程式: :
(2)指出右图装置中一个明显的不足之处: ;
(3)氧气收集完成后,测得其纯度明显偏低,原因可能是: (填字母、可多选);
A.高锰酸钾中混入了二氧化锰
B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水
D.未见气泡连续均匀冒出时就开始收集
(4)在研究“适于制取氧气的物质及其反应条件”的过程中,某同学完成了下表所示系列实验:
序号 实验 能否生成氧气
A 加热高锰酸钾 能
B 加热二氧化硅 不能
C 加热氯化钠 不能
D 加热水 不能
E 电解水 能
①根据实验A、B、C,可以得出的结论是:在一定条件下, ;
②根据实验D、E,可以得出的结论是: 是影响物质能否反应产生氧气的重要因素;
(5)将10g高锰酸钾加热一段时间后,称得剩余固体的质量为9.36g.试计算:
①产生氧气的质量;
②剩余高锰酸钾的质量.
五、综合题
18.我国曾发生多次将工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件.
(1)食盐主要成分的化学式为 ;
(2)亚硝酸钠和食盐中都含有的离子的化学符号是 ;
(3)亚硝酸钠与氯化铵共热能发生反应,其化学方程式为:NaNO2+NH4Cl NaCl+X↑+2H2O,则X的化学式为 ,该化学方程式里的含氮物质中,氮元素未表现出的化合价为 价(填序号)
A.+3 B.﹣3 C.0 D.+5.
19.按题目提示写出有关的化学方程式和部分物质的化学式。
(1)将黑色氧化铜粉末置于试管中加热;通入氨气,则生成红色的铜、水和一种气体单质。该反应的化学方程式是: ;
(2)在细菌作用下,用氨处理含甲醇的工业废水,使其变为N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B=3N2
↑+5CO2 ↑+19H2O,其中B物质的化学式是 ;
(3)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,写出该反应的化学方程式: 。
答案解析部分
1.【答案】B
2.【答案】C
3.【答案】D
4.【答案】B
5.【答案】B
6.【答案】A
7.【答案】B
8.【答案】C
9.【答案】B
10.【答案】B
11.【答案】B
12.【答案】B
13.【答案】(1)供给呼吸
(2)B
(3)C
14.【答案】(1)BaCl2+Na2SO4=BaSO4↓+2NaCl
(2)Fe+CuSO4=FeSO4+Cu
(3)Fe2O3+3CO 2Fe+3CO2
15.【答案】(1)50
(2)解:设100g炉具清洁剂中NaOH的质量为x,
解得,x=4g
该炉具清洁剂中氢氧化钠的质量分数是:,
答:该炉具清洁剂中氢氧化钠的质量分数为4%。
16.【答案】(1)将集气瓶中的氧气全部消耗完
(2)下层蜡烛火焰先熄灭,上层蜡烛火焰后熄灭
(3)偏小
(4)产生氢气逸散到空气中去了
17.【答案】(1)2KMnO4 K2MnO4+MnO2+O2↑
(2)试管口未放一团棉花
(3)B;D
(4)高锰酸钾是适于制取氧气的物质;反应条件
(5)解:①由质量守恒定律可知产生氧气的质量为10g﹣9.36g=0.64g;
②设参加反应的KMnO4质量为x,
2KMnO4 K2MnO4+MnO2+ O2↑
316 32
x 0.64g
= ,解得x=6.32g,
因此剩余KMnO4质量为10g﹣6.32g=3.68g
∵6.32g<10g
∴KMnO4未完全反应
剩余的KMnO4质量=10g﹣6.32g=3.68g
答:①产生氧气的质量为0.64g;②剩余物中高锰酸钾的质量是3.68g
18.【答案】(1)NaCl
(2)Na+
(3)N2;D
19.【答案】(1)2NH3+3CuO 3Cu+3H2O+N2
(2)O2
(3)4NH3+6NO 5N2+6H2O
一、单选题
1.我国使用“长征3号甲”运载火箭的动力由高氯酸铵(NH4ClO4)分解所提供,反应方程式为2NH4ClO4 N2↑+Cl2↑+4X↑+2O2↑,则X的化学式为( )
A.NH3 B.H2O C.H2 D.HCl
2.发射“婵娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式为C2H8N2 + 2N2O4 = 3X + 2CO2 + 4H2O ,则X的化学式为( )
A.H2 B.O2 C.N2 D.CO
3.科学家发现在特殊条件下水能表现出有趣的结构和性质。例如,在一定条件下给水施加弱电场,能使水在常温常压下结成冰(结构见图)。下列说法正确的是( )
A.由于分子的运动性,在弱电场下,水分子的排列不可能从无序转变为有序
B.水结成“热冰”的过程中,水分子的体积发生变化
C.上述变化过程中分子之间的间隔没有发生变化
D.利用该性质,人们可能在常温常压下建成溜冰场
4.“84消毒剂”是以次氯酸钠为主要有效成分的消毒液。制备次氯酸钠的原理可表示为:2NaOH + Cl2 = NaClO+X+H2O,则X的化学式是( )
A.Na2O B.NaCl C.NaH D.NaClO3
5.根据化学方程式不能获得的信息是( )
A.该反应中的反应物和生成物 B.化学反应的快慢
C.反应发生所需要的条件 D.参加反应的各粒子的相对质量
6.工业上利用下列反应制取金属Hg:4HgS+4CaO=4Hg+3X+CaSO4。该反应中X的化学式为()
A.CaS B.SO2 C.SO3 D.CaSO3
7.铜和盐酸、稀硫酸不发生反应,但与稀硝酸能发生如下反应: ,可推测X的化学式是( )
A.N2O3 B.NO C.NO2 D.N2O
8.一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 甲 乙 丙 丁
反应前质量/g 1 30 17 2
反应后质量/g m 39 0 10
关于此反应,下列认识不正确的是( )
A.表中m为1 B.甲可能是该反应的催化剂
C.该反应是化合反应 D.反应中乙、丁的质量比为9:8
9.下列关于质量守恒定律的说法错误的是( )
A.木炭在空气中燃烧成灰,虽然固体质量减少,但这并不违背质量守恒定律。
B.煤块燃烧后,变成质量小得多的煤灰,说明煤燃烧的反应不符合质量守恒定律。
C.根据质量守恒定律,镁条在空气中燃烧生成氧化镁的质量一定大于反应的镁条质量。
D.化学反应的实质是原子的重新组合,不存在原子的得失,因此化学反应前后质量守恒。
10.宏观辨识与微观探析是化学学科的核心素养之一。对下列事实的微观解释不正确的是( )
A.金刚石和石墨的物理性质差异大——碳原子的排列方式不同
B.夏天汽车轮胎爆炸——轮胎内气体分子变大
C.化学反应前后各物质质量总和不变——反应前后原子的种类、数目、质量均不改变
D.氯化钠溶液能导电——溶液中存在可自由移动的离子
11.常温下,向一定质量的CaO和CaCO3的固体混合物中,加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应,得到不饱和溶液甲。向溶液甲中滴加溶质质量分数为10%的Na2CO3溶液,至恰好完全反应,过滤,得到溶液乙和沉淀丙。下列有关说法中,错误的是( )
A.固体混合物中钙元素的质量为4g
B.反应过程中生成的CO2质量为4.4g
C.加入碳酸钠溶液的质量为106g
D.溶液乙中只含一种溶质
12.实验室有一包含杂质的碳酸氢钠样品100g(杂质不含钠元素,受热不变化),其中钠元素质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为87.6g,则分解的碳酸氢钠占原碳酸氢钠的质量分数为(2NaHCO3 Na2CO3 + H2O + CO2↑)( )
A.33.6% B.40%
C.47.3% D.60%
二、填空题
13.空气是重要的自然资源。
(1)人类每时每刻都离不开空气,因为空气中的氧气具有的性质是 。
(2)下列关于空气的说法正确的是______。
A.空气由空气分子构成
B.N2、O2等均匀地混合
C.N2、O2不再保持各自的化学性质
(3)同温同压下,气体的体积比等于分子个数比。若空气中其它成分忽略不计,下图可表示空气微观模型的是 。
14.写出下列反应的化学方程式:
(1)氯化钡溶液和硫酸钠溶液 ;
(2)“曾青(CuSO4)得铁化为铜” ;
(3)高炉炼铁中,一氧化碳与氧化铁在高温下反应 。
三、计算题
15.某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当恰好中和时,消耗的稀硫酸的质量为 g。
(2)计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
四、实验探究题
16.下列是初中化学常见的实验。请回答下列问题。
(1)图A实验中,红磷必须足量的原因是 。
(2)图B实验中可观察到的现象是 。
(3)配制一定质量分数的氯化钠溶液,按图C所示量取溶剂,其它操作均正确,最终导致配制的溶液溶质的质量分数 (填“偏大”、“偏小”或“不变”)。
(4)图D所示实验不能验证质量守恒定律的原因是 。
17.使用如图所示装置制取氧气.
(1)写出加热高锰酸钾制氧气的化学方程式: :
(2)指出右图装置中一个明显的不足之处: ;
(3)氧气收集完成后,测得其纯度明显偏低,原因可能是: (填字母、可多选);
A.高锰酸钾中混入了二氧化锰
B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水
D.未见气泡连续均匀冒出时就开始收集
(4)在研究“适于制取氧气的物质及其反应条件”的过程中,某同学完成了下表所示系列实验:
序号 实验 能否生成氧气
A 加热高锰酸钾 能
B 加热二氧化硅 不能
C 加热氯化钠 不能
D 加热水 不能
E 电解水 能
①根据实验A、B、C,可以得出的结论是:在一定条件下, ;
②根据实验D、E,可以得出的结论是: 是影响物质能否反应产生氧气的重要因素;
(5)将10g高锰酸钾加热一段时间后,称得剩余固体的质量为9.36g.试计算:
①产生氧气的质量;
②剩余高锰酸钾的质量.
五、综合题
18.我国曾发生多次将工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件.
(1)食盐主要成分的化学式为 ;
(2)亚硝酸钠和食盐中都含有的离子的化学符号是 ;
(3)亚硝酸钠与氯化铵共热能发生反应,其化学方程式为:NaNO2+NH4Cl NaCl+X↑+2H2O,则X的化学式为 ,该化学方程式里的含氮物质中,氮元素未表现出的化合价为 价(填序号)
A.+3 B.﹣3 C.0 D.+5.
19.按题目提示写出有关的化学方程式和部分物质的化学式。
(1)将黑色氧化铜粉末置于试管中加热;通入氨气,则生成红色的铜、水和一种气体单质。该反应的化学方程式是: ;
(2)在细菌作用下,用氨处理含甲醇的工业废水,使其变为N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B=3N2
↑+5CO2 ↑+19H2O,其中B物质的化学式是 ;
(3)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,写出该反应的化学方程式: 。
答案解析部分
1.【答案】B
2.【答案】C
3.【答案】D
4.【答案】B
5.【答案】B
6.【答案】A
7.【答案】B
8.【答案】C
9.【答案】B
10.【答案】B
11.【答案】B
12.【答案】B
13.【答案】(1)供给呼吸
(2)B
(3)C
14.【答案】(1)BaCl2+Na2SO4=BaSO4↓+2NaCl
(2)Fe+CuSO4=FeSO4+Cu
(3)Fe2O3+3CO 2Fe+3CO2
15.【答案】(1)50
(2)解:设100g炉具清洁剂中NaOH的质量为x,
解得,x=4g
该炉具清洁剂中氢氧化钠的质量分数是:,
答:该炉具清洁剂中氢氧化钠的质量分数为4%。
16.【答案】(1)将集气瓶中的氧气全部消耗完
(2)下层蜡烛火焰先熄灭,上层蜡烛火焰后熄灭
(3)偏小
(4)产生氢气逸散到空气中去了
17.【答案】(1)2KMnO4 K2MnO4+MnO2+O2↑
(2)试管口未放一团棉花
(3)B;D
(4)高锰酸钾是适于制取氧气的物质;反应条件
(5)解:①由质量守恒定律可知产生氧气的质量为10g﹣9.36g=0.64g;
②设参加反应的KMnO4质量为x,
2KMnO4 K2MnO4+MnO2+ O2↑
316 32
x 0.64g
= ,解得x=6.32g,
因此剩余KMnO4质量为10g﹣6.32g=3.68g
∵6.32g<10g
∴KMnO4未完全反应
剩余的KMnO4质量=10g﹣6.32g=3.68g
答:①产生氧气的质量为0.64g;②剩余物中高锰酸钾的质量是3.68g
18.【答案】(1)NaCl
(2)Na+
(3)N2;D
19.【答案】(1)2NH3+3CuO 3Cu+3H2O+N2
(2)O2
(3)4NH3+6NO 5N2+6H2O
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
