5.3利用化学方程式的简单计算课时练习(含答案)2023-2024学年九年级化学人教版上册
文档属性
| 名称 | 5.3利用化学方程式的简单计算课时练习(含答案)2023-2024学年九年级化学人教版上册 |  | |
| 格式 | docx | ||
| 文件大小 | 270.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 13:36:29 | ||
图片预览


文档简介
5.3利用化学方程式的简单计算课时练习---2023-2024学年九年级化学人教版上册
一、单选题
1.某反应2A+3B=2C+4D中,已知3.2gA跟4.8gB恰好完全反应生成4.4gC。又知D的相对分子质量为18,则A的相对分子质量为( )
A.32 B.48 C.64 D.96
2.将13.8gK2CO3样品中加入一定量的稀盐酸,恰好完全反应,得到49.4 g的溶液,则稀盐酸中溶质的质量分数为( )
A.9.1% B.18.3% C.27.5% D.35.6%
3.在一定质量的氯化钠溶液中加入硝酸银溶液至氯化钠反应完全,产生的沉淀经过过滤、洗涤、干燥、称量,沉淀质量恰好等于原氯化钠溶液的质量的二分之一.则原氯化钠溶液溶质的质量分数约为( )
A.10% B.20% C.30% D.40%
4.已知镁和铝的相对原子质量之比为8:9,若镁和铝分别与足量盐酸反应,生成氢气的质量相等,则参加反应的镁和铝的质量比为( )
A.3:2 B.4:3 C.1:1 D.1:2
5.下列图象能正确反映相应实验的是()
①向氢氧化钠溶液中逐滴加入稀盐酸
②向一定量的碳酸钙固体中逐滴加入稀盐酸至过量
③一定温度时,将饱和的氯化钠溶液恒温蒸发至有晶体析出
④将足量的金属镁片和锌片分别与等质量的相同质量分数的稀硫酸混合
A.②① B.③④ C.②④ D.①③
6.向盛有FeCl3和HCl混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量,溶质质量和溶剂质量随NaOH溶液质量的变化关系如图所示,下列说法正确的是( )
A.丙代表沉淀质量
B.Q点所示溶液中溶质为NaCl
C.原溶液中FeCl3和HCl质量相等
D.P点之后发生反应:
7.把20.4g铜和铁的混合粉末放入烧杯中,先加入100g8%硫酸铜溶液,充分反应后,再加入300g9.8%的稀硫酸,完全反应,过滤、洗涤、干燥得9.6g固体。下列判断错误的是( )
A.反应过程中共生成0.4gH2
B.反应中共消耗的硫酸溶液为200g
C.原混合物中Cu的质量为6.4g
D.最后得到的9.6g固体中一定含有铜,可能含有铁
8.下列图象正确反映对应变化关系的是( )
A.用等量等浓度的过氧化氢溶液分别制取氧气 B.等质量大小相同的锌片和铁片分别与足量等浓度的稀盐酸反应 C.红磷在密闭容器中燃烧 D.水通电,氢气和氧气的质量比为2:1
A.A B.B C.C D.D
9.在化学反应3A+B=2C+D中,若30gA和10gB恰好完全反应,生成5gD,且已知C的相对分子质量为70,则A的相对分子质量是( )
A.20 B.26 C.40 D.60
10.现有氧化镁、氢氧化镁和硫酸镁的混合物10g,加入100g9.8%的稀硫酸恰好完全反应,反应结束后蒸发,所得硫酸镁的质量可能是( )
A.12g B.17g C.22g D.15g
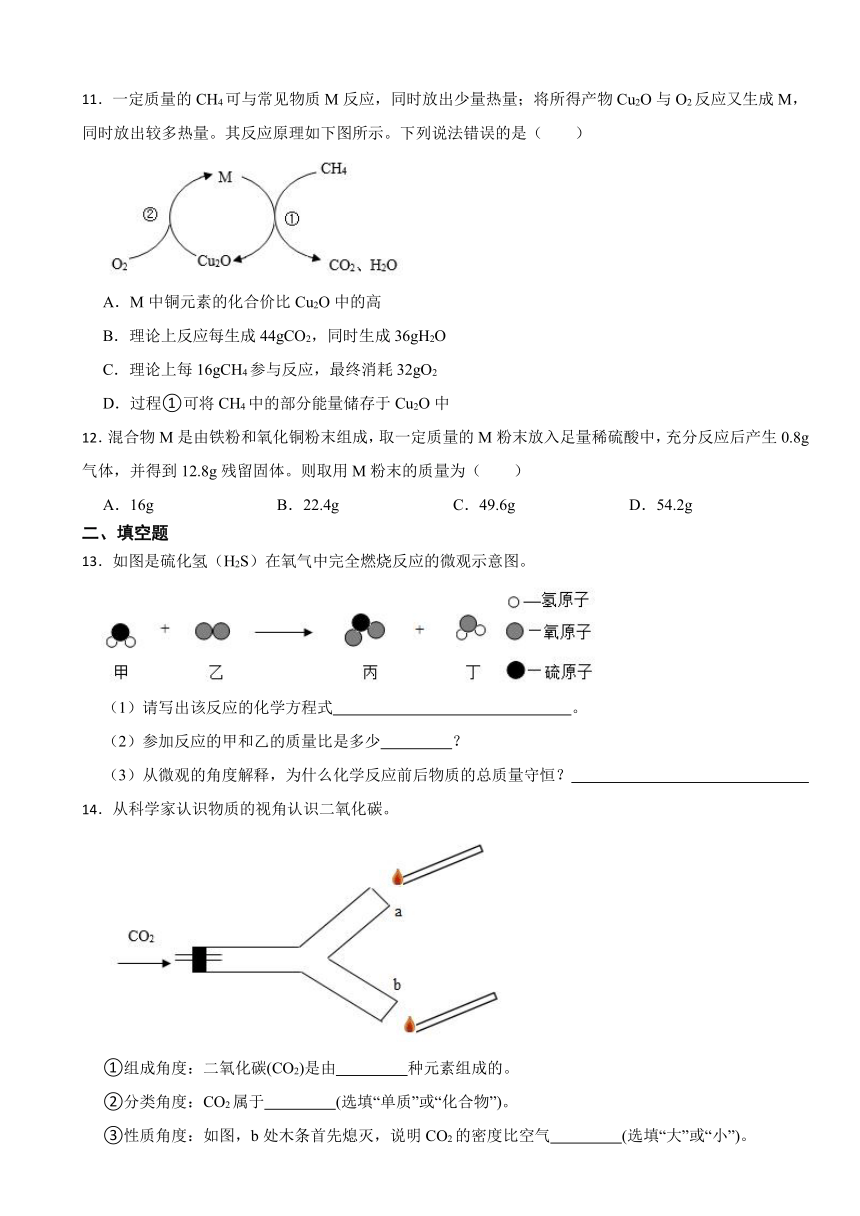
11.一定质量的CH4可与常见物质M反应,同时放出少量热量;将所得产物Cu2O与O2反应又生成M,同时放出较多热量。其反应原理如下图所示。下列说法错误的是( )
A.M中铜元素的化合价比Cu2O中的高
B.理论上反应每生成44gCO2,同时生成36gH2O
C.理论上每16gCH4参与反应,最终消耗32gO2
D.过程①可将CH4中的部分能量储存于Cu2O中
12.混合物M是由铁粉和氧化铜粉末组成,取一定质量的M粉末放入足量稀硫酸中,充分反应后产生0.8g气体,并得到12.8g残留固体。则取用M粉末的质量为( )
A.16g B.22.4g C.49.6g D.54.2g
二、填空题
13.如图是硫化氢(H2S)在氧气中完全燃烧反应的微观示意图。
(1)请写出该反应的化学方程式 。
(2)参加反应的甲和乙的质量比是多少 ?
(3)从微观的角度解释,为什么化学反应前后物质的总质量守恒?
14.从科学家认识物质的视角认识二氧化碳。
①组成角度:二氧化碳(CO2)是由 种元素组成的。
②分类角度:CO2属于 (选填“单质”或“化合物”)。
③性质角度:如图,b处木条首先熄灭,说明CO2的密度比空气 (选填“大”或“小”)。
④应用角度:用CO2生成甲醇,反应的微观示意图为:
参加反应的两种分子个数比为 。
⑤制取角度:实验室用含0.2molCaCO3的大理石和足量稀盐酸反应,可生成CO2 mol。(根据化学方程式列式计算)
三、计算题
15.碳中和是指将排放二氧化碳和吸收二氧化碳达到一种相对平衡。根据下列要求进行有关计算:
(1)二氧化碳的相对分子质量是 。
(2)在二氧化碳中碳元素和氧元素的质量比是 。
(3)现有一氧化碳和二氧化碳的混合气体10g,通入足量的澄清石灰水,得到白色沉淀10g,则混合气体中一氧化碳的质量是多少克?
四、实验探究题
16.某兴趣小组利用下列实验装置,开展O2、CO2的实验室制取和有关性质的研究。
(1)写出A、C装置编号仪器的名称: ① ;② 。
(2)甲同学用稀盐酸和大理石在B装置中反应,该反应的化学方程式为 ,观察到试管中紫色石蕊试液 (填现象)。
(3)乙同学要用KMnO4固体来制取O2,应选用上图中的 装置(填字母),该反应的化学方程式为 ;在完成“氧气的制取与性质”的基础实验后,他还想进行蜡烛在不同浓度的氧气中燃烧情况的探究,现要较简便地获得两瓶不同浓度的氧气,应选择收集氧气的方法是 。
(4)把干燥纯净的KClO3和MnO2的混合物3.45g装入大试管中,加热制取O2,待反应完全后,将试管冷却,得到2.49g固体物质。试计算混合物中MnO2的质量。
17.
(1)实验室部分装置如图所示,请回答下列问题。
选用试剂 发生装置 收集装置
H2O2溶液、MnO2
KMnO4
(2)如果用MnO2与浓H2SO4加热制备O2,可选用的发生装置是 (填字母)。
(3)选用F装置收集气体时,下列实验操作正确的是 (填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(4)实验室用KMnO4制备O2的化学方程式是 。若需制备3.2g O2,至少需要消耗 g KMnO4。(已知KMnO4的相对分子质量为158)
五、综合题
18.硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如下图所示。请回答下列问题:
(1)B2O3中B元素的化合价为 。
(2)为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是 ;回收副产物Mg(OH)2可制得流程 的反应物。
(3)H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为 。
(4)根据流程③的化学反应方程式: ,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
答案解析部分
1.【答案】A
2.【答案】B
3.【答案】B
4.【答案】B
5.【答案】C
6.【答案】B
7.【答案】D
8.【答案】B
9.【答案】C
10.【答案】B
11.【答案】C
12.【答案】C
13.【答案】(1)
(2)17:24
(3)在化学反应前后,原子的种类、质量和个数都不变,所以反应前后物质的总质量相等
14.【答案】两;化合物;大;1∶3;解:设生成二氧化碳的物质的量为x。 x=0.2mol。 答:可生成CO20.2mol。
15.【答案】(1)44
(2)
(3)解:设混合气体中二氧化碳的质量是
解得
混合气体中一氧化碳的质量是
答:混合气体中一氧化碳的质量是5.6g
16.【答案】(1)酒精灯;长颈漏斗
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;变红
(3)A;2KMnO4 K2MnO4+MnO2+O2↑;排水法
(4)1g
17.【答案】(1)B;D(或F)
(2)C
(3)①②③
(4)2KMnO4 K2MnO4+MnO2+O2↑;31.6
18.【答案】(1)+3
(2)将硼镁矿石粉碎;③
(3)
(4)解:设理论上制备1.1吨的硼,需消耗镁的质量为x
x=3.6t
答:理论上制备1.1吨的硼,需消耗镁3.6吨。
一、单选题
1.某反应2A+3B=2C+4D中,已知3.2gA跟4.8gB恰好完全反应生成4.4gC。又知D的相对分子质量为18,则A的相对分子质量为( )
A.32 B.48 C.64 D.96
2.将13.8gK2CO3样品中加入一定量的稀盐酸,恰好完全反应,得到49.4 g的溶液,则稀盐酸中溶质的质量分数为( )
A.9.1% B.18.3% C.27.5% D.35.6%
3.在一定质量的氯化钠溶液中加入硝酸银溶液至氯化钠反应完全,产生的沉淀经过过滤、洗涤、干燥、称量,沉淀质量恰好等于原氯化钠溶液的质量的二分之一.则原氯化钠溶液溶质的质量分数约为( )
A.10% B.20% C.30% D.40%
4.已知镁和铝的相对原子质量之比为8:9,若镁和铝分别与足量盐酸反应,生成氢气的质量相等,则参加反应的镁和铝的质量比为( )
A.3:2 B.4:3 C.1:1 D.1:2
5.下列图象能正确反映相应实验的是()
①向氢氧化钠溶液中逐滴加入稀盐酸
②向一定量的碳酸钙固体中逐滴加入稀盐酸至过量
③一定温度时,将饱和的氯化钠溶液恒温蒸发至有晶体析出
④将足量的金属镁片和锌片分别与等质量的相同质量分数的稀硫酸混合
A.②① B.③④ C.②④ D.①③
6.向盛有FeCl3和HCl混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量,溶质质量和溶剂质量随NaOH溶液质量的变化关系如图所示,下列说法正确的是( )
A.丙代表沉淀质量
B.Q点所示溶液中溶质为NaCl
C.原溶液中FeCl3和HCl质量相等
D.P点之后发生反应:
7.把20.4g铜和铁的混合粉末放入烧杯中,先加入100g8%硫酸铜溶液,充分反应后,再加入300g9.8%的稀硫酸,完全反应,过滤、洗涤、干燥得9.6g固体。下列判断错误的是( )
A.反应过程中共生成0.4gH2
B.反应中共消耗的硫酸溶液为200g
C.原混合物中Cu的质量为6.4g
D.最后得到的9.6g固体中一定含有铜,可能含有铁
8.下列图象正确反映对应变化关系的是( )
A.用等量等浓度的过氧化氢溶液分别制取氧气 B.等质量大小相同的锌片和铁片分别与足量等浓度的稀盐酸反应 C.红磷在密闭容器中燃烧 D.水通电,氢气和氧气的质量比为2:1
A.A B.B C.C D.D
9.在化学反应3A+B=2C+D中,若30gA和10gB恰好完全反应,生成5gD,且已知C的相对分子质量为70,则A的相对分子质量是( )
A.20 B.26 C.40 D.60
10.现有氧化镁、氢氧化镁和硫酸镁的混合物10g,加入100g9.8%的稀硫酸恰好完全反应,反应结束后蒸发,所得硫酸镁的质量可能是( )
A.12g B.17g C.22g D.15g
11.一定质量的CH4可与常见物质M反应,同时放出少量热量;将所得产物Cu2O与O2反应又生成M,同时放出较多热量。其反应原理如下图所示。下列说法错误的是( )
A.M中铜元素的化合价比Cu2O中的高
B.理论上反应每生成44gCO2,同时生成36gH2O
C.理论上每16gCH4参与反应,最终消耗32gO2
D.过程①可将CH4中的部分能量储存于Cu2O中
12.混合物M是由铁粉和氧化铜粉末组成,取一定质量的M粉末放入足量稀硫酸中,充分反应后产生0.8g气体,并得到12.8g残留固体。则取用M粉末的质量为( )
A.16g B.22.4g C.49.6g D.54.2g
二、填空题
13.如图是硫化氢(H2S)在氧气中完全燃烧反应的微观示意图。
(1)请写出该反应的化学方程式 。
(2)参加反应的甲和乙的质量比是多少 ?
(3)从微观的角度解释,为什么化学反应前后物质的总质量守恒?
14.从科学家认识物质的视角认识二氧化碳。
①组成角度:二氧化碳(CO2)是由 种元素组成的。
②分类角度:CO2属于 (选填“单质”或“化合物”)。
③性质角度:如图,b处木条首先熄灭,说明CO2的密度比空气 (选填“大”或“小”)。
④应用角度:用CO2生成甲醇,反应的微观示意图为:
参加反应的两种分子个数比为 。
⑤制取角度:实验室用含0.2molCaCO3的大理石和足量稀盐酸反应,可生成CO2 mol。(根据化学方程式列式计算)
三、计算题
15.碳中和是指将排放二氧化碳和吸收二氧化碳达到一种相对平衡。根据下列要求进行有关计算:
(1)二氧化碳的相对分子质量是 。
(2)在二氧化碳中碳元素和氧元素的质量比是 。
(3)现有一氧化碳和二氧化碳的混合气体10g,通入足量的澄清石灰水,得到白色沉淀10g,则混合气体中一氧化碳的质量是多少克?
四、实验探究题
16.某兴趣小组利用下列实验装置,开展O2、CO2的实验室制取和有关性质的研究。
(1)写出A、C装置编号仪器的名称: ① ;② 。
(2)甲同学用稀盐酸和大理石在B装置中反应,该反应的化学方程式为 ,观察到试管中紫色石蕊试液 (填现象)。
(3)乙同学要用KMnO4固体来制取O2,应选用上图中的 装置(填字母),该反应的化学方程式为 ;在完成“氧气的制取与性质”的基础实验后,他还想进行蜡烛在不同浓度的氧气中燃烧情况的探究,现要较简便地获得两瓶不同浓度的氧气,应选择收集氧气的方法是 。
(4)把干燥纯净的KClO3和MnO2的混合物3.45g装入大试管中,加热制取O2,待反应完全后,将试管冷却,得到2.49g固体物质。试计算混合物中MnO2的质量。
17.
(1)实验室部分装置如图所示,请回答下列问题。
选用试剂 发生装置 收集装置
H2O2溶液、MnO2
KMnO4
(2)如果用MnO2与浓H2SO4加热制备O2,可选用的发生装置是 (填字母)。
(3)选用F装置收集气体时,下列实验操作正确的是 (填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(4)实验室用KMnO4制备O2的化学方程式是 。若需制备3.2g O2,至少需要消耗 g KMnO4。(已知KMnO4的相对分子质量为158)
五、综合题
18.硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如下图所示。请回答下列问题:
(1)B2O3中B元素的化合价为 。
(2)为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是 ;回收副产物Mg(OH)2可制得流程 的反应物。
(3)H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为 。
(4)根据流程③的化学反应方程式: ,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
答案解析部分
1.【答案】A
2.【答案】B
3.【答案】B
4.【答案】B
5.【答案】C
6.【答案】B
7.【答案】D
8.【答案】B
9.【答案】C
10.【答案】B
11.【答案】C
12.【答案】C
13.【答案】(1)
(2)17:24
(3)在化学反应前后,原子的种类、质量和个数都不变,所以反应前后物质的总质量相等
14.【答案】两;化合物;大;1∶3;解:设生成二氧化碳的物质的量为x。 x=0.2mol。 答:可生成CO20.2mol。
15.【答案】(1)44
(2)
(3)解:设混合气体中二氧化碳的质量是
解得
混合气体中一氧化碳的质量是
答:混合气体中一氧化碳的质量是5.6g
16.【答案】(1)酒精灯;长颈漏斗
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;变红
(3)A;2KMnO4 K2MnO4+MnO2+O2↑;排水法
(4)1g
17.【答案】(1)B;D(或F)
(2)C
(3)①②③
(4)2KMnO4 K2MnO4+MnO2+O2↑;31.6
18.【答案】(1)+3
(2)将硼镁矿石粉碎;③
(3)
(4)解:设理论上制备1.1吨的硼,需消耗镁的质量为x
x=3.6t
答:理论上制备1.1吨的硼,需消耗镁3.6吨。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
