1.1 物质及其反应的分类(5) 课件(共36张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 1.1 物质及其反应的分类(5) 课件(共36张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 14:15:03 | ||
图片预览










文档简介
(共36张PPT)
第一单元 物质及其反应的分类
专题1 物质的分类及计量
大超市里有成千上万种商品,为什么我们能够迅速地挑选出出所需要的商品 这是因为人们在将这些物品陈列到书架或货架之前,已经事先对它们进行了分类处理。
问题导引
生鲜区
饮料区
熟食区
面对丰富多彩、变化无穷的物质世界,化学家是怎样研究物质组成、结构和变化的呢
1.从宏观和微观的角度认识物质的多样性,根据物质的组成和性质可以对物质进行分类。
2.认识分类对化学研究的重要性,形成学习化学的分类观。
3.从物质类别的角度认识同类物质具有相似性,一定条件下物质可以相互转化。通过研究各类物质之间的反应关系,初步认识研究物质通性的思路和方法。
学习目标
1.物质的分类。
(1)根据物质的存在状态,将物质分为 、 和 。
(2)根据物质的导电性,将物质分为 (如金属)、 (如Se、Ge、Si)和
(如塑料)。
(3)根据物质在水中的溶解性,将物质分为 、 和
。
一、物质的分类
新知导学
气态物质
液态物质
固态物质
导体
半导体
绝缘体
可溶性物质
微溶性物质
难溶性物质
(4)根据物质的组成和性质。
金属单质
非金属单质
酸
无机化合物
碱
盐
氧化物
新知导学
2.氧化物、酸、碱的分类。
(1)从化学性质上看,CaO、Na2O等氧化物能与 反应生成 ,这类氧
化物称为碱性氧化物。CaO与盐酸反应的化学方程式为 。
CO2、SO2等氧化物能与 反应生成 ,这类氧化物称为酸性氧化物。
CO2与Ca(OH)2溶液反应的化学方程式为 。
酸
盐和水
CaO+2HCl══CaCl2+H2O
碱
盐和水
CO2+Ca(OH)2══CaCO3↓+H2O
新知导学
(2)从组成上看, 等不含氧元素的酸,称为无氧酸;而 和 等
含氧元素的酸,称为含氧酸。
(3)从溶解性上看, 、 等碱可溶于水,称为可溶性碱; 和
等碱难溶于水,称为难溶性碱或难溶性氢氧化物。
HCl
H2SO4
HNO3
NaOH
KOH
Cu(OH)2
Fe(OH)3
新知导学
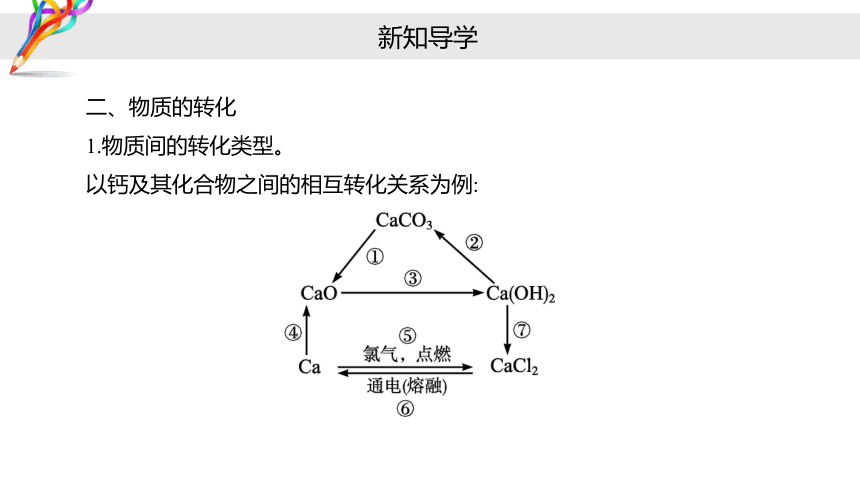
二、物质的转化
1.物质间的转化类型。
以钙及其化合物之间的相互转化关系为例:
新知导学
转化类型 化学方程式
某些盐→碱性氧化物+酸性氧化物
酸性氧化物+碱→盐+水
碱性氧化物→碱
②CO2+Ca(OH)2 === CaCO3↓+H2O
③CaO+H2O === Ca(OH)2
①CaCO3 === CaO+CO2↑
高温
新知导学
Ca(OH)2+2HCl === CaCl2+2H2O
新知导学
2. 物质转化的条件
光照
物质的转化 转化的条件
置换反应 通常活动性 的单质置换活动性 的单质
复分解反应 通常有 析出、 放出或有 等物质生成
强
较弱
沉淀
气体
水
新知导学
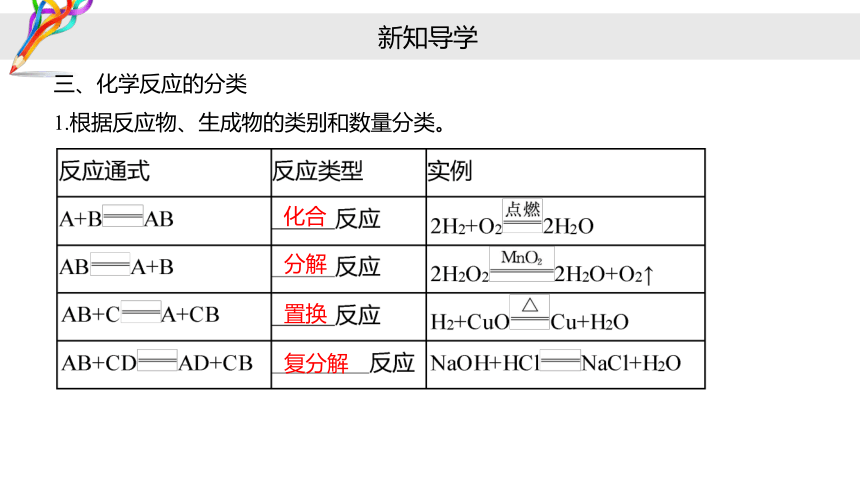
三、化学反应的分类
1.根据反应物、生成物的类别和数量分类。
化合
分解
置换
复分解
新知导学
2. 根据化学反应中元素的化合价是否发生变化。
氧化还原
非氧化还原
新知导学
对物质及其变化进行分类时的首要问题是什么
2. 所有的金属都能与稀盐酸(或稀硫酸)反应生成氢气吗
提示:只有在金属活动性顺序表中氢前面的金属才能与稀盐酸(或稀硫酸)反应生
成氢气和盐。
提示:首先要固定分类标准。根据不同的标准可以对化学物质和化学反应进行
不同的分类,因此,没有固定的分类标准,就不会有正确的分类。
思考:
新知导学
效果自测:
1.判断正误,正确的画“√”,错误的画“×”。
(1)Fe2O3与HNO3均属于氧化物。( )
(2)Na2CO3俗称纯碱,它属于碱。( )
(3)只含有一种元素的物质一定属于纯净物。( )
(4)凡是生成盐和水的反应都属于中和反应。( )
×
×
×
×
(5)2CO+O2 2CO2既是化合反应,又是氧化还原反应。( )
(6)置换反应均是氧化还原反应。( )
(7)金属都可以与稀盐酸发生置换反应。( )
√
√
×
新知导学
2.(1)写出下列反应的化学方程式,指明所属的基本反应类型。
①煅烧石灰石: , 反应。
②Zn与CuSO4反应: , 反应。
③CuCl2与NaOH反应: , 反应。
④AgNO3与稀盐酸反应: , 反应。
⑤过氧化氢分解制氧气的反应: , 反应。
(2)上述反应中属于氧化还原反应的有 。
新知导学
新知导学
重点探究
一、物质的分类
1.按照不同的标准可以将盐分成哪些类别
提示:(1)按酸碱中和的程度,盐可分为正盐(如Na2CO3)、酸式盐(如NaHCO3)、碱
式盐[如Cu2(OH)2CO3]。
(2)按阳离子不同,盐可分为钠盐(如NaCl)、钾盐(如KCl)、铵盐(如NH4Cl)、铁盐
(如FeCl3)等。
(3)按阴离子不同,盐可分为碳酸盐(如Na2CO3)、硫酸盐(如Na2SO4)、盐酸盐(如
NaCl)、硝酸盐(如NaNO3)等。
(4)根据酸根是否含有氧元素,盐可分为含氧酸盐(如Na2CO3)、无氧酸盐(如NaCl)。
2.单质和化合物的本质区别是什么
提示:根据物质所含元素的种类,把物质分为化合物和单质两大类,它们都属
于纯净物。
单质:同种元素组成的纯净物。单质必须指纯净物,如由氧元素组成的O2和
O3的混合物,不能称之为氧单质。
化合物:不同元素组成的纯净物。
重点探究
归纳提升:
1.元素的存在状态——游离态和化合态。
游离态:某元素以自身形式结合成单质的存在状态,此时元素的化合价为0价。化
合态:某元素与另外的元素之间结合成化合物时的存在状态,此时元素的化合价
呈正价或负价。由上可知,许多元素可以自身组成不同的单质,如氧元素可以自
身组成氧气和臭氧,也可以与其他元素形成化合物,而且相同的元素可以组成不
同的化合物,如氢元素和氧元素可以组成H2O、H2O2,氧元素和碳元素可以组成
CO、CO2等。
重点探究
2.氧化物的分类。
(1)依据性质,氧化物可分为酸性氧化物和碱性氧化物;依据组成,氧化物可分为
金属氧化物和非金属氧化物。
(2)酸性氧化物是与碱反应生成盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7。
②非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物是与酸反应生成盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
②金属氧化物不一定是碱性氧化物,如Mn2O7。
重点探究
典型例题:
【例题1】 下列物质的分类合理的是( )。
A.氧化物:CO2、NO、SO2、H2O、Na2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、NH3·H2O、(NH4)2SO4
D.碱性氧化物:Na2O、CaO、SO2、CuO
A
解析:A中物质均为氧化物;B中的Na2CO3虽然俗名为纯碱,其水溶液呈碱性,但
它属于盐;C中的NH3·H2O为碱;D中的SO2为酸性氧化物。
重点探究
1.含碳化合物之间可以发生如下图反应,请写出各反应的化学方程式并判断其反应
类型。
二、常见物质间的转化关系
重点探究
2.通过1中各物质的转化,你能得出不同类别的物质间有什么关系
3.在上图发生的各反应中,哪些是氧化还原反应 你是依据什么进行判断的 四种基
本反应类型与氧化还原反应有何关系
提示:不同类别的物质,如单质、氧化物、酸、碱和盐都有自己的特性,但它
们之间可以相互发生反应。
提示:反应①②③④属于氧化还原反应。因为在这些反应中,反应前后有元素的化
合价发生变化。氧化还原反应与四种基本反应类型间的关系:
重点探究
(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和有单质生成的分解反应,均属于氧化还原反应。
无单质参与的化合反应、分解反应也可能是氧化还原反应。
(4)图示关系如下图:
重点探究
归纳提升:
1.金属、氧化物、酸、碱和盐的化学通性。
重点探究
重点探究
物质类别 化学通性
酸 酸+指示剂:能使紫色石蕊溶液变红,无色酚酞溶液不变色
酸(非氧化性酸)+活泼金属→ 盐+H2
酸+碱性氧化物→ 盐+水
酸+碱→ 盐+水
酸+盐→ 新盐+新酸
重点探究
物质类别 化学通性
碱 碱+指示剂:能使紫色石蕊溶液变蓝,无色酚酞溶液变红
碱+酸性氧化物→ 盐+水
碱+酸→ 盐+水
碱+盐→ 新盐+新碱
重点探究
物质类别 化学通性
盐 盐+酸→ 新盐+新酸
盐+碱→ 新盐+新碱
盐+盐→ 新盐+新盐
较不活泼金属的盐+较活泼金属→ 较活泼金属的盐+较不活泼金属
重点探究
2.单质、氧化物、酸、碱、盐之间的转化关系。
图示解读:
①金属单质→碱性氧化物,如4Na+O2══2Na2O(氧化还原反应);
②碱性氧化物→碱,如CaO+H2O══Ca(OH)2;
重点探究
③金属单质→盐,如Zn+H2SO4══ZnSO4+H2↑(氧化还原反应);
④碱性氧化物→盐,如CaO+2HCl══CaCl2+H2O;
⑤碱→盐,如Ca(OH)2+2HCl══CaCl2+2H2O;
⑦酸性氧化物→酸,如CO2+H2O══H2CO3;
⑨酸性氧化物→盐,如CO2+2NaOH══Na2CO3+H2O;
⑩酸→盐,如HCl+NaOH══NaCl+H2O。
重点探究
典型例题:
【例题2】 选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,转化关系如图:
重点探究
(1)将图中指定序号的转化用化学方程式表示出来(所写化学方程式不得重复)。
② , ③ ,
④ , ⑤ ,
⑥ , ⑦ 。
(2)上述反应中属于氧化还原反应的有 。
①④
CO2+Ca(OH)2===CaCO3↓+H2O
CaO+2HCl ===CaCl2+H2O
Ca(OH)2+2HCl ===CaCl2+2H2O
CaO+H2O === Ca(OH)2
CO2+H2O === H2CO3
Fe+2HCl ===FeCl2+H2↑
重点探究
课堂小结
Thank You!
第一单元 物质及其反应的分类
专题1 物质的分类及计量
大超市里有成千上万种商品,为什么我们能够迅速地挑选出出所需要的商品 这是因为人们在将这些物品陈列到书架或货架之前,已经事先对它们进行了分类处理。
问题导引
生鲜区
饮料区
熟食区
面对丰富多彩、变化无穷的物质世界,化学家是怎样研究物质组成、结构和变化的呢
1.从宏观和微观的角度认识物质的多样性,根据物质的组成和性质可以对物质进行分类。
2.认识分类对化学研究的重要性,形成学习化学的分类观。
3.从物质类别的角度认识同类物质具有相似性,一定条件下物质可以相互转化。通过研究各类物质之间的反应关系,初步认识研究物质通性的思路和方法。
学习目标
1.物质的分类。
(1)根据物质的存在状态,将物质分为 、 和 。
(2)根据物质的导电性,将物质分为 (如金属)、 (如Se、Ge、Si)和
(如塑料)。
(3)根据物质在水中的溶解性,将物质分为 、 和
。
一、物质的分类
新知导学
气态物质
液态物质
固态物质
导体
半导体
绝缘体
可溶性物质
微溶性物质
难溶性物质
(4)根据物质的组成和性质。
金属单质
非金属单质
酸
无机化合物
碱
盐
氧化物
新知导学
2.氧化物、酸、碱的分类。
(1)从化学性质上看,CaO、Na2O等氧化物能与 反应生成 ,这类氧
化物称为碱性氧化物。CaO与盐酸反应的化学方程式为 。
CO2、SO2等氧化物能与 反应生成 ,这类氧化物称为酸性氧化物。
CO2与Ca(OH)2溶液反应的化学方程式为 。
酸
盐和水
CaO+2HCl══CaCl2+H2O
碱
盐和水
CO2+Ca(OH)2══CaCO3↓+H2O
新知导学
(2)从组成上看, 等不含氧元素的酸,称为无氧酸;而 和 等
含氧元素的酸,称为含氧酸。
(3)从溶解性上看, 、 等碱可溶于水,称为可溶性碱; 和
等碱难溶于水,称为难溶性碱或难溶性氢氧化物。
HCl
H2SO4
HNO3
NaOH
KOH
Cu(OH)2
Fe(OH)3
新知导学
二、物质的转化
1.物质间的转化类型。
以钙及其化合物之间的相互转化关系为例:
新知导学
转化类型 化学方程式
某些盐→碱性氧化物+酸性氧化物
酸性氧化物+碱→盐+水
碱性氧化物→碱
②CO2+Ca(OH)2 === CaCO3↓+H2O
③CaO+H2O === Ca(OH)2
①CaCO3 === CaO+CO2↑
高温
新知导学
Ca(OH)2+2HCl === CaCl2+2H2O
新知导学
2. 物质转化的条件
光照
物质的转化 转化的条件
置换反应 通常活动性 的单质置换活动性 的单质
复分解反应 通常有 析出、 放出或有 等物质生成
强
较弱
沉淀
气体
水
新知导学
三、化学反应的分类
1.根据反应物、生成物的类别和数量分类。
化合
分解
置换
复分解
新知导学
2. 根据化学反应中元素的化合价是否发生变化。
氧化还原
非氧化还原
新知导学
对物质及其变化进行分类时的首要问题是什么
2. 所有的金属都能与稀盐酸(或稀硫酸)反应生成氢气吗
提示:只有在金属活动性顺序表中氢前面的金属才能与稀盐酸(或稀硫酸)反应生
成氢气和盐。
提示:首先要固定分类标准。根据不同的标准可以对化学物质和化学反应进行
不同的分类,因此,没有固定的分类标准,就不会有正确的分类。
思考:
新知导学
效果自测:
1.判断正误,正确的画“√”,错误的画“×”。
(1)Fe2O3与HNO3均属于氧化物。( )
(2)Na2CO3俗称纯碱,它属于碱。( )
(3)只含有一种元素的物质一定属于纯净物。( )
(4)凡是生成盐和水的反应都属于中和反应。( )
×
×
×
×
(5)2CO+O2 2CO2既是化合反应,又是氧化还原反应。( )
(6)置换反应均是氧化还原反应。( )
(7)金属都可以与稀盐酸发生置换反应。( )
√
√
×
新知导学
2.(1)写出下列反应的化学方程式,指明所属的基本反应类型。
①煅烧石灰石: , 反应。
②Zn与CuSO4反应: , 反应。
③CuCl2与NaOH反应: , 反应。
④AgNO3与稀盐酸反应: , 反应。
⑤过氧化氢分解制氧气的反应: , 反应。
(2)上述反应中属于氧化还原反应的有 。
新知导学
新知导学
重点探究
一、物质的分类
1.按照不同的标准可以将盐分成哪些类别
提示:(1)按酸碱中和的程度,盐可分为正盐(如Na2CO3)、酸式盐(如NaHCO3)、碱
式盐[如Cu2(OH)2CO3]。
(2)按阳离子不同,盐可分为钠盐(如NaCl)、钾盐(如KCl)、铵盐(如NH4Cl)、铁盐
(如FeCl3)等。
(3)按阴离子不同,盐可分为碳酸盐(如Na2CO3)、硫酸盐(如Na2SO4)、盐酸盐(如
NaCl)、硝酸盐(如NaNO3)等。
(4)根据酸根是否含有氧元素,盐可分为含氧酸盐(如Na2CO3)、无氧酸盐(如NaCl)。
2.单质和化合物的本质区别是什么
提示:根据物质所含元素的种类,把物质分为化合物和单质两大类,它们都属
于纯净物。
单质:同种元素组成的纯净物。单质必须指纯净物,如由氧元素组成的O2和
O3的混合物,不能称之为氧单质。
化合物:不同元素组成的纯净物。
重点探究
归纳提升:
1.元素的存在状态——游离态和化合态。
游离态:某元素以自身形式结合成单质的存在状态,此时元素的化合价为0价。化
合态:某元素与另外的元素之间结合成化合物时的存在状态,此时元素的化合价
呈正价或负价。由上可知,许多元素可以自身组成不同的单质,如氧元素可以自
身组成氧气和臭氧,也可以与其他元素形成化合物,而且相同的元素可以组成不
同的化合物,如氢元素和氧元素可以组成H2O、H2O2,氧元素和碳元素可以组成
CO、CO2等。
重点探究
2.氧化物的分类。
(1)依据性质,氧化物可分为酸性氧化物和碱性氧化物;依据组成,氧化物可分为
金属氧化物和非金属氧化物。
(2)酸性氧化物是与碱反应生成盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7。
②非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物是与酸反应生成盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
②金属氧化物不一定是碱性氧化物,如Mn2O7。
重点探究
典型例题:
【例题1】 下列物质的分类合理的是( )。
A.氧化物:CO2、NO、SO2、H2O、Na2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、NH3·H2O、(NH4)2SO4
D.碱性氧化物:Na2O、CaO、SO2、CuO
A
解析:A中物质均为氧化物;B中的Na2CO3虽然俗名为纯碱,其水溶液呈碱性,但
它属于盐;C中的NH3·H2O为碱;D中的SO2为酸性氧化物。
重点探究
1.含碳化合物之间可以发生如下图反应,请写出各反应的化学方程式并判断其反应
类型。
二、常见物质间的转化关系
重点探究
2.通过1中各物质的转化,你能得出不同类别的物质间有什么关系
3.在上图发生的各反应中,哪些是氧化还原反应 你是依据什么进行判断的 四种基
本反应类型与氧化还原反应有何关系
提示:不同类别的物质,如单质、氧化物、酸、碱和盐都有自己的特性,但它
们之间可以相互发生反应。
提示:反应①②③④属于氧化还原反应。因为在这些反应中,反应前后有元素的化
合价发生变化。氧化还原反应与四种基本反应类型间的关系:
重点探究
(1)置换反应一定属于氧化还原反应。
(2)复分解反应一定不属于氧化还原反应。
(3)有单质参与的化合反应和有单质生成的分解反应,均属于氧化还原反应。
无单质参与的化合反应、分解反应也可能是氧化还原反应。
(4)图示关系如下图:
重点探究
归纳提升:
1.金属、氧化物、酸、碱和盐的化学通性。
重点探究
重点探究
物质类别 化学通性
酸 酸+指示剂:能使紫色石蕊溶液变红,无色酚酞溶液不变色
酸(非氧化性酸)+活泼金属→ 盐+H2
酸+碱性氧化物→ 盐+水
酸+碱→ 盐+水
酸+盐→ 新盐+新酸
重点探究
物质类别 化学通性
碱 碱+指示剂:能使紫色石蕊溶液变蓝,无色酚酞溶液变红
碱+酸性氧化物→ 盐+水
碱+酸→ 盐+水
碱+盐→ 新盐+新碱
重点探究
物质类别 化学通性
盐 盐+酸→ 新盐+新酸
盐+碱→ 新盐+新碱
盐+盐→ 新盐+新盐
较不活泼金属的盐+较活泼金属→ 较活泼金属的盐+较不活泼金属
重点探究
2.单质、氧化物、酸、碱、盐之间的转化关系。
图示解读:
①金属单质→碱性氧化物,如4Na+O2══2Na2O(氧化还原反应);
②碱性氧化物→碱,如CaO+H2O══Ca(OH)2;
重点探究
③金属单质→盐,如Zn+H2SO4══ZnSO4+H2↑(氧化还原反应);
④碱性氧化物→盐,如CaO+2HCl══CaCl2+H2O;
⑤碱→盐,如Ca(OH)2+2HCl══CaCl2+2H2O;
⑦酸性氧化物→酸,如CO2+H2O══H2CO3;
⑨酸性氧化物→盐,如CO2+2NaOH══Na2CO3+H2O;
⑩酸→盐,如HCl+NaOH══NaCl+H2O。
重点探究
典型例题:
【例题2】 选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,转化关系如图:
重点探究
(1)将图中指定序号的转化用化学方程式表示出来(所写化学方程式不得重复)。
② , ③ ,
④ , ⑤ ,
⑥ , ⑦ 。
(2)上述反应中属于氧化还原反应的有 。
①④
CO2+Ca(OH)2===CaCO3↓+H2O
CaO+2HCl ===CaCl2+H2O
Ca(OH)2+2HCl ===CaCl2+2H2O
CaO+H2O === Ca(OH)2
CO2+H2O === H2CO3
Fe+2HCl ===FeCl2+H2↑
重点探究
课堂小结
Thank You!
