2023—2024学年人教版化学九年级下册第十单元 酸和碱 分层题(含答案)
文档属性
| 名称 | 2023—2024学年人教版化学九年级下册第十单元 酸和碱 分层题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 524.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 14:51:28 | ||
图片预览



文档简介
2023—2024学年人教版化学九年级下册第十单元 酸和碱 分层题附答案
人教版第十单元 酸和碱
一、选择题。(16题)
1、x、y、z三种金属中,只有z能和稀硫酸反应,当把y放入x的盐溶液中,y表面有x析出,则三种金属x、y、z的活动性顺序为( )
A.z﹥y﹥x B.y﹥x﹥z C.z﹥x﹥y D.y﹥z﹥x
2、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
3、下列不是氢氧化钠俗称的是( )
A.火碱 B.烧碱 C.纯碱 D.苛性钠
4、氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者在水溶液中均能解离出一种相同的粒子,这种粒子是( )
A.H+ B.OH- C.H2O D.H
5、合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质,将煤综合利用.仅用合成气为原料不可能得到的物质是( )
A.草酸(HOOCCOOH) B.甲醇(CH3OH)
C.尿素[CO(NH2)2] D.葡萄糖(C6H12O6)
6、下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是( )
A. Fe和CuSO4溶液 B. Zn和稀H2SO4
C. NaOH溶液和稀盐酸 D. 澄清石灰水和CO2
7、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
8、空气是人类宝贵的自然资源,下列有关空气的说法错误的是( )
A. 液氮可用作制冷剂
B. 氧气可用作火箭发射的燃料
C. 氦气可用来填充探空气球
D. 造成空气污染的气体主要有一氧化碳、二氧化氮、二氧化硫
9、下列验证实验不能成功的是( )
A. CO2能与烧碱溶液反应
B. 不同物质的着火点不同
C. 分子在不断运动
D. 质量守恒定律
10、以下物质能使酚酞变红的物质是( )
A.氯化钠 B.食醋 C.碳酸钠 D.盐酸
11、苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强。下列对苯甲酸性质的推测不合理是( )
A.苯甲酸溶液的pH小于7
B.苯甲酸溶液的pH大于7
C.苯甲酸溶液能使紫色石蕊试液变红色
D.苯甲酸溶液不能使无色酚酞试液变色
12、豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草酸钙沉淀等物质。其中发生的反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
13、某物质不含碳元素和氢元素,它不可能是( )
①酸 ②碱 ③盐 ④有机物.
A. ①②④ B. ②③④ C. ①②③ D. ①③④
14、醋酸、柠檬酸等是食品加工中常用的酸,它们在水中都能电离生成( )
A. OH- B. H+ C. Cl- D. SO42-
15、一些食物的近似pH如下:
下列说法中不正确的是( )
A.苹果汁和葡萄汁均显酸性 B.鸡蛋清和牛奶均显碱性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
16、类比推理是化学学习的常用思维方法,现有以下类推结果,其中错误的是 ( )
①酸碱中和反应生成盐和水,生成盐和水的反应一定是中和反应;
②碱的水溶液可使酚酞溶液变红,所以使酚酞溶液变红的溶液一定是碱溶液;
③氧化物中都含有氧元素,所以含有氧元素的化合物一定是氧化物;
④有机物中都含有碳元素,但是含有碳元素的化合物不一定是有机物.
A.只有①② B.只有②③④ C.只有①②③ D.①②③④
二、填空题。
17、将稀盐酸滴入如图所示的盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是 (填字母,下同)。
(2)溶液变为浅绿色的是 ,该溶液中一定含有的阳离子是 。
(3)溶液变为蓝色的是 ,该试管中发生反应的化学方程式为 。
(4)产生气泡的是 。
(5)没有发生化学反应的是 ,理由是 。
18、对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强,常温下,10%的稀硫酸的pH________(填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_______________。
(2)有化学反应发生的方法:加入________、__________或____________(要求各种方法中所选的物质的类别不同)。
19、如图为两种物质在不同温度时的溶解度曲线.请回答:
(1)40℃时,将30g KCl加入到50g水中,充分溶解后所得溶液是________溶液(填写“饱和”或“不饱和”)。
(2)将20℃时KNO3和KCl的两种饱和溶液升温至40℃,则两种溶液的溶质质量分数大小关系是:KNO3________KCl(填写“>”、“<”或“=”)。
20、酸、碱、盐是三类重要物质。
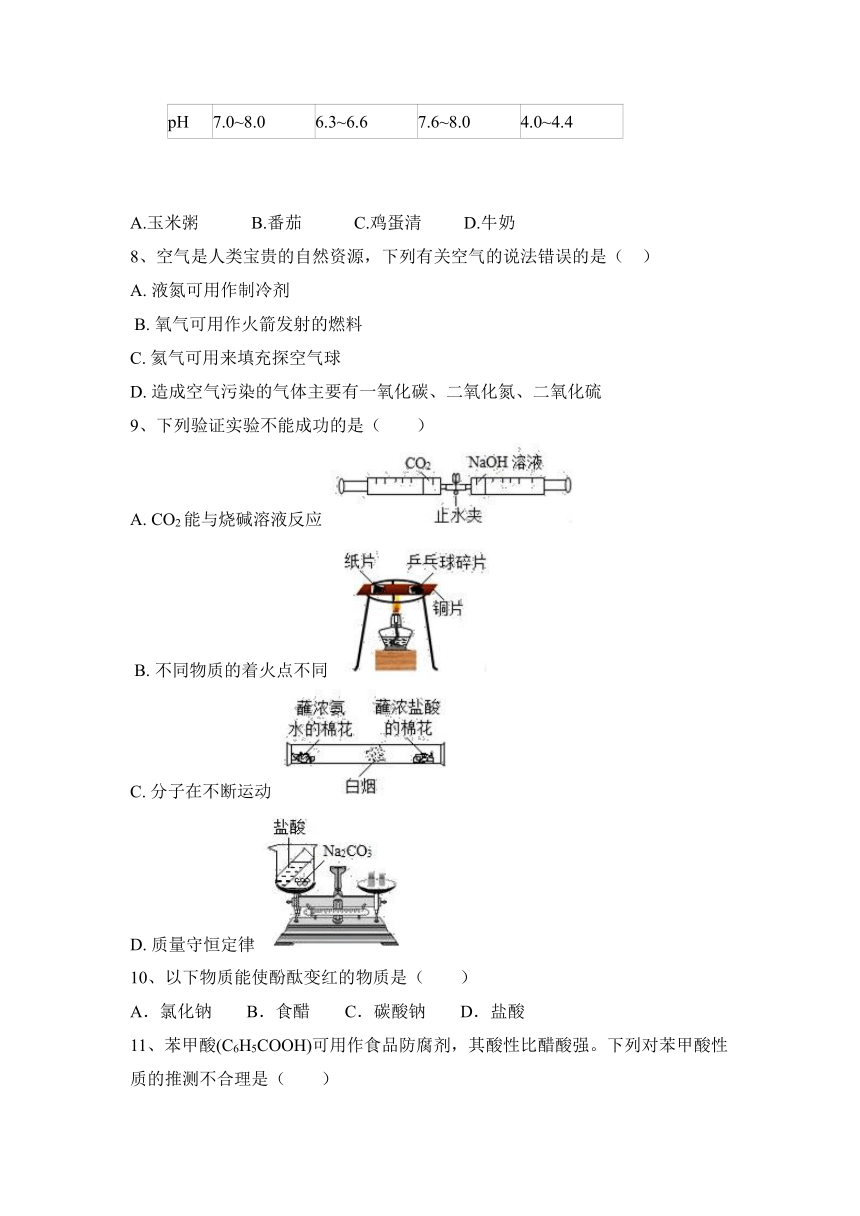
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因_____ 。
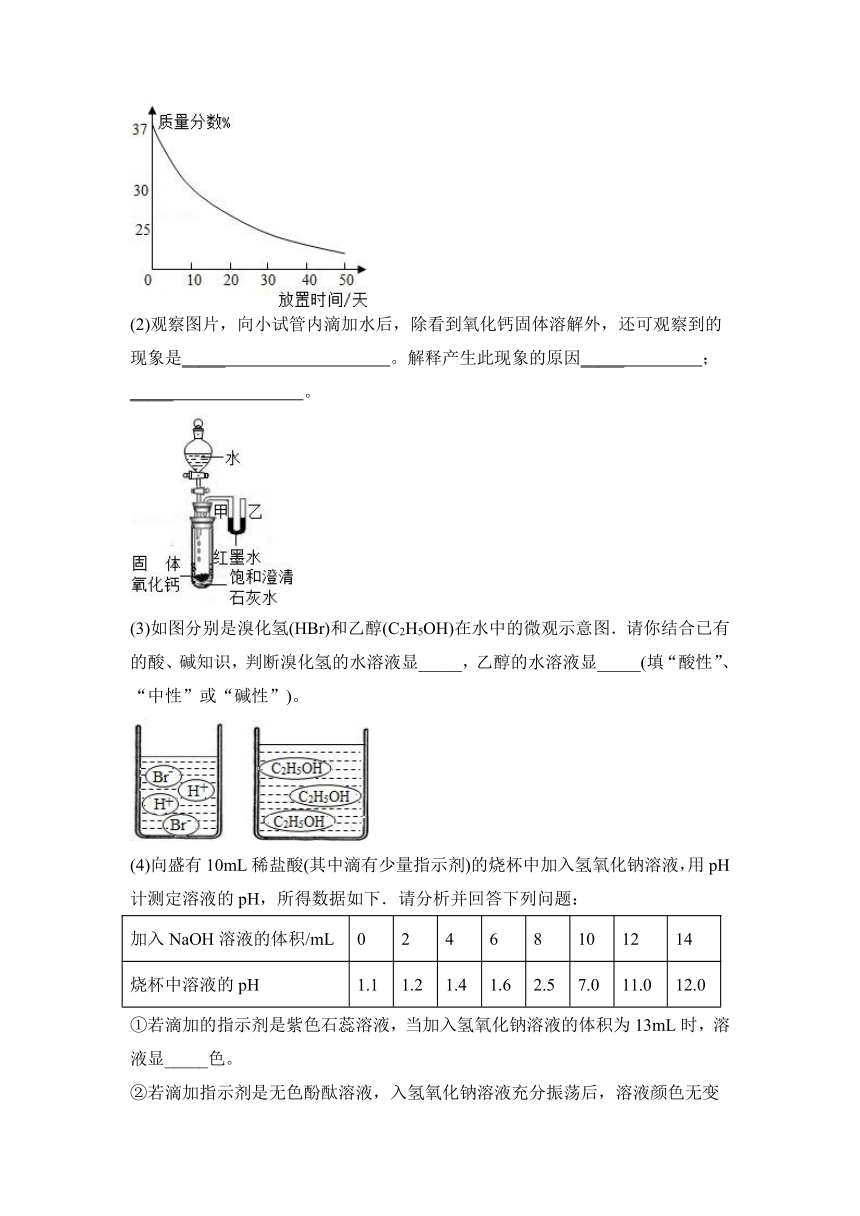
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是_____ 。解释产生此现象的原因_____ ;
_____ 。
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显_____,乙醇的水溶液显_____(填“酸性”、“中性”或“碱性”)。
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
加入NaOH溶液的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 1.1 1.2 1.4 1.6 2.5 7.0 11.0 12.0
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显_____色。
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)_____;可能有_____。
21、“大理石”是常见的筑装饰材料,容易受到酸雨(含硫酸)的侵蚀,原因是(用化学方程式表示) 。
三、实验题。
22、为验证铜、铝、银的金属活动性顺序,进行如下实验:
①铝丝放入硝酸铜溶液 ②铜丝放入硝酸银溶液 ③铜丝放入硝酸铝溶液
回答下列问题:
(1)实验①中铝丝一定要打磨的原因是____________________ ;
(2)实验①能确定铝和铜活动性强弱的明显现象是___________________;
(3)写出实验②中发生反应的化学方程式_______________________________;
(4)要验证铜、铝、银三种金属活动性顺序,实验方案有很多。为了体现“绿色化学”的理念, 按照利用的物质、发生的反应、产生的废液都尽量少的原则,请你设计一个完成该验证目 的的实验方案______________________________。(写出所用物质和操作方法)
23、甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 检测结果
甲同学 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 pH>7
乙同学 将pH试纸浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 pH>7
(1)根据两位同学的实验可得出碳酸钠溶液显___________(填酸性、碱性或中性)。
(2)根据两位同学的实验操作,你认为哪个同学操作不规范。为什么?_________ 。
(3)如果将pH试纸润湿,再一次测定碳酸钠溶液的酸碱性,测得的结果将_______。(填“偏大”、“偏小”、“无影响”、“无法确定”)
24、已知盐酸是HCl气体溶于水所形成的溶液,在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到澄清石灰水变浑浊的现象。
回答下列问题:
(1)A装置中发生反应的化学方程式为 。
(2)B装置的作用是 ,实验后向B中滴入石蕊溶液,可看到的现象是 ,写出B中所有溶质的化学式 。
(3)如果去掉B装置,将A、C直接连接,则C装置中可能发生反应的化学方程式是 。
四、计算题。
25、26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:
(1)黄铜中铜的质量分数;
(2)反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
2023—2024学年人教版化学九年级下册第十单元 酸和碱 分层题附答案
人教版第十单元 酸和碱
一、选择题。(16题)
1、x、y、z三种金属中,只有z能和稀硫酸反应,当把y放入x的盐溶液中,y表面有x析出,则三种金属x、y、z的活动性顺序为( )
A.z﹥y﹥x B.y﹥x﹥z C.z﹥x﹥y D.y﹥z﹥x
【答案】A
2、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
【答案】B
3、下列不是氢氧化钠俗称的是( )
A.火碱 B.烧碱 C.纯碱 D.苛性钠
【答案】C
4、氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者在水溶液中均能解离出一种相同的粒子,这种粒子是( )
A.H+ B.OH- C.H2O D.H
【答案】B
5、合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质,将煤综合利用.仅用合成气为原料不可能得到的物质是( )
A.草酸(HOOCCOOH) B.甲醇(CH3OH)
C.尿素[CO(NH2)2] D.葡萄糖(C6H12O6)
【答案】C
6、下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是( )
A. Fe和CuSO4溶液 B. Zn和稀H2SO4
C. NaOH溶液和稀盐酸 D. 澄清石灰水和CO2
【答案】C
7、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
【答案】B
8、空气是人类宝贵的自然资源,下列有关空气的说法错误的是( )
A. 液氮可用作制冷剂
B. 氧气可用作火箭发射的燃料
C. 氦气可用来填充探空气球
D. 造成空气污染的气体主要有一氧化碳、二氧化氮、二氧化硫
【答案】B
9、下列验证实验不能成功的是( )
A. CO2能与烧碱溶液反应
B. 不同物质的着火点不同
C. 分子在不断运动
D. 质量守恒定律
【答案】D
10、以下物质能使酚酞变红的物质是( )
A.氯化钠 B.食醋 C.碳酸钠 D.盐酸
【答案】C
11、苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强。下列对苯甲酸性质的推测不合理是( )
A.苯甲酸溶液的pH小于7
B.苯甲酸溶液的pH大于7
C.苯甲酸溶液能使紫色石蕊试液变红色
D.苯甲酸溶液不能使无色酚酞试液变色
【答案】B
12、豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草酸钙沉淀等物质。其中发生的反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
【答案】D
13、某物质不含碳元素和氢元素,它不可能是( )
①酸 ②碱 ③盐 ④有机物.
A. ①②④ B. ②③④ C. ①②③ D. ①③④
【答案】A
14、醋酸、柠檬酸等是食品加工中常用的酸,它们在水中都能电离生成( )
A. OH- B. H+ C. Cl- D. SO42-
【答案】B
15、一些食物的近似pH如下:
下列说法中不正确的是( )
A.苹果汁和葡萄汁均显酸性 B.鸡蛋清和牛奶均显碱性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
【答案】B
16、类比推理是化学学习的常用思维方法,现有以下类推结果,其中错误的是 ( )
①酸碱中和反应生成盐和水,生成盐和水的反应一定是中和反应;
②碱的水溶液可使酚酞溶液变红,所以使酚酞溶液变红的溶液一定是碱溶液;
③氧化物中都含有氧元素,所以含有氧元素的化合物一定是氧化物;
④有机物中都含有碳元素,但是含有碳元素的化合物不一定是有机物.
A.只有①② B.只有②③④ C.只有①②③ D.①②③④
【答案】C
二、填空题。
17、将稀盐酸滴入如图所示的盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是 (填字母,下同)。
(2)溶液变为浅绿色的是 ,该溶液中一定含有的阳离子是 。
(3)溶液变为蓝色的是 ,该试管中发生反应的化学方程式为 。
(4)产生气泡的是 。
(5)没有发生化学反应的是 ,理由是 。
【答案】(1)E (2)B Fe2+
(3)D CuO+2HCl CuCl2+H2O (4)BC
(5)A 在金属活动性顺序中,铜排在氢的后面
18、对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强,常温下,10%的稀硫酸的pH________(填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_______________。
(2)有化学反应发生的方法:加入________、__________或____________(要求各种方法中所选的物质的类别不同)。
【答案】小于 (1)加水稀释 (2)Zn CuO NaOH(或CaCO3等)
19、如图为两种物质在不同温度时的溶解度曲线.请回答:
(1)40℃时,将30g KCl加入到50g水中,充分溶解后所得溶液是________溶液(填写“饱和”或“不饱和”)。
(2)将20℃时KNO3和KCl的两种饱和溶液升温至40℃,则两种溶液的溶质质量分数大小关系是:KNO3________KCl(填写“>”、“<”或“=”)。
【答案】(1)饱和 (2)<
20、酸、碱、盐是三类重要物质。
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因_____ 。
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是_____ 。解释产生此现象的原因_____ ;
_____ 。
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显_____,乙醇的水溶液显_____(填“酸性”、“中性”或“碱性”)。
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
加入NaOH溶液的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 1.1 1.2 1.4 1.6 2.5 7.0 11.0 12.0
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显_____色。
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)_____;可能有_____。
【答案】浓盐酸易挥发 红墨水的液面乙高于甲、澄清石灰水变浑浊
氧化钙与水反应放热使试管内的气体受热膨胀
氢氧化钙的溶解度随温度的升高而降低,一部分氢氧化钙固体析出
酸性 中性 蓝色 NaCl HCl
21、“大理石”是常见的筑装饰材料,容易受到酸雨(含硫酸)的侵蚀,原因是(用化学方程式表示) 。
【答案】CaCO3+H2SO4 = CaSO4+CO2↑+H2O
三、实验题。
22、为验证铜、铝、银的金属活动性顺序,进行如下实验:
①铝丝放入硝酸铜溶液 ②铜丝放入硝酸银溶液 ③铜丝放入硝酸铝溶液
回答下列问题:
(1)实验①中铝丝一定要打磨的原因是____________________ ;
(2)实验①能确定铝和铜活动性强弱的明显现象是___________________;
(3)写出实验②中发生反应的化学方程式_______________________________;
(4)要验证铜、铝、银三种金属活动性顺序,实验方案有很多。为了体现“绿色化学”的理念, 按照利用的物质、发生的反应、产生的废液都尽量少的原则,请你设计一个完成该验证目 的的实验方案______________________________。(写出所用物质和操作方法)
【答案】(1)去除铝丝上的氧化物或污物
(2)铝的表面附着一层红色的固体
(3)Cu+2AgNO3==Cu(NO3)2+2Ag
(4)所用物质:铝丝、银丝和硫酸铜(或者硝酸铜)溶液
操作方法:将铝丝、银丝分别插入到硫酸铜(或者硝酸铜)溶液中,铝的表面附着一层红色的固体,说明铝与硫酸铜(或者硝酸铜)反应生成硫酸铝(或者硝酸铝)和铜,即证明铝的活动性比铜强,因此会置换出铜,由于在银的表面不会出现一层红色的固体,说明反应没有进行,即银的活动性比铜弱,因此可证明三种金属的活动性顺序为:铝>铜>银。
23、甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 检测结果
甲同学 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 pH>7
乙同学 将pH试纸浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 pH>7
(1)根据两位同学的实验可得出碳酸钠溶液显___________(填酸性、碱性或中性)。
(2)根据两位同学的实验操作,你认为哪个同学操作不规范。为什么?_________ 。
(3)如果将pH试纸润湿,再一次测定碳酸钠溶液的酸碱性,测得的结果将_______。(填“偏大”、“偏小”、“无影响”、“无法确定”)
【答案】碱性 乙同学、把试纸浸到溶液中污染试剂 偏小
24、已知盐酸是HCl气体溶于水所形成的溶液,在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到澄清石灰水变浑浊的现象。
回答下列问题:
(1)A装置中发生反应的化学方程式为 。
(2)B装置的作用是 ,实验后向B中滴入石蕊溶液,可看到的现象是 ,写出B中所有溶质的化学式 。
(3)如果去掉B装置,将A、C直接连接,则C装置中可能发生反应的化学方程式是 。
【答案】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)吸收挥发出的氯化氢气体;石蕊溶液变红;HCl、H2CO3
(3)Ca(OH)2+2HCl═CaCl2+2H2O
四、计算题。
25、26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:
(1)黄铜中铜的质量分数;
(2)反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
【答案】(1)黄铜中铜的质量分数为75%。
(2)反应后所得溶液中溶质质量分数为15.1%。
人教版第十单元 酸和碱
一、选择题。(16题)
1、x、y、z三种金属中,只有z能和稀硫酸反应,当把y放入x的盐溶液中,y表面有x析出,则三种金属x、y、z的活动性顺序为( )
A.z﹥y﹥x B.y﹥x﹥z C.z﹥x﹥y D.y﹥z﹥x
2、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
3、下列不是氢氧化钠俗称的是( )
A.火碱 B.烧碱 C.纯碱 D.苛性钠
4、氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者在水溶液中均能解离出一种相同的粒子,这种粒子是( )
A.H+ B.OH- C.H2O D.H
5、合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质,将煤综合利用.仅用合成气为原料不可能得到的物质是( )
A.草酸(HOOCCOOH) B.甲醇(CH3OH)
C.尿素[CO(NH2)2] D.葡萄糖(C6H12O6)
6、下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是( )
A. Fe和CuSO4溶液 B. Zn和稀H2SO4
C. NaOH溶液和稀盐酸 D. 澄清石灰水和CO2
7、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
8、空气是人类宝贵的自然资源,下列有关空气的说法错误的是( )
A. 液氮可用作制冷剂
B. 氧气可用作火箭发射的燃料
C. 氦气可用来填充探空气球
D. 造成空气污染的气体主要有一氧化碳、二氧化氮、二氧化硫
9、下列验证实验不能成功的是( )
A. CO2能与烧碱溶液反应
B. 不同物质的着火点不同
C. 分子在不断运动
D. 质量守恒定律
10、以下物质能使酚酞变红的物质是( )
A.氯化钠 B.食醋 C.碳酸钠 D.盐酸
11、苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强。下列对苯甲酸性质的推测不合理是( )
A.苯甲酸溶液的pH小于7
B.苯甲酸溶液的pH大于7
C.苯甲酸溶液能使紫色石蕊试液变红色
D.苯甲酸溶液不能使无色酚酞试液变色
12、豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草酸钙沉淀等物质。其中发生的反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
13、某物质不含碳元素和氢元素,它不可能是( )
①酸 ②碱 ③盐 ④有机物.
A. ①②④ B. ②③④ C. ①②③ D. ①③④
14、醋酸、柠檬酸等是食品加工中常用的酸,它们在水中都能电离生成( )
A. OH- B. H+ C. Cl- D. SO42-
15、一些食物的近似pH如下:
下列说法中不正确的是( )
A.苹果汁和葡萄汁均显酸性 B.鸡蛋清和牛奶均显碱性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
16、类比推理是化学学习的常用思维方法,现有以下类推结果,其中错误的是 ( )
①酸碱中和反应生成盐和水,生成盐和水的反应一定是中和反应;
②碱的水溶液可使酚酞溶液变红,所以使酚酞溶液变红的溶液一定是碱溶液;
③氧化物中都含有氧元素,所以含有氧元素的化合物一定是氧化物;
④有机物中都含有碳元素,但是含有碳元素的化合物不一定是有机物.
A.只有①② B.只有②③④ C.只有①②③ D.①②③④
二、填空题。
17、将稀盐酸滴入如图所示的盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是 (填字母,下同)。
(2)溶液变为浅绿色的是 ,该溶液中一定含有的阳离子是 。
(3)溶液变为蓝色的是 ,该试管中发生反应的化学方程式为 。
(4)产生气泡的是 。
(5)没有发生化学反应的是 ,理由是 。
18、对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强,常温下,10%的稀硫酸的pH________(填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_______________。
(2)有化学反应发生的方法:加入________、__________或____________(要求各种方法中所选的物质的类别不同)。
19、如图为两种物质在不同温度时的溶解度曲线.请回答:
(1)40℃时,将30g KCl加入到50g水中,充分溶解后所得溶液是________溶液(填写“饱和”或“不饱和”)。
(2)将20℃时KNO3和KCl的两种饱和溶液升温至40℃,则两种溶液的溶质质量分数大小关系是:KNO3________KCl(填写“>”、“<”或“=”)。
20、酸、碱、盐是三类重要物质。
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因_____ 。
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是_____ 。解释产生此现象的原因_____ ;
_____ 。
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显_____,乙醇的水溶液显_____(填“酸性”、“中性”或“碱性”)。
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
加入NaOH溶液的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 1.1 1.2 1.4 1.6 2.5 7.0 11.0 12.0
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显_____色。
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)_____;可能有_____。
21、“大理石”是常见的筑装饰材料,容易受到酸雨(含硫酸)的侵蚀,原因是(用化学方程式表示) 。
三、实验题。
22、为验证铜、铝、银的金属活动性顺序,进行如下实验:
①铝丝放入硝酸铜溶液 ②铜丝放入硝酸银溶液 ③铜丝放入硝酸铝溶液
回答下列问题:
(1)实验①中铝丝一定要打磨的原因是____________________ ;
(2)实验①能确定铝和铜活动性强弱的明显现象是___________________;
(3)写出实验②中发生反应的化学方程式_______________________________;
(4)要验证铜、铝、银三种金属活动性顺序,实验方案有很多。为了体现“绿色化学”的理念, 按照利用的物质、发生的反应、产生的废液都尽量少的原则,请你设计一个完成该验证目 的的实验方案______________________________。(写出所用物质和操作方法)
23、甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 检测结果
甲同学 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 pH>7
乙同学 将pH试纸浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 pH>7
(1)根据两位同学的实验可得出碳酸钠溶液显___________(填酸性、碱性或中性)。
(2)根据两位同学的实验操作,你认为哪个同学操作不规范。为什么?_________ 。
(3)如果将pH试纸润湿,再一次测定碳酸钠溶液的酸碱性,测得的结果将_______。(填“偏大”、“偏小”、“无影响”、“无法确定”)
24、已知盐酸是HCl气体溶于水所形成的溶液,在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到澄清石灰水变浑浊的现象。
回答下列问题:
(1)A装置中发生反应的化学方程式为 。
(2)B装置的作用是 ,实验后向B中滴入石蕊溶液,可看到的现象是 ,写出B中所有溶质的化学式 。
(3)如果去掉B装置,将A、C直接连接,则C装置中可能发生反应的化学方程式是 。
四、计算题。
25、26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:
(1)黄铜中铜的质量分数;
(2)反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
2023—2024学年人教版化学九年级下册第十单元 酸和碱 分层题附答案
人教版第十单元 酸和碱
一、选择题。(16题)
1、x、y、z三种金属中,只有z能和稀硫酸反应,当把y放入x的盐溶液中,y表面有x析出,则三种金属x、y、z的活动性顺序为( )
A.z﹥y﹥x B.y﹥x﹥z C.z﹥x﹥y D.y﹥z﹥x
【答案】A
2、按图所示进行实验,下列说法错误的是( )
A.稀盐酸和稀硫酸都能使石蕊溶液变为红色
B.稀盐酸和稀硫酸都能使酚酞溶液变为蓝色
C.使用点滴板进行实验可节约药品
D.若将稀硫酸或稀盐酸换成稀硝酸,变色情况一样
【答案】B
3、下列不是氢氧化钠俗称的是( )
A.火碱 B.烧碱 C.纯碱 D.苛性钠
【答案】C
4、氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者在水溶液中均能解离出一种相同的粒子,这种粒子是( )
A.H+ B.OH- C.H2O D.H
【答案】B
5、合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质,将煤综合利用.仅用合成气为原料不可能得到的物质是( )
A.草酸(HOOCCOOH) B.甲醇(CH3OH)
C.尿素[CO(NH2)2] D.葡萄糖(C6H12O6)
【答案】C
6、下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是( )
A. Fe和CuSO4溶液 B. Zn和稀H2SO4
C. NaOH溶液和稀盐酸 D. 澄清石灰水和CO2
【答案】C
7、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
【答案】B
8、空气是人类宝贵的自然资源,下列有关空气的说法错误的是( )
A. 液氮可用作制冷剂
B. 氧气可用作火箭发射的燃料
C. 氦气可用来填充探空气球
D. 造成空气污染的气体主要有一氧化碳、二氧化氮、二氧化硫
【答案】B
9、下列验证实验不能成功的是( )
A. CO2能与烧碱溶液反应
B. 不同物质的着火点不同
C. 分子在不断运动
D. 质量守恒定律
【答案】D
10、以下物质能使酚酞变红的物质是( )
A.氯化钠 B.食醋 C.碳酸钠 D.盐酸
【答案】C
11、苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强。下列对苯甲酸性质的推测不合理是( )
A.苯甲酸溶液的pH小于7
B.苯甲酸溶液的pH大于7
C.苯甲酸溶液能使紫色石蕊试液变红色
D.苯甲酸溶液不能使无色酚酞试液变色
【答案】B
12、豆腐不可与菠菜一起煮,原因是菠菜中含有丰富的草酸、草酸钠,豆腐中含有较多的硫酸钙等钙盐,相互反应生成草酸钙沉淀等物质。其中发生的反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
【答案】D
13、某物质不含碳元素和氢元素,它不可能是( )
①酸 ②碱 ③盐 ④有机物.
A. ①②④ B. ②③④ C. ①②③ D. ①③④
【答案】A
14、醋酸、柠檬酸等是食品加工中常用的酸,它们在水中都能电离生成( )
A. OH- B. H+ C. Cl- D. SO42-
【答案】B
15、一些食物的近似pH如下:
下列说法中不正确的是( )
A.苹果汁和葡萄汁均显酸性 B.鸡蛋清和牛奶均显碱性
C.苹果汁比葡萄汁的酸性强 D.胃酸过多的人应少饮苹果汁和葡萄汁
【答案】B
16、类比推理是化学学习的常用思维方法,现有以下类推结果,其中错误的是 ( )
①酸碱中和反应生成盐和水,生成盐和水的反应一定是中和反应;
②碱的水溶液可使酚酞溶液变红,所以使酚酞溶液变红的溶液一定是碱溶液;
③氧化物中都含有氧元素,所以含有氧元素的化合物一定是氧化物;
④有机物中都含有碳元素,但是含有碳元素的化合物不一定是有机物.
A.只有①② B.只有②③④ C.只有①②③ D.①②③④
【答案】C
二、填空题。
17、将稀盐酸滴入如图所示的盛有不同物质的试管中,请回答下列问题。
(1)溶液变成红色的是 (填字母,下同)。
(2)溶液变为浅绿色的是 ,该溶液中一定含有的阳离子是 。
(3)溶液变为蓝色的是 ,该试管中发生反应的化学方程式为 。
(4)产生气泡的是 。
(5)没有发生化学反应的是 ,理由是 。
【答案】(1)E (2)B Fe2+
(3)D CuO+2HCl CuCl2+H2O (4)BC
(5)A 在金属活动性顺序中,铜排在氢的后面
18、对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强,常温下,10%的稀硫酸的pH________(填“大于”“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_______________。
(2)有化学反应发生的方法:加入________、__________或____________(要求各种方法中所选的物质的类别不同)。
【答案】小于 (1)加水稀释 (2)Zn CuO NaOH(或CaCO3等)
19、如图为两种物质在不同温度时的溶解度曲线.请回答:
(1)40℃时,将30g KCl加入到50g水中,充分溶解后所得溶液是________溶液(填写“饱和”或“不饱和”)。
(2)将20℃时KNO3和KCl的两种饱和溶液升温至40℃,则两种溶液的溶质质量分数大小关系是:KNO3________KCl(填写“>”、“<”或“=”)。
【答案】(1)饱和 (2)<
20、酸、碱、盐是三类重要物质。
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因_____ 。
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是_____ 。解释产生此现象的原因_____ ;
_____ 。
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显_____,乙醇的水溶液显_____(填“酸性”、“中性”或“碱性”)。
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
加入NaOH溶液的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 1.1 1.2 1.4 1.6 2.5 7.0 11.0 12.0
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显_____色。
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)_____;可能有_____。
【答案】浓盐酸易挥发 红墨水的液面乙高于甲、澄清石灰水变浑浊
氧化钙与水反应放热使试管内的气体受热膨胀
氢氧化钙的溶解度随温度的升高而降低,一部分氢氧化钙固体析出
酸性 中性 蓝色 NaCl HCl
21、“大理石”是常见的筑装饰材料,容易受到酸雨(含硫酸)的侵蚀,原因是(用化学方程式表示) 。
【答案】CaCO3+H2SO4 = CaSO4+CO2↑+H2O
三、实验题。
22、为验证铜、铝、银的金属活动性顺序,进行如下实验:
①铝丝放入硝酸铜溶液 ②铜丝放入硝酸银溶液 ③铜丝放入硝酸铝溶液
回答下列问题:
(1)实验①中铝丝一定要打磨的原因是____________________ ;
(2)实验①能确定铝和铜活动性强弱的明显现象是___________________;
(3)写出实验②中发生反应的化学方程式_______________________________;
(4)要验证铜、铝、银三种金属活动性顺序,实验方案有很多。为了体现“绿色化学”的理念, 按照利用的物质、发生的反应、产生的废液都尽量少的原则,请你设计一个完成该验证目 的的实验方案______________________________。(写出所用物质和操作方法)
【答案】(1)去除铝丝上的氧化物或污物
(2)铝的表面附着一层红色的固体
(3)Cu+2AgNO3==Cu(NO3)2+2Ag
(4)所用物质:铝丝、银丝和硫酸铜(或者硝酸铜)溶液
操作方法:将铝丝、银丝分别插入到硫酸铜(或者硝酸铜)溶液中,铝的表面附着一层红色的固体,说明铝与硫酸铜(或者硝酸铜)反应生成硫酸铝(或者硝酸铝)和铜,即证明铝的活动性比铜强,因此会置换出铜,由于在银的表面不会出现一层红色的固体,说明反应没有进行,即银的活动性比铜弱,因此可证明三种金属的活动性顺序为:铝>铜>银。
23、甲、乙两同学想了解碳酸钠溶液的酸碱性。他们做了以下研究:
实 验 操 作 检测结果
甲同学 取pH试纸放在玻璃片上;用玻璃棒蘸取碳酸钠溶液沾在pH试纸上;将试纸显示的颜色与标准比色卡比较。 pH>7
乙同学 将pH试纸浸入碳酸钠溶液中,把试纸显示的颜色与标准比色卡比较。 pH>7
(1)根据两位同学的实验可得出碳酸钠溶液显___________(填酸性、碱性或中性)。
(2)根据两位同学的实验操作,你认为哪个同学操作不规范。为什么?_________ 。
(3)如果将pH试纸润湿,再一次测定碳酸钠溶液的酸碱性,测得的结果将_______。(填“偏大”、“偏小”、“无影响”、“无法确定”)
【答案】碱性 乙同学、把试纸浸到溶液中污染试剂 偏小
24、已知盐酸是HCl气体溶于水所形成的溶液,在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象.现有一同学用下列装置进行实验,却看到澄清石灰水变浑浊的现象。
回答下列问题:
(1)A装置中发生反应的化学方程式为 。
(2)B装置的作用是 ,实验后向B中滴入石蕊溶液,可看到的现象是 ,写出B中所有溶质的化学式 。
(3)如果去掉B装置,将A、C直接连接,则C装置中可能发生反应的化学方程式是 。
【答案】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)吸收挥发出的氯化氢气体;石蕊溶液变红;HCl、H2CO3
(3)Ca(OH)2+2HCl═CaCl2+2H2O
四、计算题。
25、26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:
(1)黄铜中铜的质量分数;
(2)反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
【答案】(1)黄铜中铜的质量分数为75%。
(2)反应后所得溶液中溶质质量分数为15.1%。
同课章节目录
