原电池原理的应用 专题练习(含解析)
文档属性
| 名称 | 原电池原理的应用 专题练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 105.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 01:11:47 | ||
图片预览



文档简介
专题练习 原电池原理的应用
1.下列四个化学反应中,你认为理论上不可用于设计原电池的是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
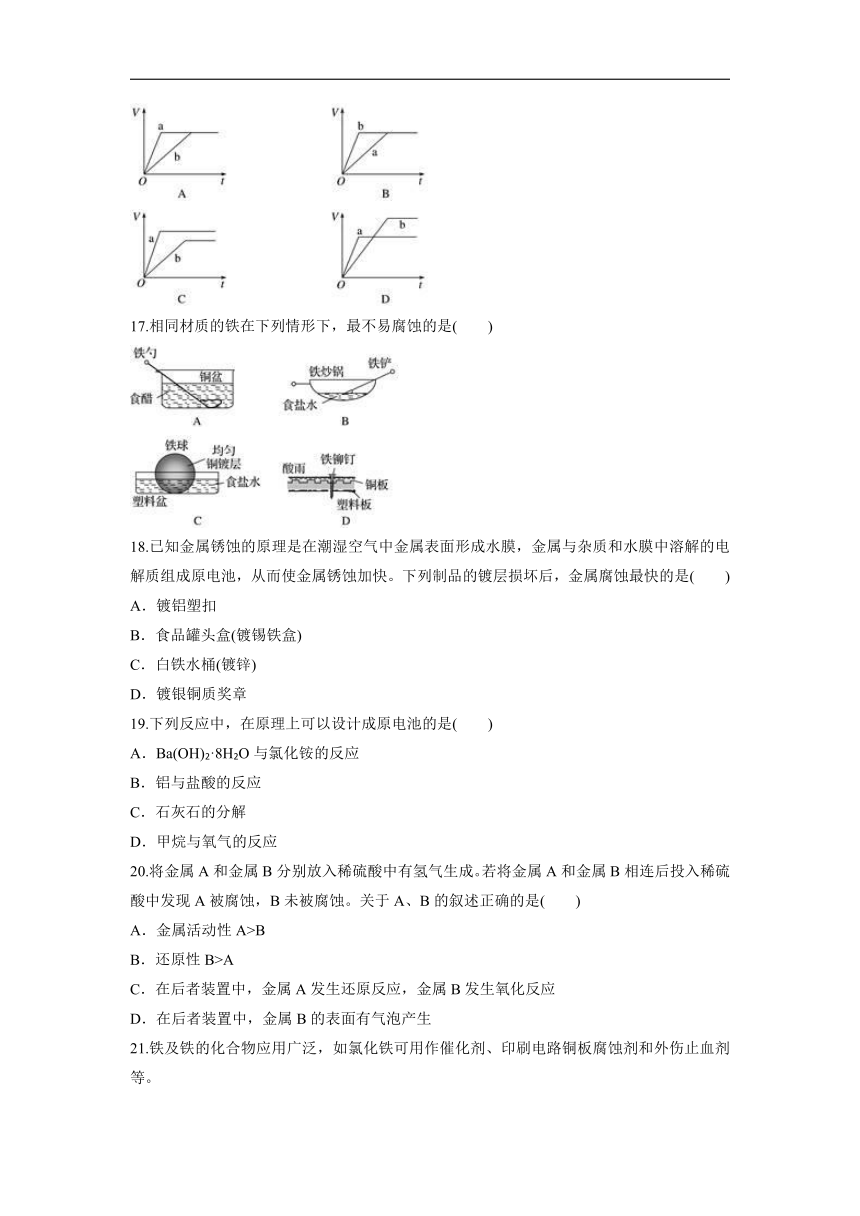
B.2H2+O22H2O
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
D.CH4+2O2CO2+2H2O
2.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.Zn+Ag2O+H2O===Zn(OH)2+2Ag
B.Pb+PbO2+2H2SO4===2PbSO4+2H2O
C.Zn+CuSO4===Cu+ZnSO4
D.C+CO22CO
3.下列反应中可用来设计成原电池的是( )
A.CaO+H2O===Ca(OH)2
B.NaOH+HCl===NaCl+H2O
C.2KClO32KCl+3O2↑
D.Zn+2HCl===ZnCl2+H2↑
4.某同学根据离子反应方程式2Fe3++Fe===3Fe2+来设计原电池。下列设计方案中可行的是( )
A.电极材料为铁和锌,电解质溶液为氯化铁溶液
B.电极材料为铁和铜,电解质溶液为硝酸铁溶液
C.电极材料为铁和石墨,电解质溶液为氯化亚铁溶液
D.电极材料为石墨,电解质溶液为氯化铁溶液
5.利用Cu+2FeCl3===CuCl2+2FeCl2反应设计一个原电池,下列说法中正确的是( )
A.电极材料为铁和铜,电解质溶液为氯化铁溶液
B.电极材料为铜和石墨,电解质溶液为硝酸铁溶液
C.正极反应式为2Fe3++2e-===2Fe2+
D.负极质量减小,正极质量增加
6.由甲、乙两种金属与稀硫酸组成的原电池中,甲为正极,则下列推断正确的是( )
A.甲的金属性强于乙
B.甲电极上发生的电极反应是还原反应
C.电子不断由甲电极经外电路流向乙电极
D.甲在金属性活动顺序表中一定排在氢前面
7.下列金属性质的比较中,能说明甲的金属性比乙强的是( )
①甲与水反应比乙与水反应剧烈
②单质甲能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强
④以甲、乙金属为电极构成原电池,甲作负极
A.①④
B.③④
C.①②③④
D.①②③
8.下列叙述中能表明金属甲的活动性比金属乙的活动性强的是( )
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子甲比乙氧化性强
C.甲与盐酸缓慢反应放出氢气,而乙能与冷水剧烈反应放出氢气
D.甲、乙与硫酸溶液形成原电池,乙上冒气泡
9.把金属A放入盐B(NO3)2的溶液中,发生反应A+B2+===A2++B。以下叙述正确的是( )
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A、B和B(NO3)2溶液构成的原电池,A一定是正极,B一定是负极
10.根据下列事实:①A+B2+===A2++B;②D+2H2O===D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-===E,B-2e-===B2+,由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>A2+>B2+>E2+
B.A2+>B2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
11.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>c>d>b
B.a>b>c>d
C.c>a>b>d
D.b>d>c>a
12.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属活动性顺序是( )
A.a>b>c>d
B.b>c>d>a
C.d>a>b>c
D.a>b>d>c
13.在实验室制取氢气时,最好的方法是( )
A.纯锌与稀硫酸反应
B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铜、银)与稀硫酸反应
14.一定量的盐酸跟过量的铁粉反应时,为了减缓反应的进行,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①氢氧化钠固体 ②水 ③氯化钠固体 ④醋酸钠固体
⑤硫酸铜溶液
A.①②
B.②③⑤
C.②④
D.②④⑤
15.用铁片与稀硫酸反应制取氢气时,下列措施可以加快氢气生成的是( )
A.加入少量的硫酸钠固体
B.加入硝酸钠固体
C.滴加少量硫酸铜溶液
D.改用浓硫酸
16.等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量硫酸铜溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
17.相同材质的铁在下列情形下,最不易腐蚀的是( )
18.已知金属锈蚀的原理是在潮湿空气中金属表面形成水膜,金属与杂质和水膜中溶解的电解质组成原电池,从而使金属锈蚀加快。下列制品的镀层损坏后,金属腐蚀最快的是( )
A.镀铝塑扣
B.食品罐头盒(镀锡铁盒)
C.白铁水桶(镀锌)
D.镀银铜质奖章
19.下列反应中,在原理上可以设计成原电池的是( )
A.Ba(OH)2·8H2O与氯化铵的反应
B.铝与盐酸的反应
C.石灰石的分解
D.甲烷与氧气的反应
20.将金属A和金属B分别放入稀硫酸中有氢气生成。若将金属A和金属B相连后投入稀硫酸中发现A被腐蚀,B未被腐蚀。关于A、B的叙述正确的是( )
A.金属活动性A>B
B.还原性B>A
C.在后者装置中,金属A发生还原反应,金属B发生氧化反应
D.在后者装置中,金属B的表面有气泡产生
21.铁及铁的化合物应用广泛,如氯化铁可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)氯化铁溶液腐蚀印刷电路铜板的离子方程式是____________________________________
______________________________________________________________________________。
(2)若将(1)中的反应设计成原电池,可用________作负极,________作正极,____________作电解质溶液。
(3)负极反应式是_______________________________________________________________,
正极反应式是________________________________________________________________。
22.根据氧化还原反应:2FeCl3+Cu===CuCl2+2FeCl2设计原电池。
(1)画出装置图。
(2)选用的电解质溶液是_________________________________________________________。
(3)负极材料是________,电极反应式是___________________________________________。
(4)正极材料是________,电极反应式是___________________________________________。
23.现有如下两个反应:
①NaOH+HCl===NaCl+H2O;②Cu+2Ag+===2Ag+Cu2+。
(1)根据两反应本质,判断能否设计成原电池_______________________________________。
(2)如果不能,说明其原因_______________________________________________________。
(3)如果可以,则写出正、负极材料、其电极反应式、反应类型(“氧化”或“还原”):
负极:____________,____________,________。
正极:____________,____________,________。
(4)若导线上转移电子1mol,则正极质量增加________g,电解质溶液为_________________。
24.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是__________________________________________________。
(2)装置乙中正极的电极反应式是__________________________________________________。
(3)装置丙中溶液的酸性变化是____________________________________________________。
(4)四种金属活动性由强到弱的顺序是______________________________________________。
25.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________________________________。
(2)B中锡极为________极,电极反应式为____________,锡极附近溶液的酸性________(填“增大”、“减小”或“不变”)。B中Fe极为________极,电极反应方程式为________________________________________________________________________
________________________________________________________________________。
(3)C中被腐蚀的金属是________,总反应式方程式为__________________________
________________________________________________________________________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是__________________________________。
26.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成。请回答下列问题:
(1)上述实验中发生反应的化学方程式有____________________________________________
_____________________________________________________________。
(2)硫酸铜溶液可以加快氢气生成的原因是__________________________________________
___________________________________________________________________。
(3)实验室中现有硫酸钠、硫酸镁、硫酸银、硫酸钾等四种溶液,可与上述实验中硫酸铜溶液起相似作用的是________________________________。
参考答案
1.【答案】C
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
2.【答案】D
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
3.【答案】D
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
4.【答案】B
【解析】该原电池的总反应可分为两个电极反应,负极:Fe-2e-===Fe2+,正极:2Fe3++2e-===2Fe2+。铁作负极,活动性比铁弱的金属或导电非金属作正极,电解质溶液中应含有铁离子(Fe3+)。
5.【答案】C
【解析】该原电池的总反应可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Fe3++2e-===2Fe2+。铜作负极,其质量不断减小;活动性比铜弱的金属或导电非金属作正极,其质量不变;氯化铁溶液为电解质溶液。
6.【答案】B
【解析】甲、乙两种金属与稀硫酸组成原电池中,甲为正极,发生还原反应;乙则为负极,发生氧化反应;其电子由乙电极经外电路流向甲电极。乙的金属活动性比甲强。
7.【答案】C
【解析】一般来说,金属与水或酸反应产生氢气越剧烈、金属最高价氧化物对应水化物的碱性越强,金属的活动性就越强;相对活泼的金属能从盐溶液中置换出不活泼金属;当两种金属为电极构成原电池时,负极为相对活泼的金属。
8.【答案】D
【解析】元素金属性的强弱取决于失电子的难易,与失电子的多少无关;阳离子氧化性越强,则其对应金属的还原性越弱;金属与酸或水反应越剧烈,金属的活动性越强;当两种金属为电极构成原电池时,负极为相对活泼的金属。
9.【答案】C
【解析】A+B2+===A2++B说明A比B活泼,但A、B有可能都在金属活动性顺序表H之后,因此A、B都有可能不与水反应,故A错;酒精是非电解质,不能形成原电池,B错;由A、B和B(NO3)2溶液构成的原电池,A一定是负极,B一定是正极。
10.【答案】D
【解析】由题意可判断金属的活动性顺序是D>A>B>E,而金属单质的还原性越弱,其阳离子的氧化性越强,故D正确。
11.【答案】A
【解析】c、d相连时,电流由d到c,推断c作负极;a、c相连时,c极上产生大量气泡,推断a作负极;b、d相连时,b上有大量气泡产生,推断d作负极。四种金属的活动性顺序由强到弱为a>c>d>b。
12.【答案】C
【解析】装置一能形成原电池,a极质量减小为负极,b极为正极,a的活动性比b强;
装置二不能形成原电池,金属活动性顺序b在氢之前,c在之后;
装置三能形成原电池,d极溶解为负极,c极为正极,d的活动性比c强;
装置四能形成原电池,电流从a极(正极)流向d极(负极),d的活动性比a强。
四种金属活动性顺序为d>a>b>c。
13.【答案】D
【解析】粗锌(含铜、银)与稀硫酸能形成原电池,加快锌与稀硫酸的反应。
14.【答案】C
【解析】加入的物质应使盐酸中氢离子浓度降低(反应减慢),但不改变与铁反应的氢离子总物质的量(不影响生成氢气的总量)。①能使氢离子总物质的量减小;③使氢离子浓度不变;⑤能形成原电池,使其反应加快;只有②和④符合题意要求。
15.【答案】C
【解析】滴加少量硫酸铜溶液,锌与置换出的铜形成原电池,加快锌与稀硫酸的反应。
16.【答案】D
【解析】等质量的两份锌粉中,加入等体积等物质的量浓度且均过量的稀硫酸,当向a中加入少量硫酸铜溶液,锌与置换出的铜形成原电池,使a中锌与稀硫酸反应产生氢气快,但a中因铜离子消耗了少量的锌,a中产生的氢气的量比b中产生的氢气的量要小。
17.【答案】C
【解析】选项A、B、D都能形成原电池,铁作负极,更易被腐蚀,选项C中铁被均匀的铜镀层保护。
18.【答案】B
【解析】在构成原电池反应中,被腐蚀的是较活泼的作负极的金属,根据金属活动顺序表,锌、铝比铁较活泼,铁比锡、铜比银较活泼,而铁比铜活泼,镀锡铁盒镀层破坏后腐蚀最快。
19.【答案】BD
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
20.【答案】AD
【解析】在金属A、B与稀硫酸形成的原电池中,A被腐蚀溶解,发生氧化反应,A为原电池的负极,B为原电池的正极,溶液中的氢离子在正极上发生还原反应有气泡产生。A的金属活动性(或还原性)比B的强。
21.【答案】(1)2Fe3++Cu===2Fe2++Cu2+
(2)铜 石墨(答案合理即可) 氯化铁溶液
(3)Cu-2e-===Cu2+ 2Fe3++2e-===2Fe2+
【解析】根据电池反应方程式设计原电池:关键是根据化合价的变化确定原电池的负极和电解质溶液。该原电池的总反应可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Fe3++2e-===2Fe2+。铜作负极,活动性比铜弱的金属或导电非金属作正极,氯化铁溶液为电解质溶液。
22.【答案】(1)
(2)氯化铁溶液
(3)铜 Cu-2e-===Cu2+
(4)石墨(答案合理即可) 2Fe3++2e-===2Fe2+
【解析】根据电池反应方程式设计原电池:关键是化合价的变化确定原电池的负极和电解质溶液。该原电池的总反应可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Fe3++2e-===2Fe2+。铜作负极,活动性比铜弱的金属或导电非金属作正极,氯化铁溶液为电解质溶液。
23.【答案】(1)①不能,②可以
(2)①为非氧化还原反应,没有电子转移
(3)铜 Cu-2e-===Cu2+ 氧化 碳棒、银、铂、金(任选一) 2Ag++2e-===2Ag 还原
(3)108 硝酸银溶液
【解析】反应①为非氧化还原反应,不能用来设计成原电池。反应②为自发的氧化还原反应,可用来设计成原电池,其电池总反应方程式Cu+2Ag+===2Ag+Cu2+可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Ag++2e-===2Ag;铜作负极,活动性比铜弱的金属或导电非金属作正极,硝酸银溶液为电解质溶液。
24.【答案】(1)A-2e-===A2+
(2)Cu2++2e-===Cu
(3)减弱
(4)D>A>B>C
【解析】据图Ⅰ知活动性:A>B,A作负极,电极反应式为A-2e-===A2+;
据图Ⅱ知活动性:B>C,正极反应式为Cu2++2e-===Cu;
据图Ⅲ知活动性:D>A,正极反应式为2H++2e-===H2↑,溶液的酸性减弱。
四种金属的活动性:D>A>B>C。
25.【答案】(1)Fe+2H+===Fe2++H2↑
(2)正 2H++2e-===H2↑ 减小 正极 Fe-2e-===Fe2+
(3)Zn Zn+H2SO4===ZnSO4+H2↑
(4)BAC
【解析】A中不能形成原电池,铁与稀硫酸发生置换反应。
B能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁腐蚀的速率加快。
C能形成原电池,锌比铁活泼,锌为负极不断被腐蚀,铁为正极保持不变。
26.(1)Zn+CuSO4===Cu+ZnSO4、Zn+H2SO4===ZnSO4+H2↑
(2)CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率
(3)Ag2SO4或硫酸银
【解析】锌与稀硫酸反应时,加入少量硫酸铜溶液,锌与置换出的铜形成原电池,使锌与稀硫酸的反应加快;同理,锌也能置换出银,形成原电池,使反应加快。
1.下列四个化学反应中,你认为理论上不可用于设计原电池的是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
B.2H2+O22H2O
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
D.CH4+2O2CO2+2H2O
2.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.Zn+Ag2O+H2O===Zn(OH)2+2Ag
B.Pb+PbO2+2H2SO4===2PbSO4+2H2O
C.Zn+CuSO4===Cu+ZnSO4
D.C+CO22CO
3.下列反应中可用来设计成原电池的是( )
A.CaO+H2O===Ca(OH)2
B.NaOH+HCl===NaCl+H2O
C.2KClO32KCl+3O2↑
D.Zn+2HCl===ZnCl2+H2↑
4.某同学根据离子反应方程式2Fe3++Fe===3Fe2+来设计原电池。下列设计方案中可行的是( )
A.电极材料为铁和锌,电解质溶液为氯化铁溶液
B.电极材料为铁和铜,电解质溶液为硝酸铁溶液
C.电极材料为铁和石墨,电解质溶液为氯化亚铁溶液
D.电极材料为石墨,电解质溶液为氯化铁溶液
5.利用Cu+2FeCl3===CuCl2+2FeCl2反应设计一个原电池,下列说法中正确的是( )
A.电极材料为铁和铜,电解质溶液为氯化铁溶液
B.电极材料为铜和石墨,电解质溶液为硝酸铁溶液
C.正极反应式为2Fe3++2e-===2Fe2+
D.负极质量减小,正极质量增加
6.由甲、乙两种金属与稀硫酸组成的原电池中,甲为正极,则下列推断正确的是( )
A.甲的金属性强于乙
B.甲电极上发生的电极反应是还原反应
C.电子不断由甲电极经外电路流向乙电极
D.甲在金属性活动顺序表中一定排在氢前面
7.下列金属性质的比较中,能说明甲的金属性比乙强的是( )
①甲与水反应比乙与水反应剧烈
②单质甲能从乙的盐溶液中置换出单质乙
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强
④以甲、乙金属为电极构成原电池,甲作负极
A.①④
B.③④
C.①②③④
D.①②③
8.下列叙述中能表明金属甲的活动性比金属乙的活动性强的是( )
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子甲比乙氧化性强
C.甲与盐酸缓慢反应放出氢气,而乙能与冷水剧烈反应放出氢气
D.甲、乙与硫酸溶液形成原电池,乙上冒气泡
9.把金属A放入盐B(NO3)2的溶液中,发生反应A+B2+===A2++B。以下叙述正确的是( )
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A、B和B(NO3)2溶液构成的原电池,A一定是正极,B一定是负极
10.根据下列事实:①A+B2+===A2++B;②D+2H2O===D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-===E,B-2e-===B2+,由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>A2+>B2+>E2+
B.A2+>B2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
11.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>c>d>b
B.a>b>c>d
C.c>a>b>d
D.b>d>c>a
12.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属活动性顺序是( )
A.a>b>c>d
B.b>c>d>a
C.d>a>b>c
D.a>b>d>c
13.在实验室制取氢气时,最好的方法是( )
A.纯锌与稀硫酸反应
B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铜、银)与稀硫酸反应
14.一定量的盐酸跟过量的铁粉反应时,为了减缓反应的进行,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①氢氧化钠固体 ②水 ③氯化钠固体 ④醋酸钠固体
⑤硫酸铜溶液
A.①②
B.②③⑤
C.②④
D.②④⑤
15.用铁片与稀硫酸反应制取氢气时,下列措施可以加快氢气生成的是( )
A.加入少量的硫酸钠固体
B.加入硝酸钠固体
C.滴加少量硫酸铜溶液
D.改用浓硫酸
16.等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量硫酸铜溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
17.相同材质的铁在下列情形下,最不易腐蚀的是( )
18.已知金属锈蚀的原理是在潮湿空气中金属表面形成水膜,金属与杂质和水膜中溶解的电解质组成原电池,从而使金属锈蚀加快。下列制品的镀层损坏后,金属腐蚀最快的是( )
A.镀铝塑扣
B.食品罐头盒(镀锡铁盒)
C.白铁水桶(镀锌)
D.镀银铜质奖章
19.下列反应中,在原理上可以设计成原电池的是( )
A.Ba(OH)2·8H2O与氯化铵的反应
B.铝与盐酸的反应
C.石灰石的分解
D.甲烷与氧气的反应
20.将金属A和金属B分别放入稀硫酸中有氢气生成。若将金属A和金属B相连后投入稀硫酸中发现A被腐蚀,B未被腐蚀。关于A、B的叙述正确的是( )
A.金属活动性A>B
B.还原性B>A
C.在后者装置中,金属A发生还原反应,金属B发生氧化反应
D.在后者装置中,金属B的表面有气泡产生
21.铁及铁的化合物应用广泛,如氯化铁可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)氯化铁溶液腐蚀印刷电路铜板的离子方程式是____________________________________
______________________________________________________________________________。
(2)若将(1)中的反应设计成原电池,可用________作负极,________作正极,____________作电解质溶液。
(3)负极反应式是_______________________________________________________________,
正极反应式是________________________________________________________________。
22.根据氧化还原反应:2FeCl3+Cu===CuCl2+2FeCl2设计原电池。
(1)画出装置图。
(2)选用的电解质溶液是_________________________________________________________。
(3)负极材料是________,电极反应式是___________________________________________。
(4)正极材料是________,电极反应式是___________________________________________。
23.现有如下两个反应:
①NaOH+HCl===NaCl+H2O;②Cu+2Ag+===2Ag+Cu2+。
(1)根据两反应本质,判断能否设计成原电池_______________________________________。
(2)如果不能,说明其原因_______________________________________________________。
(3)如果可以,则写出正、负极材料、其电极反应式、反应类型(“氧化”或“还原”):
负极:____________,____________,________。
正极:____________,____________,________。
(4)若导线上转移电子1mol,则正极质量增加________g,电解质溶液为_________________。
24.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是__________________________________________________。
(2)装置乙中正极的电极反应式是__________________________________________________。
(3)装置丙中溶液的酸性变化是____________________________________________________。
(4)四种金属活动性由强到弱的顺序是______________________________________________。
25.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为_____________________________________________________。
(2)B中锡极为________极,电极反应式为____________,锡极附近溶液的酸性________(填“增大”、“减小”或“不变”)。B中Fe极为________极,电极反应方程式为________________________________________________________________________
________________________________________________________________________。
(3)C中被腐蚀的金属是________,总反应式方程式为__________________________
________________________________________________________________________。
(4)A、B、C中铁被腐蚀由快到慢的顺序是__________________________________。
26.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成。请回答下列问题:
(1)上述实验中发生反应的化学方程式有____________________________________________
_____________________________________________________________。
(2)硫酸铜溶液可以加快氢气生成的原因是__________________________________________
___________________________________________________________________。
(3)实验室中现有硫酸钠、硫酸镁、硫酸银、硫酸钾等四种溶液,可与上述实验中硫酸铜溶液起相似作用的是________________________________。
参考答案
1.【答案】C
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
2.【答案】D
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
3.【答案】D
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
4.【答案】B
【解析】该原电池的总反应可分为两个电极反应,负极:Fe-2e-===Fe2+,正极:2Fe3++2e-===2Fe2+。铁作负极,活动性比铁弱的金属或导电非金属作正极,电解质溶液中应含有铁离子(Fe3+)。
5.【答案】C
【解析】该原电池的总反应可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Fe3++2e-===2Fe2+。铜作负极,其质量不断减小;活动性比铜弱的金属或导电非金属作正极,其质量不变;氯化铁溶液为电解质溶液。
6.【答案】B
【解析】甲、乙两种金属与稀硫酸组成原电池中,甲为正极,发生还原反应;乙则为负极,发生氧化反应;其电子由乙电极经外电路流向甲电极。乙的金属活动性比甲强。
7.【答案】C
【解析】一般来说,金属与水或酸反应产生氢气越剧烈、金属最高价氧化物对应水化物的碱性越强,金属的活动性就越强;相对活泼的金属能从盐溶液中置换出不活泼金属;当两种金属为电极构成原电池时,负极为相对活泼的金属。
8.【答案】D
【解析】元素金属性的强弱取决于失电子的难易,与失电子的多少无关;阳离子氧化性越强,则其对应金属的还原性越弱;金属与酸或水反应越剧烈,金属的活动性越强;当两种金属为电极构成原电池时,负极为相对活泼的金属。
9.【答案】C
【解析】A+B2+===A2++B说明A比B活泼,但A、B有可能都在金属活动性顺序表H之后,因此A、B都有可能不与水反应,故A错;酒精是非电解质,不能形成原电池,B错;由A、B和B(NO3)2溶液构成的原电池,A一定是负极,B一定是正极。
10.【答案】D
【解析】由题意可判断金属的活动性顺序是D>A>B>E,而金属单质的还原性越弱,其阳离子的氧化性越强,故D正确。
11.【答案】A
【解析】c、d相连时,电流由d到c,推断c作负极;a、c相连时,c极上产生大量气泡,推断a作负极;b、d相连时,b上有大量气泡产生,推断d作负极。四种金属的活动性顺序由强到弱为a>c>d>b。
12.【答案】C
【解析】装置一能形成原电池,a极质量减小为负极,b极为正极,a的活动性比b强;
装置二不能形成原电池,金属活动性顺序b在氢之前,c在之后;
装置三能形成原电池,d极溶解为负极,c极为正极,d的活动性比c强;
装置四能形成原电池,电流从a极(正极)流向d极(负极),d的活动性比a强。
四种金属活动性顺序为d>a>b>c。
13.【答案】D
【解析】粗锌(含铜、银)与稀硫酸能形成原电池,加快锌与稀硫酸的反应。
14.【答案】C
【解析】加入的物质应使盐酸中氢离子浓度降低(反应减慢),但不改变与铁反应的氢离子总物质的量(不影响生成氢气的总量)。①能使氢离子总物质的量减小;③使氢离子浓度不变;⑤能形成原电池,使其反应加快;只有②和④符合题意要求。
15.【答案】C
【解析】滴加少量硫酸铜溶液,锌与置换出的铜形成原电池,加快锌与稀硫酸的反应。
16.【答案】D
【解析】等质量的两份锌粉中,加入等体积等物质的量浓度且均过量的稀硫酸,当向a中加入少量硫酸铜溶液,锌与置换出的铜形成原电池,使a中锌与稀硫酸反应产生氢气快,但a中因铜离子消耗了少量的锌,a中产生的氢气的量比b中产生的氢气的量要小。
17.【答案】C
【解析】选项A、B、D都能形成原电池,铁作负极,更易被腐蚀,选项C中铁被均匀的铜镀层保护。
18.【答案】B
【解析】在构成原电池反应中,被腐蚀的是较活泼的作负极的金属,根据金属活动顺序表,锌、铝比铁较活泼,铁比锡、铜比银较活泼,而铁比铜活泼,镀锡铁盒镀层破坏后腐蚀最快。
19.【答案】BD
【解析】理论上用于设计原电池的反应,是常温下能够自发进行的氧化还原反应。
20.【答案】AD
【解析】在金属A、B与稀硫酸形成的原电池中,A被腐蚀溶解,发生氧化反应,A为原电池的负极,B为原电池的正极,溶液中的氢离子在正极上发生还原反应有气泡产生。A的金属活动性(或还原性)比B的强。
21.【答案】(1)2Fe3++Cu===2Fe2++Cu2+
(2)铜 石墨(答案合理即可) 氯化铁溶液
(3)Cu-2e-===Cu2+ 2Fe3++2e-===2Fe2+
【解析】根据电池反应方程式设计原电池:关键是根据化合价的变化确定原电池的负极和电解质溶液。该原电池的总反应可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Fe3++2e-===2Fe2+。铜作负极,活动性比铜弱的金属或导电非金属作正极,氯化铁溶液为电解质溶液。
22.【答案】(1)
(2)氯化铁溶液
(3)铜 Cu-2e-===Cu2+
(4)石墨(答案合理即可) 2Fe3++2e-===2Fe2+
【解析】根据电池反应方程式设计原电池:关键是化合价的变化确定原电池的负极和电解质溶液。该原电池的总反应可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Fe3++2e-===2Fe2+。铜作负极,活动性比铜弱的金属或导电非金属作正极,氯化铁溶液为电解质溶液。
23.【答案】(1)①不能,②可以
(2)①为非氧化还原反应,没有电子转移
(3)铜 Cu-2e-===Cu2+ 氧化 碳棒、银、铂、金(任选一) 2Ag++2e-===2Ag 还原
(3)108 硝酸银溶液
【解析】反应①为非氧化还原反应,不能用来设计成原电池。反应②为自发的氧化还原反应,可用来设计成原电池,其电池总反应方程式Cu+2Ag+===2Ag+Cu2+可分为两个电极反应,负极:Cu-2e-===Cu2+,正极:2Ag++2e-===2Ag;铜作负极,活动性比铜弱的金属或导电非金属作正极,硝酸银溶液为电解质溶液。
24.【答案】(1)A-2e-===A2+
(2)Cu2++2e-===Cu
(3)减弱
(4)D>A>B>C
【解析】据图Ⅰ知活动性:A>B,A作负极,电极反应式为A-2e-===A2+;
据图Ⅱ知活动性:B>C,正极反应式为Cu2++2e-===Cu;
据图Ⅲ知活动性:D>A,正极反应式为2H++2e-===H2↑,溶液的酸性减弱。
四种金属的活动性:D>A>B>C。
25.【答案】(1)Fe+2H+===Fe2++H2↑
(2)正 2H++2e-===H2↑ 减小 正极 Fe-2e-===Fe2+
(3)Zn Zn+H2SO4===ZnSO4+H2↑
(4)BAC
【解析】A中不能形成原电池,铁与稀硫酸发生置换反应。
B能形成原电池,铁比锡活泼,锡为正极,铁为负极,铁腐蚀的速率加快。
C能形成原电池,锌比铁活泼,锌为负极不断被腐蚀,铁为正极保持不变。
26.(1)Zn+CuSO4===Cu+ZnSO4、Zn+H2SO4===ZnSO4+H2↑
(2)CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn微电池,加快了氢气产生的速率
(3)Ag2SO4或硫酸银
【解析】锌与稀硫酸反应时,加入少量硫酸铜溶液,锌与置换出的铜形成原电池,使锌与稀硫酸的反应加快;同理,锌也能置换出银,形成原电池,使反应加快。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
