2.1化学反应速率 同步练习(含答案)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1化学反应速率 同步练习(含答案)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 426.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 23:33:14 | ||
图片预览



文档简介
2.1化学反应速率
同步练习
1.下列有关反应速率说法正确的是
A.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
B.为加快铁和水蒸气的反应速率,增加反应物铁的用量(不考虑表面积变化)
C.和均可加快分解,同等条件下二者对分解速率的改变相同
D.在稀硫酸和铁粉反应制氢气时,为减慢反应速率,可加入适量醋酸钠固体
2.在反应中,各物质表示的反应速率最快的是
A. B.
C. D.
3.下列关于反应过程中能量变化的说法正确的是
A.由如图所示的能量变化可判断出该化学反应是放热反应
B.如图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)= CH3CH3(g)未使用催化剂和使用催化剂时反应过程中的能量变化
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.在一定条件下,某可逆反应的ΔH=+100 kJ·mol-1,则该反应的正反应活化能比逆反应活化能大100 kJ·mol-1
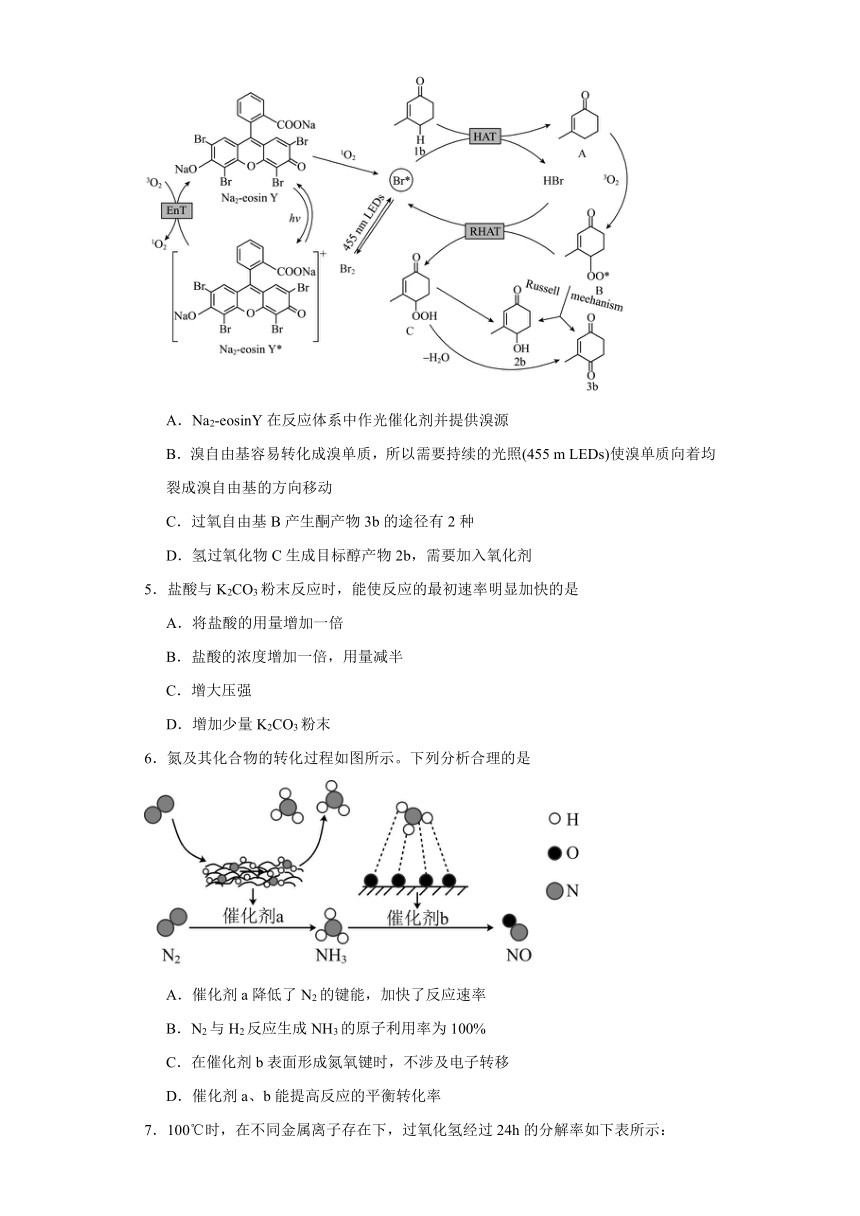
4.烯酮是许多天然产物和医药分子的重要合成砌块。通过向烯酮类分子的烯丙位引入羟基官能团,可以改善其物理和生物性质。一种机理:首先在受光激发之后,激发态的Na2-eosinY*与O2发生能量转移产生1O2。随后1O2与Na2-eosinY作用产生溴自由基,进一步发生反应。下列说法错误的是
A.Na2-eosinY在反应体系中作光催化剂并提供溴源
B.溴自由基容易转化成溴单质,所以需要持续的光照(455 m LEDs)使溴单质向着均裂成溴自由基的方向移动
C.过氧自由基B产生酮产物3b的途径有2种
D.氢过氧化物C生成目标醇产物2b,需要加入氧化剂
5.盐酸与K2CO3粉末反应时,能使反应的最初速率明显加快的是
A.将盐酸的用量增加一倍
B.盐酸的浓度增加一倍,用量减半
C.增大压强
D.增加少量K2CO3粉末
6.氮及其化合物的转化过程如图所示。下列分析合理的是
A.催化剂a降低了N2的键能,加快了反应速率
B.N2与H2反应生成NH3的原子利用率为100%
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
7.100℃时,在不同金属离子存在下,过氧化氢经过24h的分解率如下表所示:
离子 加入量(mg·L-1) 分解率/% 离子 加入量(mg·L-1) 分解率/%
无 2 Fe2+ 1.0 15
Al3+ 10 2 Cu2+ 0.1 86
Zn2+ 10 10 Cr3+ 0.1 96
下列有关说法正确的是
A.能使过氧化氢分解反应活化能降低最多的离子是Al3+
B.催化剂可以使平衡移动,提高过氧化氢的分解率
C.若向过氧化氢中加入水,过氧化氢的分解速率加快
D.用等量H2O2制O2时,与自身分解相比,加入足量酸性KMnO4溶液可得到更多O2
8.采取下列措施对增大化学反应速率有明显效果的是
A.N2和H2合成NH3时,不断分离出产物NH3
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.Na2SO4溶液与BaCl2溶液反应时,增大压强
D.大理石与盐酸反应制取CO2时,将块状大理石改为粉末状大理石
9.下列实验方法或装置正确的是
A B C D
验证气体易溶于水 探究固体表面积对反应速率的影响 制取少量乙酸乙酯 测定中和热
A.A B.B C.C D.D
10.可逆反应A(g)+3B(g)2C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是
A.v(A)=0.25mol·L-1·s-1 B.v(B)=0.6mol·L-1·s-1
C.v(C)=0.3mol·L-1·s-1 D.v(D)=0.4mol·L-1·s-1
11.丙烯与HCl在催化剂作用下发生加成反应:第一步H+进攻丙烯生成碳正离子,第二步Cl-进攻碳正离子。得到两种碳正离子的反应进程与能量关系如图。
下列说法不正确的是
A.催化剂可以使生成①过程的活化能降低
B.过渡态(Ⅰ)比过渡态(Ⅱ)稳定
C.生成①的过程所需的活化能较高,速率慢
D.丙烯与HCl加成反应主要生成
12.某温度下,体积一定的密闭容器中进行反应:,下列叙述错误的是
A.升高温度,正反应速率增大,逆反应速率减小
B.混合气体密度不变时,能说明反应已达到平衡
C.向容器中加入氩气,反应速率不变
D.加入催化剂,可增大单位体积内活化分子数,有效碰撞次数增大
13.运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法不正确的是
A.HCOOH吸附在催化剂表面是一个放热过程
B. HCOO是该历程的决速步骤
C.该反应过程中存在C-H断裂和C=O键的生成
D.Pd和Rh作催化剂时改变了HCOOH分解产生的反应热
14.为研究碳酸钙与稀盐酸的反应速率,标准状况下测得生成CO2体积随时间变化情况如图所示,下列分析正确的是
A.FG段的反应速率最快
B.F点收集到CO2的量最多
C.影响EF段反应速率的主要因素是c(HCl)
D.OE、EF、FG三段中,CO2的生成速率之比为2:4:1
15.下列对有关事实或解释不正确的
选项 事实 解释
A 用铝粉代替铝片与稀盐酸反应,反应速率加快 改用铝粉,固体表面积增大,故反应速率加快
B 5%的双氧水中加入二氧化锰粉末,分解速率迅速加快 降低了反应的焓变,活化分子数增多,有效碰撞增多,速率加快
C 锌与稀硫酸反应,滴入少量硫酸铜溶液,生成氢气的速率加快 锌置换出铜,形成原电池,反应速率加快
D 密闭容器中反应:,当温度、压强不变,充入惰性气体,反应速率减慢 容器体积增大,反应物浓度减小,反应速率减慢
A.A B.B C.C D.D
16.向恒容密闭容器中加入适量催化剂,并充入一定量的H2和CO合成甲醇:2H2(g)+CO(g) CH3OH(g),单位时间内,CO的转化率[α(CO)]与反应温度的变化关系如图所示,温度为T1~T2℃时,CO的转化率降低,原因是 。
17.向某浓度的盐酸中加入一定量的纯净,产生气体的体积随时间的变化曲线如图所示,已知随着反应的进行,反应体系温度逐渐升高(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设段的反应速率为,段的反应速率为,段的反应速度为,则从大到小的顺序为 ;试分析三个时段速率不同的可能原因 。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 。
A.蒸馏水 B.氯化钾固体 C.氯化钠溶液 D.浓盐酸
(3)在盛有碳、的密闭容器中,充入,一定条件下发生,反应时测得的物质的量为。则在内的化学反应速率为 。
18.某探究小组利用丙酮的溴代反应:CH3COCH3+Br2CH3COCH2Br+HBr。研究反应物浓度与反应速率的关系。反应速率v通过测定溴的颜色消失所需的时间来确定,在一定温度下,获得如下实验数据:
实验序号 初始浓度c/mol L-1 溴颜色消失所需时间t/s
CH3COCH3 HCl Br2
① 0.80 0.20 0.0010 290
② 1.60 x 0.0010 145
③ y 0.40 0.0010 145
④ 0.80 0.20 0.0020 580
⑤ 0.80 0.20 0.0040 t1
(1)表格中x=___,y=___。
(2)已知该反应速率方程:v=kca(CH3COCH3)cb(HCl)cd(Br2),其中k为仅与温度有关的速率常数。由上表数据可推测出a=___,b=___,d=___。
(3)t1=___。已知反应物分子一步直接转化为产物的反应称为基元反应,则该反应(填“是”或“不是”)___基元反应。
19.某温度下,反应2A(g)B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g)。20s时测得各组分的物质的量如下表,则反应前20s的平均速率为 ,正反应速率 逆反应速率。
物质 A(g) B(g) C(g)
物质的量/mol 1.2 0.6 0.6
20.提高合成氨反应速率: 、 、 、 。
参考答案:
1.D2.D3.D4.D5.B6.B7.D8.D9.A10.A11.B12.A13.D14.D15.B
16.催化剂的活性降低,反应速率减小
17. 段反应物浓度较大,速率较快;段反应物浓度减小,但速率较快,说明反应放热,温度升高,反应速率增大;段反应物浓度减小,反应速率减慢。 AC
18.(1)0.20 0.80
(2)1 1 0
(3)1160 不是
19. 0.03mol·L-1·s-1 大于
20. 高压 高温 催化剂 V(N2):V(H2)=1:2.8
同步练习
1.下列有关反应速率说法正确的是
A.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
B.为加快铁和水蒸气的反应速率,增加反应物铁的用量(不考虑表面积变化)
C.和均可加快分解,同等条件下二者对分解速率的改变相同
D.在稀硫酸和铁粉反应制氢气时,为减慢反应速率,可加入适量醋酸钠固体
2.在反应中,各物质表示的反应速率最快的是
A. B.
C. D.
3.下列关于反应过程中能量变化的说法正确的是
A.由如图所示的能量变化可判断出该化学反应是放热反应
B.如图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)= CH3CH3(g)未使用催化剂和使用催化剂时反应过程中的能量变化
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.在一定条件下,某可逆反应的ΔH=+100 kJ·mol-1,则该反应的正反应活化能比逆反应活化能大100 kJ·mol-1
4.烯酮是许多天然产物和医药分子的重要合成砌块。通过向烯酮类分子的烯丙位引入羟基官能团,可以改善其物理和生物性质。一种机理:首先在受光激发之后,激发态的Na2-eosinY*与O2发生能量转移产生1O2。随后1O2与Na2-eosinY作用产生溴自由基,进一步发生反应。下列说法错误的是
A.Na2-eosinY在反应体系中作光催化剂并提供溴源
B.溴自由基容易转化成溴单质,所以需要持续的光照(455 m LEDs)使溴单质向着均裂成溴自由基的方向移动
C.过氧自由基B产生酮产物3b的途径有2种
D.氢过氧化物C生成目标醇产物2b,需要加入氧化剂
5.盐酸与K2CO3粉末反应时,能使反应的最初速率明显加快的是
A.将盐酸的用量增加一倍
B.盐酸的浓度增加一倍,用量减半
C.增大压强
D.增加少量K2CO3粉末
6.氮及其化合物的转化过程如图所示。下列分析合理的是
A.催化剂a降低了N2的键能,加快了反应速率
B.N2与H2反应生成NH3的原子利用率为100%
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
7.100℃时,在不同金属离子存在下,过氧化氢经过24h的分解率如下表所示:
离子 加入量(mg·L-1) 分解率/% 离子 加入量(mg·L-1) 分解率/%
无 2 Fe2+ 1.0 15
Al3+ 10 2 Cu2+ 0.1 86
Zn2+ 10 10 Cr3+ 0.1 96
下列有关说法正确的是
A.能使过氧化氢分解反应活化能降低最多的离子是Al3+
B.催化剂可以使平衡移动,提高过氧化氢的分解率
C.若向过氧化氢中加入水,过氧化氢的分解速率加快
D.用等量H2O2制O2时,与自身分解相比,加入足量酸性KMnO4溶液可得到更多O2
8.采取下列措施对增大化学反应速率有明显效果的是
A.N2和H2合成NH3时,不断分离出产物NH3
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.Na2SO4溶液与BaCl2溶液反应时,增大压强
D.大理石与盐酸反应制取CO2时,将块状大理石改为粉末状大理石
9.下列实验方法或装置正确的是
A B C D
验证气体易溶于水 探究固体表面积对反应速率的影响 制取少量乙酸乙酯 测定中和热
A.A B.B C.C D.D
10.可逆反应A(g)+3B(g)2C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是
A.v(A)=0.25mol·L-1·s-1 B.v(B)=0.6mol·L-1·s-1
C.v(C)=0.3mol·L-1·s-1 D.v(D)=0.4mol·L-1·s-1
11.丙烯与HCl在催化剂作用下发生加成反应:第一步H+进攻丙烯生成碳正离子,第二步Cl-进攻碳正离子。得到两种碳正离子的反应进程与能量关系如图。
下列说法不正确的是
A.催化剂可以使生成①过程的活化能降低
B.过渡态(Ⅰ)比过渡态(Ⅱ)稳定
C.生成①的过程所需的活化能较高,速率慢
D.丙烯与HCl加成反应主要生成
12.某温度下,体积一定的密闭容器中进行反应:,下列叙述错误的是
A.升高温度,正反应速率增大,逆反应速率减小
B.混合气体密度不变时,能说明反应已达到平衡
C.向容器中加入氩气,反应速率不变
D.加入催化剂,可增大单位体积内活化分子数,有效碰撞次数增大
13.运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法不正确的是
A.HCOOH吸附在催化剂表面是一个放热过程
B. HCOO是该历程的决速步骤
C.该反应过程中存在C-H断裂和C=O键的生成
D.Pd和Rh作催化剂时改变了HCOOH分解产生的反应热
14.为研究碳酸钙与稀盐酸的反应速率,标准状况下测得生成CO2体积随时间变化情况如图所示,下列分析正确的是
A.FG段的反应速率最快
B.F点收集到CO2的量最多
C.影响EF段反应速率的主要因素是c(HCl)
D.OE、EF、FG三段中,CO2的生成速率之比为2:4:1
15.下列对有关事实或解释不正确的
选项 事实 解释
A 用铝粉代替铝片与稀盐酸反应,反应速率加快 改用铝粉,固体表面积增大,故反应速率加快
B 5%的双氧水中加入二氧化锰粉末,分解速率迅速加快 降低了反应的焓变,活化分子数增多,有效碰撞增多,速率加快
C 锌与稀硫酸反应,滴入少量硫酸铜溶液,生成氢气的速率加快 锌置换出铜,形成原电池,反应速率加快
D 密闭容器中反应:,当温度、压强不变,充入惰性气体,反应速率减慢 容器体积增大,反应物浓度减小,反应速率减慢
A.A B.B C.C D.D
16.向恒容密闭容器中加入适量催化剂,并充入一定量的H2和CO合成甲醇:2H2(g)+CO(g) CH3OH(g),单位时间内,CO的转化率[α(CO)]与反应温度的变化关系如图所示,温度为T1~T2℃时,CO的转化率降低,原因是 。
17.向某浓度的盐酸中加入一定量的纯净,产生气体的体积随时间的变化曲线如图所示,已知随着反应的进行,反应体系温度逐渐升高(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设段的反应速率为,段的反应速率为,段的反应速度为,则从大到小的顺序为 ;试分析三个时段速率不同的可能原因 。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 。
A.蒸馏水 B.氯化钾固体 C.氯化钠溶液 D.浓盐酸
(3)在盛有碳、的密闭容器中,充入,一定条件下发生,反应时测得的物质的量为。则在内的化学反应速率为 。
18.某探究小组利用丙酮的溴代反应:CH3COCH3+Br2CH3COCH2Br+HBr。研究反应物浓度与反应速率的关系。反应速率v通过测定溴的颜色消失所需的时间来确定,在一定温度下,获得如下实验数据:
实验序号 初始浓度c/mol L-1 溴颜色消失所需时间t/s
CH3COCH3 HCl Br2
① 0.80 0.20 0.0010 290
② 1.60 x 0.0010 145
③ y 0.40 0.0010 145
④ 0.80 0.20 0.0020 580
⑤ 0.80 0.20 0.0040 t1
(1)表格中x=___,y=___。
(2)已知该反应速率方程:v=kca(CH3COCH3)cb(HCl)cd(Br2),其中k为仅与温度有关的速率常数。由上表数据可推测出a=___,b=___,d=___。
(3)t1=___。已知反应物分子一步直接转化为产物的反应称为基元反应,则该反应(填“是”或“不是”)___基元反应。
19.某温度下,反应2A(g)B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g)。20s时测得各组分的物质的量如下表,则反应前20s的平均速率为 ,正反应速率 逆反应速率。
物质 A(g) B(g) C(g)
物质的量/mol 1.2 0.6 0.6
20.提高合成氨反应速率: 、 、 、 。
参考答案:
1.D2.D3.D4.D5.B6.B7.D8.D9.A10.A11.B12.A13.D14.D15.B
16.催化剂的活性降低,反应速率减小
17. 段反应物浓度较大,速率较快;段反应物浓度减小,但速率较快,说明反应放热,温度升高,反应速率增大;段反应物浓度减小,反应速率减慢。 AC
18.(1)0.20 0.80
(2)1 1 0
(3)1160 不是
19. 0.03mol·L-1·s-1 大于
20. 高压 高温 催化剂 V(N2):V(H2)=1:2.8
