2.1.2影响化学反应速率的因素同步练习(含答案)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2影响化学反应速率的因素同步练习(含答案)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 833.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-04 23:35:08 | ||
图片预览


文档简介
2.1.2影响化学反应速率的因素
同步练习
1.一定温度下,10mL0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
B.4~6min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·s)
C.反应至6min时,c(H2O2)=0.20mol/L
D.反应至6min时,H2O2分解了40%
2.已知的速率方程为。,为探究反应速率与的关系,进行如下实验:向锥形瓶中加入一定体积(V)的2.0 mol L 溶液、2.0 mol L 溶液、1.0 mol L醋酸和水,充分搅拌,保持体系温度为36℃,用秒表测量收集1.0 mL 所需要的时间(t),实验数据如下表。下列说法正确的是
实验 V/mL t/s
溶液 溶液 醋酸 水
1 4.0 4.0 8.0 332
2 6.0 4.0 4.0 6.0 148
3 4.0 4.0 4.0 83
4 12.0 4.0 4.0 37
A.;
B.实验3用表示的反应平均速率mol·s
C.醋酸不参与反应,其浓度的大小对该反应速率无影响
D.速率方程中
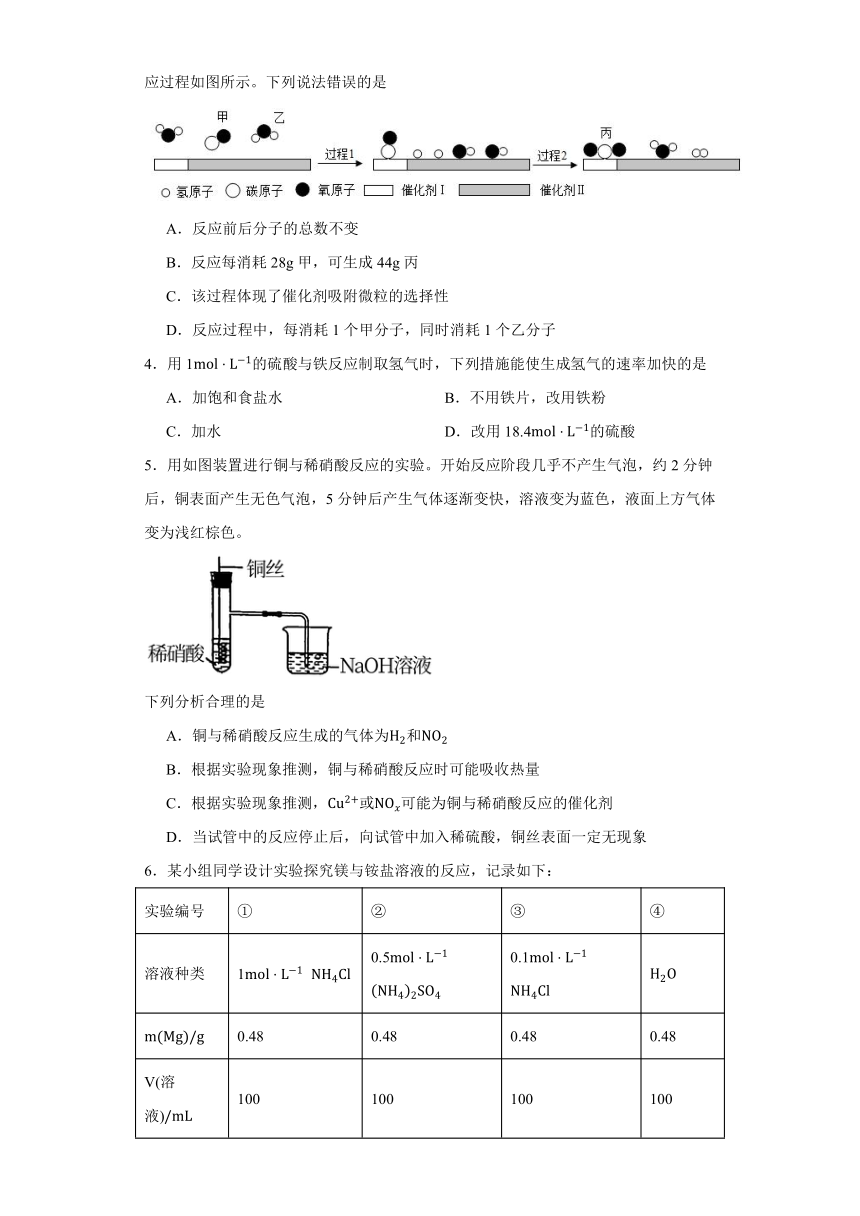
3.我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是
A.反应前后分子的总数不变
B.反应每消耗28g甲,可生成44g丙
C.该过程体现了催化剂吸附微粒的选择性
D.反应过程中,每消耗1个甲分子,同时消耗1个乙分子
4.用1的硫酸与铁反应制取氢气时,下列措施能使生成氢气的速率加快的是
A.加饱和食盐水 B.不用铁片,改用铁粉
C.加水 D.改用18.4的硫酸
5.用如图装置进行铜与稀硝酸反应的实验。开始反应阶段几乎不产生气泡,约2分钟后,铜表面产生无色气泡,5分钟后产生气体逐渐变快,溶液变为蓝色,液面上方气体变为浅红棕色。
下列分析合理的是
A.铜与稀硝酸反应生成的气体为和
B.根据实验现象推测,铜与稀硝酸反应时可能吸收热量
C.根据实验现象推测,或可能为铜与稀硝酸反应的催化剂
D.当试管中的反应停止后,向试管中加入稀硫酸,铜丝表面一定无现象
6.某小组同学设计实验探究镁与铵盐溶液的反应,记录如下:
实验编号 ① ② ③ ④
溶液种类 1 0.5 0.1
0.48 0.48 0.48 0.48
V(溶液) 100 100 100 100
实验现象 有气体产生,并产生白色沉淀 有气体产生,并产生白色沉淀 有气体产生,并产生白色沉淀 几乎看不到现象
6h时 433 255 347 12
根据上述实验所得结论正确的是
A.实验②中发生的反应为
B.由实验①、③可得,溶液中越大,反应速率越快
C.由实验①、②可得,溶液中阴离子的种类对产生的速率有影响
D.由实验①~④可得,溶液的越小,产生的速率越快
7.T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示,则下列结论正确的是
A.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
B.反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.保持其他条件不变,升高温度,反应的化学平衡常数K增大
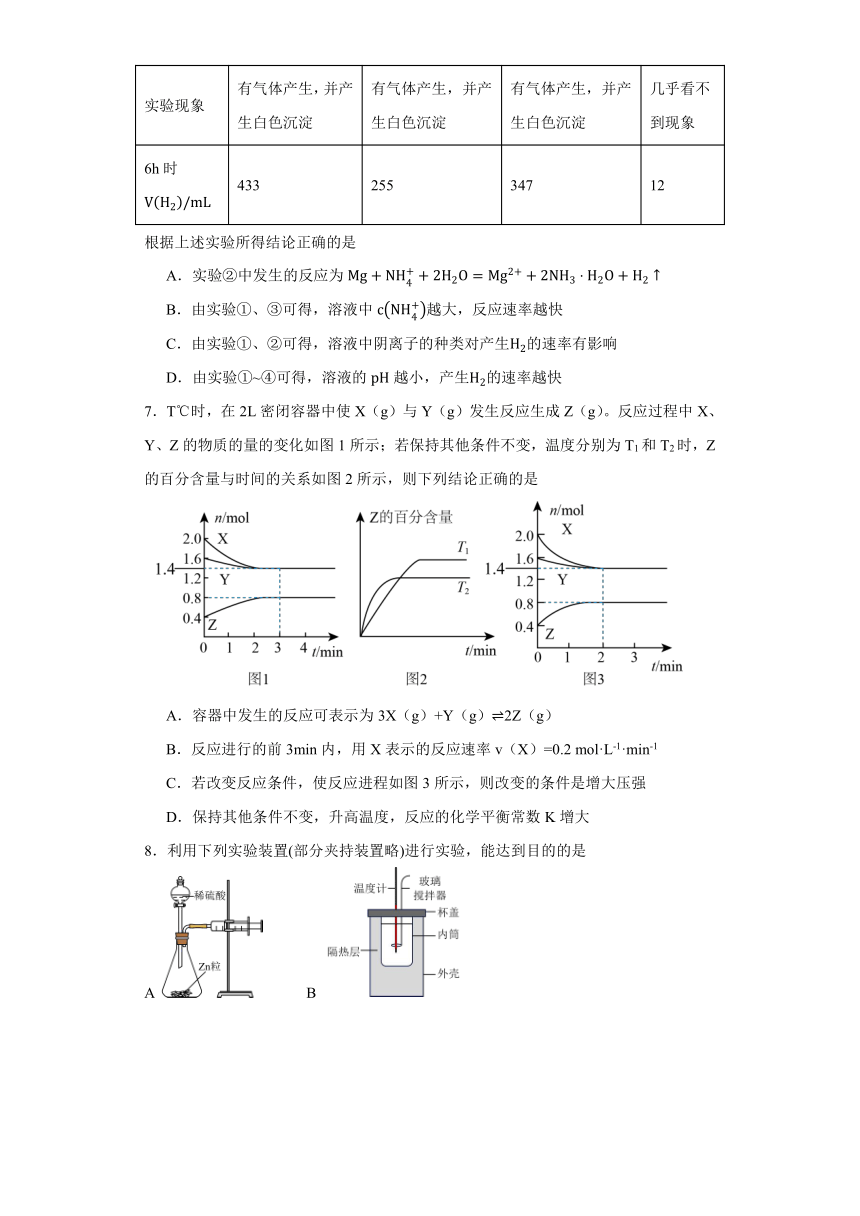
8.利用下列实验装置(部分夹持装置略)进行实验,能达到目的的是
A B
C D
A.利用针筒活塞向右移动,证明反应放热 B.测定酸碱中和反应的反应热
C.验证不同催化剂对化学反应速率的影响 D.制备并收集 NO2
9.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高反应物的转化率
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
10.在Fe+作用下,CO与N2O发生如下两步基元反应,能量变化及反应历程如图所示。
①N2O+Fe+=N2+FeO+(慢)
②FeO++CO=CO2+Fe+(快)
下列说法不正确的是
A.Fe+降低总反应的活化能
B.反应②是非氧化还原反应
C.总反应的化学反应速率由反应①决定
D.总反应中每转移1mole-,在标准状况下生成11.2LN2
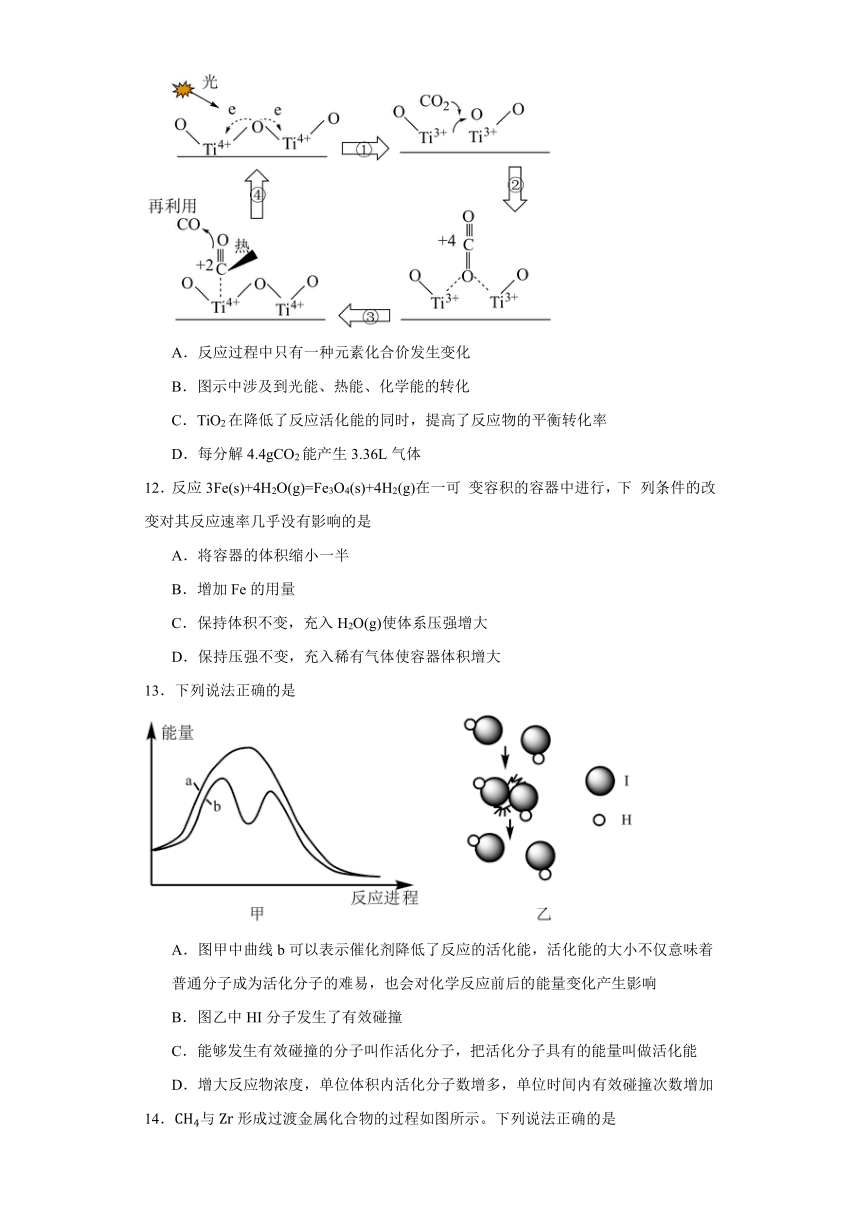
11.为早日实现“双碳”目标,科学家提出以TiO2为催化剂,用光热化学循环分解法减少大气中CO2含量,反应机理如图所示。下列说法正确的是
A.反应过程中只有一种元素化合价发生变化
B.图示中涉及到光能、热能、化学能的转化
C.TiO2在降低了反应活化能的同时,提高了反应物的平衡转化率
D.每分解4.4gCO2能产生3.36L气体
12.反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)在一可 变容积的容器中进行,下 列条件的改变对其反应速率几乎没有影响的是
A.将容器的体积缩小一半
B.增加Fe的用量
C.保持体积不变,充入H2O(g)使体系压强增大
D.保持压强不变,充入稀有气体使容器体积增大
13.下列说法正确的是
A.图甲中曲线b可以表示催化剂降低了反应的活化能,活化能的大小不仅意味着普通分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
B.图乙中HI分子发生了有效碰撞
C.能够发生有效碰撞的分子叫作活化分子,把活化分子具有的能量叫做活化能
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
14.与形成过渡金属化合物的过程如图所示。下列说法正确的是
A.整个反应的快慢由状态2的速率决定
B.总反应的
C.反应过程中有非极性键的断裂
D.稳定性:
15.下列有关实验操作和现象的说法,不正确的是
A.研究浓度对反应速率的影响:向两支分别盛有2mL和1mL 0. 1mol/L Na2S2O3溶液的试管中,同时加入相同体积的0. 1mol/L的稀硫酸,观察乳白色浑浊出现所需时间长短
B.硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中
C.把充满SO2、塞有橡胶塞的试管倒立在水中,打开塞子,试管内液面会缓慢上升
D.钠与水反应的实验后,多余的钠放回试剂瓶中
16.回答下列问题:
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应,探究浓度和温度对化学反应速率的影响,进行了如下实验:
实验序号 反应温度/K 稀H2SO4 Na2S2O3溶液 H2O
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
A 298 5 0.10 10 0.10 0
B T1 5 0.10 4 0.10 V1
C 313 5 0.10 V2 0.10 6
①写出该反应的离子方程式: 。
②实验A、B可探究 对反应速率的影响,因此V1= ,T1= ,V2= 。
(2)取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中前,B试管中产生气体的速率较慢且量少的原因可能为 ,后,B试管中产生气体的速率较快且量多的原因可能为 。
17.水溶性硝态氮(以NO、NO等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
(1)在反硝化细菌作用下,用葡萄糖处理酸性废水中的NO,产生两种对大气无污染的气体。该反应的离子方程式为 。
(2)纳米铁铜双金属有巨大的比表面积和很高的反应活性,可用于水体脱硝。
① 纳米铁铜双金属与普通铁铜双金属脱硝效果(以处理某硝酸盐为例)如图-1所示。在0到20min内,纳米铁铜双金属脱硝效果显著,其原因可能是 。
② 研究表明水体中溶解氧的存在降低了纳米铁铜双金属脱硝的效果,验证的实验方案是 。
(3)Jetten 等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和NO的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为 、 。
18.合成氨是人类科学技术发展史上的一项重大突破.合成氨反应的化学方程式为N2(g)+3H2(g)==2NH3(g).一定条件下,在容积固定的密闭容器中反应达平衡后,请回答
(1)若增大N2的浓度,则化学反应速率 (填“增大”或“减小”),化学平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(2)若加入适当的催化剂,则化学反应速率 (填“增大”或“减小”),化学平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(3)若增大NH3的浓度,则化学反应速率 (填“增大”或“减小”),化学平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
19.在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一,甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应Ⅰ CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
反应Ⅱ CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
反应ⅢCO(g) +H2O(g) CO2(g) +H2(g) ΔH3
已知部分化学键的键能数据如下表:
化学键 O-H H-H C=O C≡O( CO)
键能/(kJ·mol -1) 463 436 803 1075
则ΔH3= ,若反应Ⅲ的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= kJ·mol-1。
20.Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为 (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
该历程中,放热最多的步骤的化学方程式为 。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式 。
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式 。
Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是 。
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
参考答案:
1.D2.D3.C4.B5.C6.C7.A8.B9.D10.B11.B12.B13.D14.A15.A
16.(1) +2H+=S↓+SO2↑+H2O 浓度 6 298 4
(2) 氯酸钾自身受热分解很缓慢 高锰酸钾的分解产物对氯酸钾的分解起到了催化作用
17.(1)5C6H12O6+24NO+24H+ 12N2↑+30CO2↑+42H2O.
(2) 纳米铁铜双金属的比表面积大,能吸附废水中更多的硝态氮;纳米铁铜双金属颗粒更小,表面的反应活性点更多(或还原性更强);纳米铁铜双金属能形成更多的微小原电池,短时间内反应速率更快 向两支试管中分别加入等体积硝态氮废水,同时通入相同时间的足量的空气和氮气;停止通气后,向两支试管中加入等量的纳米铁铜双金属,相同时间后,测定两份废水中硝态氮的含量,比较有氧和无氧环境中的脱氮率
(3) 在NR酶的作用下,NO在酸性介质中(结合H+)得电子生成NH2OH(和H2O)(或NO+5H++4e-=NH2OH+H2O) 在HH酶的作用下,NH2OH和NH3转化为N2H4(和H2O)(或NH2OH+NH3=N2H4+H2O)
18. 增大 向正反应方向 增大 不 增大 向逆反应方向
19. -41kJ/mol 124
20. A CHO*+3H*=CO*+4H*(或CHO*=CO*+H*) TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH=-45.5 kJ/mol 2H2+2NO=N2+2H2O CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ/mol ACE
同步练习
1.一定温度下,10mL0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
B.4~6min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·s)
C.反应至6min时,c(H2O2)=0.20mol/L
D.反应至6min时,H2O2分解了40%
2.已知的速率方程为。,为探究反应速率与的关系,进行如下实验:向锥形瓶中加入一定体积(V)的2.0 mol L 溶液、2.0 mol L 溶液、1.0 mol L醋酸和水,充分搅拌,保持体系温度为36℃,用秒表测量收集1.0 mL 所需要的时间(t),实验数据如下表。下列说法正确的是
实验 V/mL t/s
溶液 溶液 醋酸 水
1 4.0 4.0 8.0 332
2 6.0 4.0 4.0 6.0 148
3 4.0 4.0 4.0 83
4 12.0 4.0 4.0 37
A.;
B.实验3用表示的反应平均速率mol·s
C.醋酸不参与反应,其浓度的大小对该反应速率无影响
D.速率方程中
3.我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是
A.反应前后分子的总数不变
B.反应每消耗28g甲,可生成44g丙
C.该过程体现了催化剂吸附微粒的选择性
D.反应过程中,每消耗1个甲分子,同时消耗1个乙分子
4.用1的硫酸与铁反应制取氢气时,下列措施能使生成氢气的速率加快的是
A.加饱和食盐水 B.不用铁片,改用铁粉
C.加水 D.改用18.4的硫酸
5.用如图装置进行铜与稀硝酸反应的实验。开始反应阶段几乎不产生气泡,约2分钟后,铜表面产生无色气泡,5分钟后产生气体逐渐变快,溶液变为蓝色,液面上方气体变为浅红棕色。
下列分析合理的是
A.铜与稀硝酸反应生成的气体为和
B.根据实验现象推测,铜与稀硝酸反应时可能吸收热量
C.根据实验现象推测,或可能为铜与稀硝酸反应的催化剂
D.当试管中的反应停止后,向试管中加入稀硫酸,铜丝表面一定无现象
6.某小组同学设计实验探究镁与铵盐溶液的反应,记录如下:
实验编号 ① ② ③ ④
溶液种类 1 0.5 0.1
0.48 0.48 0.48 0.48
V(溶液) 100 100 100 100
实验现象 有气体产生,并产生白色沉淀 有气体产生,并产生白色沉淀 有气体产生,并产生白色沉淀 几乎看不到现象
6h时 433 255 347 12
根据上述实验所得结论正确的是
A.实验②中发生的反应为
B.由实验①、③可得,溶液中越大,反应速率越快
C.由实验①、②可得,溶液中阴离子的种类对产生的速率有影响
D.由实验①~④可得,溶液的越小,产生的速率越快
7.T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示,则下列结论正确的是
A.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
B.反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.保持其他条件不变,升高温度,反应的化学平衡常数K增大
8.利用下列实验装置(部分夹持装置略)进行实验,能达到目的的是
A B
C D
A.利用针筒活塞向右移动,证明反应放热 B.测定酸碱中和反应的反应热
C.验证不同催化剂对化学反应速率的影响 D.制备并收集 NO2
9.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高反应物的转化率
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
10.在Fe+作用下,CO与N2O发生如下两步基元反应,能量变化及反应历程如图所示。
①N2O+Fe+=N2+FeO+(慢)
②FeO++CO=CO2+Fe+(快)
下列说法不正确的是
A.Fe+降低总反应的活化能
B.反应②是非氧化还原反应
C.总反应的化学反应速率由反应①决定
D.总反应中每转移1mole-,在标准状况下生成11.2LN2
11.为早日实现“双碳”目标,科学家提出以TiO2为催化剂,用光热化学循环分解法减少大气中CO2含量,反应机理如图所示。下列说法正确的是
A.反应过程中只有一种元素化合价发生变化
B.图示中涉及到光能、热能、化学能的转化
C.TiO2在降低了反应活化能的同时,提高了反应物的平衡转化率
D.每分解4.4gCO2能产生3.36L气体
12.反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)在一可 变容积的容器中进行,下 列条件的改变对其反应速率几乎没有影响的是
A.将容器的体积缩小一半
B.增加Fe的用量
C.保持体积不变,充入H2O(g)使体系压强增大
D.保持压强不变,充入稀有气体使容器体积增大
13.下列说法正确的是
A.图甲中曲线b可以表示催化剂降低了反应的活化能,活化能的大小不仅意味着普通分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
B.图乙中HI分子发生了有效碰撞
C.能够发生有效碰撞的分子叫作活化分子,把活化分子具有的能量叫做活化能
D.增大反应物浓度,单位体积内活化分子数增多,单位时间内有效碰撞次数增加
14.与形成过渡金属化合物的过程如图所示。下列说法正确的是
A.整个反应的快慢由状态2的速率决定
B.总反应的
C.反应过程中有非极性键的断裂
D.稳定性:
15.下列有关实验操作和现象的说法,不正确的是
A.研究浓度对反应速率的影响:向两支分别盛有2mL和1mL 0. 1mol/L Na2S2O3溶液的试管中,同时加入相同体积的0. 1mol/L的稀硫酸,观察乳白色浑浊出现所需时间长短
B.硝酸应保存在棕色、细口、带玻璃塞的试剂瓶中
C.把充满SO2、塞有橡胶塞的试管倒立在水中,打开塞子,试管内液面会缓慢上升
D.钠与水反应的实验后,多余的钠放回试剂瓶中
16.回答下列问题:
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应,探究浓度和温度对化学反应速率的影响,进行了如下实验:
实验序号 反应温度/K 稀H2SO4 Na2S2O3溶液 H2O
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
A 298 5 0.10 10 0.10 0
B T1 5 0.10 4 0.10 V1
C 313 5 0.10 V2 0.10 6
①写出该反应的离子方程式: 。
②实验A、B可探究 对反应速率的影响,因此V1= ,T1= ,V2= 。
(2)取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中前,B试管中产生气体的速率较慢且量少的原因可能为 ,后,B试管中产生气体的速率较快且量多的原因可能为 。
17.水溶性硝态氮(以NO、NO等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
(1)在反硝化细菌作用下,用葡萄糖处理酸性废水中的NO,产生两种对大气无污染的气体。该反应的离子方程式为 。
(2)纳米铁铜双金属有巨大的比表面积和很高的反应活性,可用于水体脱硝。
① 纳米铁铜双金属与普通铁铜双金属脱硝效果(以处理某硝酸盐为例)如图-1所示。在0到20min内,纳米铁铜双金属脱硝效果显著,其原因可能是 。
② 研究表明水体中溶解氧的存在降低了纳米铁铜双金属脱硝的效果,验证的实验方案是 。
(3)Jetten 等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和NO的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为 、 。
18.合成氨是人类科学技术发展史上的一项重大突破.合成氨反应的化学方程式为N2(g)+3H2(g)==2NH3(g).一定条件下,在容积固定的密闭容器中反应达平衡后,请回答
(1)若增大N2的浓度,则化学反应速率 (填“增大”或“减小”),化学平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(2)若加入适当的催化剂,则化学反应速率 (填“增大”或“减小”),化学平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
(3)若增大NH3的浓度,则化学反应速率 (填“增大”或“减小”),化学平衡 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
19.在碳中和背景下,氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高,仍是目前氢能产业发展的挑战之一,甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应Ⅰ CH4(g) +H2O(g) CO(g) +3H2(g) ΔH1>0
反应Ⅱ CH4(g) +2H2O(g) CO2(g) +4H2(g) ΔH2>0
反应ⅢCO(g) +H2O(g) CO2(g) +H2(g) ΔH3
已知部分化学键的键能数据如下表:
化学键 O-H H-H C=O C≡O( CO)
键能/(kJ·mol -1) 463 436 803 1075
则ΔH3= ,若反应Ⅲ的正反应活化能Ea(正) =83 kJ· mol-1,则逆反应活化能Ea(逆)= kJ·mol-1。
20.Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为 (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
该历程中,放热最多的步骤的化学方程式为 。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式 。
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式 。
Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是 。
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
参考答案:
1.D2.D3.C4.B5.C6.C7.A8.B9.D10.B11.B12.B13.D14.A15.A
16.(1) +2H+=S↓+SO2↑+H2O 浓度 6 298 4
(2) 氯酸钾自身受热分解很缓慢 高锰酸钾的分解产物对氯酸钾的分解起到了催化作用
17.(1)5C6H12O6+24NO+24H+ 12N2↑+30CO2↑+42H2O.
(2) 纳米铁铜双金属的比表面积大,能吸附废水中更多的硝态氮;纳米铁铜双金属颗粒更小,表面的反应活性点更多(或还原性更强);纳米铁铜双金属能形成更多的微小原电池,短时间内反应速率更快 向两支试管中分别加入等体积硝态氮废水,同时通入相同时间的足量的空气和氮气;停止通气后,向两支试管中加入等量的纳米铁铜双金属,相同时间后,测定两份废水中硝态氮的含量,比较有氧和无氧环境中的脱氮率
(3) 在NR酶的作用下,NO在酸性介质中(结合H+)得电子生成NH2OH(和H2O)(或NO+5H++4e-=NH2OH+H2O) 在HH酶的作用下,NH2OH和NH3转化为N2H4(和H2O)(或NH2OH+NH3=N2H4+H2O)
18. 增大 向正反应方向 增大 不 增大 向逆反应方向
19. -41kJ/mol 124
20. A CHO*+3H*=CO*+4H*(或CHO*=CO*+H*) TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH=-45.5 kJ/mol 2H2+2NO=N2+2H2O CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ/mol ACE
