2.1.2 一种重要的混合物——胶体 课件(共30页) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.1.2 一种重要的混合物——胶体 课件(共30页) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 00:14:22 | ||
图片预览










文档简介
(共30张PPT)
第2课时
一种重要的混合物——胶体
第2章 第1节
1.熟知溶液、浊液、胶体三种分散系的本质区别(重点)。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶
液,会分离提纯胶体(难点)。
学习目标
联想·质疑
清晨当太阳升起时,漫步在茂密的树林里,会看到一缕缕阳光穿过枝叶间隙洒在地面上;晚上,当你欣赏都市夜景时,你会看到一道道“光柱”射向远方,你知道为什么会产生这美丽的景象吗?
这些都与一种特殊的混合物有关
胶体的特征和性质
一
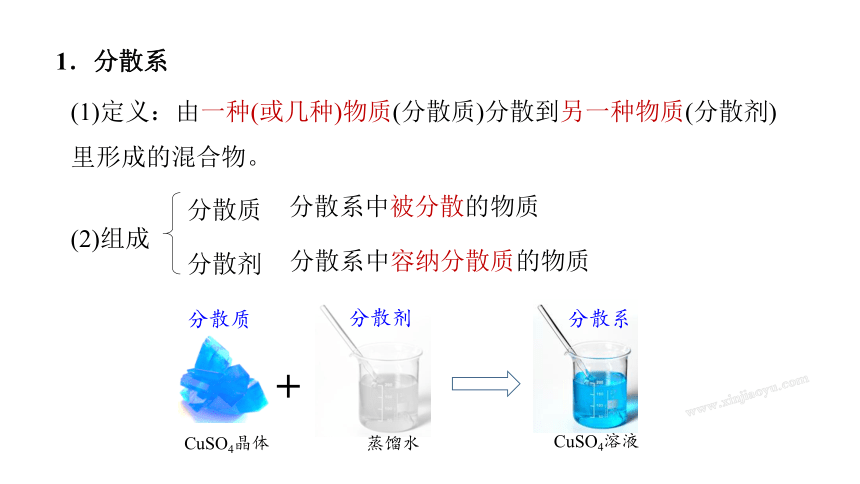
1.分散系
(2)组成
分散质
分散剂
(1)定义:由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的混合物。
CuSO4溶液
蒸馏水
+
CuSO4晶体
分散质
分散剂
分散系
分散系中被分散的物质
分散系中容纳分散质的物质
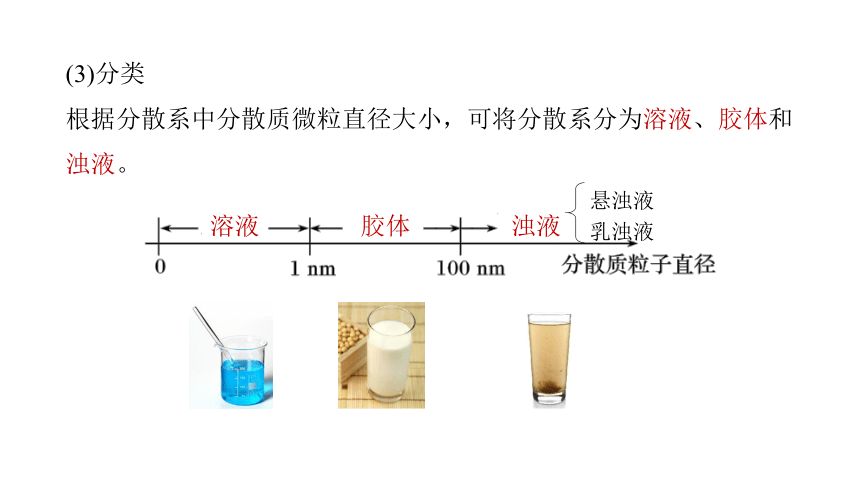
(3)分类
根据分散系中分散质微粒直径大小,可将分散系分为溶液、胶体和浊液。
溶液
胶体
浊液
悬浊液
乳浊液
2.胶体
(1)定义:分散质的微粒直径介于1~100 nm的分散系。
(2)分类:依据分散剂状态分为气溶胶、液溶胶、固溶胶。
比如云、雾、烟的分散剂是空气,分散质微粒是微小的液滴或固体颗粒,属于气溶胶。
雾
烟
云
颗粒直径介于1~100 nm的物质为胶体,这种说法对吗?若不对,请加以解释。
思考1
提示 不对,胶体是分散质粒子的直径介于1~100 nm的分散系,并不是说颗粒直径介于1~100 nm的物质就是胶体,如果是单一物质就不是胶体。例如不能说粒子直径介于1~100 nm的氢氧化铁是胶体。
蛋白质分子与淀粉分子的大小都在几十纳米左右,则淀粉溶液、豆浆、牛奶都是胶体吗?
思考2
提示 是,分散质粒子的直径介于1~100 nm时形成的分散系称为胶体。
3.胶体的性质
(1)渗析
①概念
胶体的分散质微粒不能透过半透膜,而小分子、离子能够透过半透膜,因此可以利用半透膜分离胶体中的杂质分子或离子。这种提纯、精制胶体的方法称为渗析。
②操作
如图除去Fe(OH)3胶体中的FeCl3,将混合物盛于半透膜制作的渗析袋中,置于流动(或频繁更换)的蒸馏水里一段时间即可。
半透膜是一种比滤纸孔隙更小,只能允许小分子或离子扩散进出的薄膜。
动物肠衣
鸡蛋壳膜
如何证明Cl-透过半透膜?
思考3
提示 取渗析后蒸馏水中的少许液体,滴加少量AgNO3溶液,若产生白色沉淀,证明Cl-已透过半透膜。
(2)丁达尔现象或丁达尔效应
操作 从垂直于光线的 方向观察现象 原因分析
可见光源
碘化银胶体
可见光源
盐酸
一条光亮的通路
(丁达尔效应或丁达尔现象)
胶粒的直径为10-9~10-7 m,能对光线散射
溶液中粒子的直径小于10-9 m,散射极其微弱
无明显现象
特别提醒
(1)丁达尔效应是光的散射,属于物理变化。
(2)观察丁达尔效应时应从可见光束的侧面。
(1)结合上面渗析操作图,如何证明Fe(OH)3胶体没有透过半透膜?
思考4
提示 用可见光源照射烧杯中的液体,从侧面不能看到光亮的通路。
(2)基于以上实验探究,思考如何用简便方法区分胶体和溶液?
提示 利用丁达尔效应区分胶体和溶液。
应用体验
1.判断正误
(1)氯化钠溶液均一、稳定、透明,不是分散系
(2)分散系有的是纯净物,有的是混合物
(3)根据能否发生丁达尔现象将分散系分为浊液、溶液和胶体
(4)油水混合物属于乳浊液
×
×
√
×
应用体验
2.如图所示,家庭小实验制得的分散系按分散质粒子大小分类,指明属于哪种分散系(填字母),并回答相关问题。
(1)①溶液: 。②浊液: 。③胶体: 。
AD
BC
EF
应用体验
答案 三者分散系类型不完全相同,食盐水为溶液、碳素墨水和稀牛奶为胶体,本质区别是它们的分散质粒子直径不同,如图:
(2)食盐水、碳素墨水和稀牛奶从外观上看都是均一透明的,三者分散系类型相同吗?根本区别是什么?
归纳总结
溶液、胶体和浊液三种分散系的比较
类型 特征 溶液 胶体 浊液
悬浊液 乳浊液
分散质 微粒直 径大小 <1 nm 1~100 nm >100 nm >100 nm
微粒结构 分子、离子 较多分子的集合体或大分子 大量分子或离子聚集成的固体颗粒 大量分子或离子聚集成的液滴
归纳总结
分散质性质 特点 均一、透明 多数均一、透明 不均一、不透明,久置沉淀 不均一、不透明,久置分层
稳定性 稳定 介稳性 不稳定 不稳定
能否透过滤纸 能 能 不能 -
实例 食盐水、蔗糖溶液、酒精 Fe(OH)3胶体、淀粉胶体 泥水、石灰乳 油水混合物
胶体的制备及应用
1.Fe(OH)3胶体的制备
如图所示,向沸水中逐滴加入1~2 mL饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色,停止加热,反应的化学方程式为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl。
特别提醒
(1)本实验用蒸馏水,不能用自来水,自来水含HCl能等使胶体聚沉;不能过度加热,也不能搅拌,以免Fe(OH)3胶体发生聚沉。
(2)化学方程式不用“ ”和“↓”等符号。
思考
(1)如何检验制备的红褐色液体为Fe(OH)3胶体?
提示 用一束可见光线照射,从侧面观察,若出现一道光亮的通路,则证明成功制得胶体。
(2)含1 mol Fe(OH)3胶粒的胶体中,Fe(OH)3分子个数为NA吗?
提示 不是,Fe(OH)3胶粒为Fe(OH)3分子集合体,1 mol Fe(OH)3胶粒中Fe(OH)3分子个数大于NA。
2.胶体的其他性质
电泳
定义:
原因:
应用:
在通电的情况下,胶体粒子发生定向移动的现象。
胶体的分散质具有巨大的比表面积,能吸附带有某种电荷的离子,从而形成带电微粒。
工业上用于电泳电镀、电泳除尘等。
通电前
通电后
﹣
﹢
氢氧化铁胶体的电泳现象
聚沉
定义:
原因:
应用:
在一定条件下胶体的分散质微粒聚集成较大的微粒,在重力作用下沉淀析出的现象。
①加入酸、碱或盐等物质
②加热
③搅拌
豆腐的制作,黄河三角洲的形成等
氢氧化铁胶体的聚沉
加入Na2SO4溶液
3.胶体的应用
(1)将盐卤或石膏加入豆浆,制成豆腐。
(2)一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞。
(3)工厂常利用高压静电除大量烟尘。
(4)手被割破时,可用FeCl3溶液应急止血。
(5)海河交界处易形成三角洲。
(6)医疗上的血液透析。
(7)明矾常用作净水剂。
特别提醒
(1)明矾做净水剂是利用明矾溶于水能形成Al(OH)3胶体,胶体具有吸附性,但胶体没有杀菌消毒的作用。
(2)胶体不带电荷,胶体微粒(分散质微粒)可能带电荷,例如金属氢氧化物等的胶体微粒带正电荷、淀粉胶体中的胶体微粒不带电荷。
应用体验
1.判断正误
(1)医疗上的血液透析利用了胶体的性质
(2)放电影时,放映机前的一条光亮的“通路”,是气溶胶发生的丁达尔现象
(3)胶体带电荷,在通电时会发生电泳现象
(4)胶体在一定条件下发生聚沉,属于化学变化
×
√
×
√
应用体验
2.(2022·福建师大附中高一期末)下列关于胶体的叙述不正确的是
A.光线通过时,胶体发生丁达尔效应,溶液不能发生丁达尔效应
B.可以用滤纸通过过滤的方法,将胶体中的胶体粒子分离出来
C.渗析是用半透膜把小分子或离子从胶体中分离出来,达到净化胶体的
目的
D.将饱和FeCl3溶液滴入沸水中,继续加热煮沸得到红褐色液体即可制
备Fe(OH)3胶体
√
溶液中的粒子和胶体中的粒子都能透过滤纸
第2课时
一种重要的混合物——胶体
第2章 第1节
1.熟知溶液、浊液、胶体三种分散系的本质区别(重点)。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶
液,会分离提纯胶体(难点)。
学习目标
联想·质疑
清晨当太阳升起时,漫步在茂密的树林里,会看到一缕缕阳光穿过枝叶间隙洒在地面上;晚上,当你欣赏都市夜景时,你会看到一道道“光柱”射向远方,你知道为什么会产生这美丽的景象吗?
这些都与一种特殊的混合物有关
胶体的特征和性质
一
1.分散系
(2)组成
分散质
分散剂
(1)定义:由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的混合物。
CuSO4溶液
蒸馏水
+
CuSO4晶体
分散质
分散剂
分散系
分散系中被分散的物质
分散系中容纳分散质的物质
(3)分类
根据分散系中分散质微粒直径大小,可将分散系分为溶液、胶体和浊液。
溶液
胶体
浊液
悬浊液
乳浊液
2.胶体
(1)定义:分散质的微粒直径介于1~100 nm的分散系。
(2)分类:依据分散剂状态分为气溶胶、液溶胶、固溶胶。
比如云、雾、烟的分散剂是空气,分散质微粒是微小的液滴或固体颗粒,属于气溶胶。
雾
烟
云
颗粒直径介于1~100 nm的物质为胶体,这种说法对吗?若不对,请加以解释。
思考1
提示 不对,胶体是分散质粒子的直径介于1~100 nm的分散系,并不是说颗粒直径介于1~100 nm的物质就是胶体,如果是单一物质就不是胶体。例如不能说粒子直径介于1~100 nm的氢氧化铁是胶体。
蛋白质分子与淀粉分子的大小都在几十纳米左右,则淀粉溶液、豆浆、牛奶都是胶体吗?
思考2
提示 是,分散质粒子的直径介于1~100 nm时形成的分散系称为胶体。
3.胶体的性质
(1)渗析
①概念
胶体的分散质微粒不能透过半透膜,而小分子、离子能够透过半透膜,因此可以利用半透膜分离胶体中的杂质分子或离子。这种提纯、精制胶体的方法称为渗析。
②操作
如图除去Fe(OH)3胶体中的FeCl3,将混合物盛于半透膜制作的渗析袋中,置于流动(或频繁更换)的蒸馏水里一段时间即可。
半透膜是一种比滤纸孔隙更小,只能允许小分子或离子扩散进出的薄膜。
动物肠衣
鸡蛋壳膜
如何证明Cl-透过半透膜?
思考3
提示 取渗析后蒸馏水中的少许液体,滴加少量AgNO3溶液,若产生白色沉淀,证明Cl-已透过半透膜。
(2)丁达尔现象或丁达尔效应
操作 从垂直于光线的 方向观察现象 原因分析
可见光源
碘化银胶体
可见光源
盐酸
一条光亮的通路
(丁达尔效应或丁达尔现象)
胶粒的直径为10-9~10-7 m,能对光线散射
溶液中粒子的直径小于10-9 m,散射极其微弱
无明显现象
特别提醒
(1)丁达尔效应是光的散射,属于物理变化。
(2)观察丁达尔效应时应从可见光束的侧面。
(1)结合上面渗析操作图,如何证明Fe(OH)3胶体没有透过半透膜?
思考4
提示 用可见光源照射烧杯中的液体,从侧面不能看到光亮的通路。
(2)基于以上实验探究,思考如何用简便方法区分胶体和溶液?
提示 利用丁达尔效应区分胶体和溶液。
应用体验
1.判断正误
(1)氯化钠溶液均一、稳定、透明,不是分散系
(2)分散系有的是纯净物,有的是混合物
(3)根据能否发生丁达尔现象将分散系分为浊液、溶液和胶体
(4)油水混合物属于乳浊液
×
×
√
×
应用体验
2.如图所示,家庭小实验制得的分散系按分散质粒子大小分类,指明属于哪种分散系(填字母),并回答相关问题。
(1)①溶液: 。②浊液: 。③胶体: 。
AD
BC
EF
应用体验
答案 三者分散系类型不完全相同,食盐水为溶液、碳素墨水和稀牛奶为胶体,本质区别是它们的分散质粒子直径不同,如图:
(2)食盐水、碳素墨水和稀牛奶从外观上看都是均一透明的,三者分散系类型相同吗?根本区别是什么?
归纳总结
溶液、胶体和浊液三种分散系的比较
类型 特征 溶液 胶体 浊液
悬浊液 乳浊液
分散质 微粒直 径大小 <1 nm 1~100 nm >100 nm >100 nm
微粒结构 分子、离子 较多分子的集合体或大分子 大量分子或离子聚集成的固体颗粒 大量分子或离子聚集成的液滴
归纳总结
分散质性质 特点 均一、透明 多数均一、透明 不均一、不透明,久置沉淀 不均一、不透明,久置分层
稳定性 稳定 介稳性 不稳定 不稳定
能否透过滤纸 能 能 不能 -
实例 食盐水、蔗糖溶液、酒精 Fe(OH)3胶体、淀粉胶体 泥水、石灰乳 油水混合物
胶体的制备及应用
1.Fe(OH)3胶体的制备
如图所示,向沸水中逐滴加入1~2 mL饱和FeCl3溶液,继续煮沸至液体呈透明的红褐色,停止加热,反应的化学方程式为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl。
特别提醒
(1)本实验用蒸馏水,不能用自来水,自来水含HCl能等使胶体聚沉;不能过度加热,也不能搅拌,以免Fe(OH)3胶体发生聚沉。
(2)化学方程式不用“ ”和“↓”等符号。
思考
(1)如何检验制备的红褐色液体为Fe(OH)3胶体?
提示 用一束可见光线照射,从侧面观察,若出现一道光亮的通路,则证明成功制得胶体。
(2)含1 mol Fe(OH)3胶粒的胶体中,Fe(OH)3分子个数为NA吗?
提示 不是,Fe(OH)3胶粒为Fe(OH)3分子集合体,1 mol Fe(OH)3胶粒中Fe(OH)3分子个数大于NA。
2.胶体的其他性质
电泳
定义:
原因:
应用:
在通电的情况下,胶体粒子发生定向移动的现象。
胶体的分散质具有巨大的比表面积,能吸附带有某种电荷的离子,从而形成带电微粒。
工业上用于电泳电镀、电泳除尘等。
通电前
通电后
﹣
﹢
氢氧化铁胶体的电泳现象
聚沉
定义:
原因:
应用:
在一定条件下胶体的分散质微粒聚集成较大的微粒,在重力作用下沉淀析出的现象。
①加入酸、碱或盐等物质
②加热
③搅拌
豆腐的制作,黄河三角洲的形成等
氢氧化铁胶体的聚沉
加入Na2SO4溶液
3.胶体的应用
(1)将盐卤或石膏加入豆浆,制成豆腐。
(2)一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞。
(3)工厂常利用高压静电除大量烟尘。
(4)手被割破时,可用FeCl3溶液应急止血。
(5)海河交界处易形成三角洲。
(6)医疗上的血液透析。
(7)明矾常用作净水剂。
特别提醒
(1)明矾做净水剂是利用明矾溶于水能形成Al(OH)3胶体,胶体具有吸附性,但胶体没有杀菌消毒的作用。
(2)胶体不带电荷,胶体微粒(分散质微粒)可能带电荷,例如金属氢氧化物等的胶体微粒带正电荷、淀粉胶体中的胶体微粒不带电荷。
应用体验
1.判断正误
(1)医疗上的血液透析利用了胶体的性质
(2)放电影时,放映机前的一条光亮的“通路”,是气溶胶发生的丁达尔现象
(3)胶体带电荷,在通电时会发生电泳现象
(4)胶体在一定条件下发生聚沉,属于化学变化
×
√
×
√
应用体验
2.(2022·福建师大附中高一期末)下列关于胶体的叙述不正确的是
A.光线通过时,胶体发生丁达尔效应,溶液不能发生丁达尔效应
B.可以用滤纸通过过滤的方法,将胶体中的胶体粒子分离出来
C.渗析是用半透膜把小分子或离子从胶体中分离出来,达到净化胶体的
目的
D.将饱和FeCl3溶液滴入沸水中,继续加热煮沸得到红褐色液体即可制
备Fe(OH)3胶体
√
溶液中的粒子和胶体中的粒子都能透过滤纸
