2.3.1 认识氧化还原反应 课件(共31页)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3.1 认识氧化还原反应 课件(共31页)2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 00:17:25 | ||
图片预览










文档简介
(共31张PPT)
第1课时 认识氧化还原反应
第2章 第3节
1.能通过分析元素化合价的变化判断化学反应是否是氧化还原反应(重点)。
2.知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移
的方向和数目(难点)。
3.理清氧化还原反应与四种基本反应类型之间的关系。
学习目标
新课导入
氧化还原反应是化学反应中的重要反应。自然界中的燃烧、呼吸作用、光合作用,生产生活中的化学电池、金属冶炼、火箭发射等都与该反应息息相关。
认识氧化还原反应
一
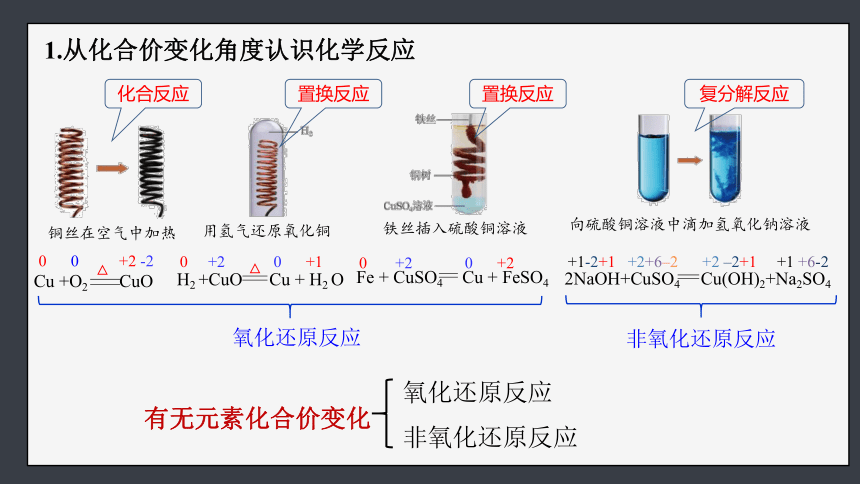
1.从化合价变化角度认识化学反应
铜丝在空气中加热
用氢气还原氧化铜
铁丝插入硫酸铜溶液
向硫酸铜溶液中滴加氢氧化钠溶液
0 0 +2 -2
Cu +O2 CuO
△
H2 +CuO Cu + H2 O
△
0 +2 0 +1
Fe + CuSO4 Cu + FeSO4
0 +2 0 +2
2NaOH+CuSO4 Cu(OH)2+Na2SO4
+1-2+1 +2+6–2 +2 –2+1 +1 +6-2
化合反应
置换反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
有无元素化合价变化
氧化还原反应
非氧化还原反应
2.氧化还原反应
(1)概念:
在反应过程中有元素化合价变化的化学反应。
(2)特征:
反应过程中物质所含元素化合价发生变化。
(3)氧化反应与还原反应
氧化反应:反应物所含某种(或某些)元素化合价升高的反应。
如H2 →H2 O
还原反应:反应物所含某种(或某些)元素化合价降低的反应。
如CuO→Cu。
H2 +CuO Cu + H2 O
△
0 +2 0 +1
思考:氧化反应和还原反应,是分开进行的吗?
同时发生
下列化学反应:
①HCl+NH3===NH4Cl ②2NO+O2===2NO2
思考
⑤H2SO4+2KOH===K2SO4+2H2O ⑥Fe+2HCl===FeCl2+H2↑
⑧Cl2+2NaBr===2NaCl+Br2
⑨CaCO3+2HCl===CaCl2+CO2↑+H2O ⑩
(1)上述反应中属于化合反应的是____,属于分解反应的是____,属于复分解反应的是_____,属于置换反应的是_____,属于氧化还原反应的是_____________。
①②
③④
⑤⑨
⑥⑧
②④⑥⑦⑧ ⑩
(2)四种基本反应类型都是氧化还原反应吗?哪些一定是,哪些一定不是?
思考
提示 四种基本反应类型中,置换反应、有单质参加的化合反应、有单质生成的分解反应一定是氧化还原反应;
复分解反应一定不是氧化还原反应。
归纳总结
1.氧化还原反应与四种基本反应类型之间的关系
归纳总结
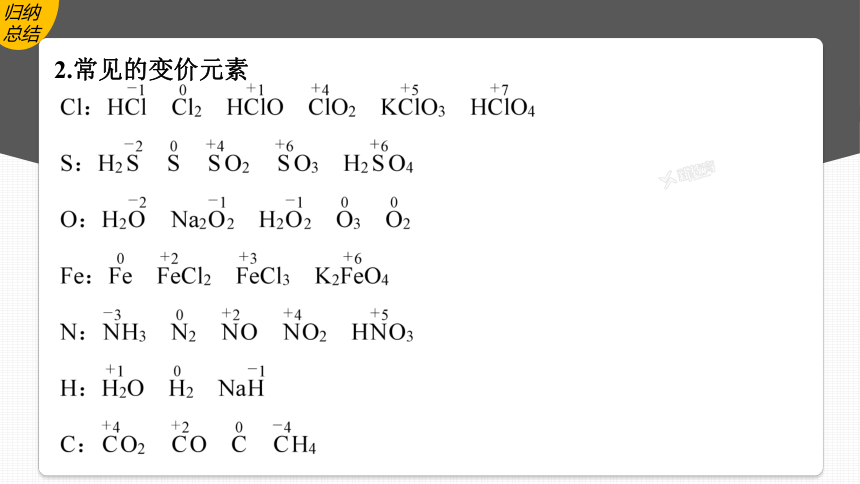
2.常见的变价元素
应用体验
1.判断正误
(1)氧化还原反应中,所有元素的化合价均发生了变化
(2)凡有单质参加的化学反应或有单质生成的化学反应都是氧化还原反应
(3)某元素从化合态变成游离态,一定发生了还原反应
(4)Na和H2O的反应是氧化还原反应
×
×
√
×
应用体验
.
2.(2022·聊城一中高一期中)歌曲《青花瓷》唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜),铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O
===Cu2(OH)2CO3。下列有关该反应的说法正确的是
A.Cu2(OH)2CO3(碱式碳酸铜)属于盐,能与盐酸反应
B.该反应中氧元素和碳元素化合价均发生变化,所以是氧化还原反应
C.该反应中O2被氧化,氧元素化合价从0价降低到-2价
D.该反应是氧化还原反应,有3种元素化合价发生改变
√
0 0 +4 -2 +1 -2
+2 -2 +1 +4 -2
C元素的化合价没有发生变化
被还原
2种 Cu元素和O元素
返回
氧化还原反应的实质
二
1.探究氧化还原反应的实质
思考
在反应过程中,钠原子变成了Na+,氯原子变成了Cl-。钠原子和氯原子是怎样变化为Na+和Cl-并进而形成氯化钠的呢?
提示
电子的得失
Cl
7 8 2
+17
Na
2 8 1
+11
Na+
2 8
+11
Na+ Cl-
Cl-
8 8 2
+17
e-
(2)以Fe+CuSO4===Cu+FeSO4为例
装置及操作 现象 解释
①溶液蓝色变浅;
②碳棒表面析出红色物质;
③电流表指针发生偏转
Fe+Cu2+===Fe2++Cu
①Fe Fe2+(绿色);
②Cu2+ Cu(红色);
③有电子转移,形成电流
(3)结论
2Na+Cl2===2NaCl
点燃
0 0 +1 -1
失1e-×2,价升高,被氧化
得1e-×2 ,价降低,被还原
0
0
+2
+2
Fe + CuSO4 FeSO4 + Cu
失2e-×1,价升高,被氧化
得2e-×1 ,价降低,被还原
氧化反应:反应物所含原子或离子失去电子的反应;
还原反应:反应物所含原子或离子得到电子的反应;
氧化还原反应实质:电子转移是氧化还原反应的实质
归纳总结
归纳总结
氧化还原反应的实质与特征
2.氧化还原反应中电子转移的表示方法
(1)双线桥
表示同种元素的原子在反应前后电子转移的情况。
基本步骤:
箭头指向:同一元素
得失电子是守恒的
失去1×2e-
得到1×2e-
标价态→
连双线→
注得失
注意事项:
应用:体现“谁变谁”,用于分析 “剂”
与“产物” 关系及配平。
标“得、失”等
0
0
+2
+2
Fe + CuSO4 FeSO4 + Cu
用双线桥表示下列反应中电子转移的情况:
例1
答案
(2)单线桥
表示反应过程中不同元素(或同种元素)原子间的电子转移的情况。
基本步骤:
只标明电子转移总数, ,不标“得、失”
2e-
标价态→
连单线→
标电子
注意事项:
应用:体现“谁给谁”,便于分析电子转移方向和数目
始于还原剂中价升高的元素,止于氧化剂中价降低的元素
箭头指向价降低的元素
0
0
+2
+2
Fe + CuSO4 FeSO4 + Cu
用单线桥表示下列反应电子转移的情况:
例2
答案
应用体验
1.判断正误
(1)金属单质参与的化学反应,金属单质一定失去电子
(2)在Zn和CuSO4溶液反应时,Zn失电子发生还原反应
(3)氧化还原反应中,有一种元素发生氧化反应必定有另一种元素发生还原反应
(4)只要是氧化还原反应,一定存在电子的转移
(5)氧化还原反应中转移电子总数是得到的电子数和失去的电子数二者的加和
×
×
√
×
√
应用体验
.
2.(1)用双线桥表示下列反应中电子转移的情况。
①Cl2+2NaOH===NaCl+NaClO+H2O
答案
应用体验
.
②SO2+2H2S===3S↓+2H2O
答案
应用体验
.
(2)用单线桥表示下列反应中电子转移的情况。
答案
应用体验
.
②Cl2+2NaOH===NaCl+NaClO+H2O
答案
1.下列关于氧化还原反应的说法正确的是
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
√
1
2
3
自我测试
4
2.(2022·河南许昌联考)下列反应不属于基本反应类型,但属于氧化还原反应的是
A.Cu+2AgNO3===Cu(NO3)2+2Ag
B.BaCl2+Na2CO3===BaCO3↓+2NaCl
1
2
3
自我测试
4
√
置换反应
复分解反应
分解反应
3.(2023·北京八中高一检测)下列物质长期露置于空气中会变质,但不涉及氧化还原反应的是
A.Na B.Ca(OH)2 C.Na2O2 D.氯水
√
1
2
3
自我测试
4
Na+O2→Na2O
0
+1
Na2O2+CO2→Na2CO3+O2
-1
0
HClO → HCl+O2
-2
0
+1
-1
4.下列反应中,电子转移的方向和数目是否正确?不正确的说明理由。
(1)
1
2
3
自我测试
4
提示 电子转移的“得失”描述错误,Fe应失去2e-×1,H2SO4中H+应得到e-×2。
(2)
1
2
3
自我测试
4
提示 电子转移的方向错误,应由CO中的C元素指向CuO中的Cu元素。
(3)
提示 电子转移的数目错误,应转移2e-×3,共6e-。
返回
第1课时 认识氧化还原反应
第2章 第3节
1.能通过分析元素化合价的变化判断化学反应是否是氧化还原反应(重点)。
2.知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移
的方向和数目(难点)。
3.理清氧化还原反应与四种基本反应类型之间的关系。
学习目标
新课导入
氧化还原反应是化学反应中的重要反应。自然界中的燃烧、呼吸作用、光合作用,生产生活中的化学电池、金属冶炼、火箭发射等都与该反应息息相关。
认识氧化还原反应
一
1.从化合价变化角度认识化学反应
铜丝在空气中加热
用氢气还原氧化铜
铁丝插入硫酸铜溶液
向硫酸铜溶液中滴加氢氧化钠溶液
0 0 +2 -2
Cu +O2 CuO
△
H2 +CuO Cu + H2 O
△
0 +2 0 +1
Fe + CuSO4 Cu + FeSO4
0 +2 0 +2
2NaOH+CuSO4 Cu(OH)2+Na2SO4
+1-2+1 +2+6–2 +2 –2+1 +1 +6-2
化合反应
置换反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
有无元素化合价变化
氧化还原反应
非氧化还原反应
2.氧化还原反应
(1)概念:
在反应过程中有元素化合价变化的化学反应。
(2)特征:
反应过程中物质所含元素化合价发生变化。
(3)氧化反应与还原反应
氧化反应:反应物所含某种(或某些)元素化合价升高的反应。
如H2 →H2 O
还原反应:反应物所含某种(或某些)元素化合价降低的反应。
如CuO→Cu。
H2 +CuO Cu + H2 O
△
0 +2 0 +1
思考:氧化反应和还原反应,是分开进行的吗?
同时发生
下列化学反应:
①HCl+NH3===NH4Cl ②2NO+O2===2NO2
思考
⑤H2SO4+2KOH===K2SO4+2H2O ⑥Fe+2HCl===FeCl2+H2↑
⑧Cl2+2NaBr===2NaCl+Br2
⑨CaCO3+2HCl===CaCl2+CO2↑+H2O ⑩
(1)上述反应中属于化合反应的是____,属于分解反应的是____,属于复分解反应的是_____,属于置换反应的是_____,属于氧化还原反应的是_____________。
①②
③④
⑤⑨
⑥⑧
②④⑥⑦⑧ ⑩
(2)四种基本反应类型都是氧化还原反应吗?哪些一定是,哪些一定不是?
思考
提示 四种基本反应类型中,置换反应、有单质参加的化合反应、有单质生成的分解反应一定是氧化还原反应;
复分解反应一定不是氧化还原反应。
归纳总结
1.氧化还原反应与四种基本反应类型之间的关系
归纳总结
2.常见的变价元素
应用体验
1.判断正误
(1)氧化还原反应中,所有元素的化合价均发生了变化
(2)凡有单质参加的化学反应或有单质生成的化学反应都是氧化还原反应
(3)某元素从化合态变成游离态,一定发生了还原反应
(4)Na和H2O的反应是氧化还原反应
×
×
√
×
应用体验
.
2.(2022·聊城一中高一期中)歌曲《青花瓷》唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜),铜在潮湿的空气中生锈的化学反应为2Cu+O2+CO2+H2O
===Cu2(OH)2CO3。下列有关该反应的说法正确的是
A.Cu2(OH)2CO3(碱式碳酸铜)属于盐,能与盐酸反应
B.该反应中氧元素和碳元素化合价均发生变化,所以是氧化还原反应
C.该反应中O2被氧化,氧元素化合价从0价降低到-2价
D.该反应是氧化还原反应,有3种元素化合价发生改变
√
0 0 +4 -2 +1 -2
+2 -2 +1 +4 -2
C元素的化合价没有发生变化
被还原
2种 Cu元素和O元素
返回
氧化还原反应的实质
二
1.探究氧化还原反应的实质
思考
在反应过程中,钠原子变成了Na+,氯原子变成了Cl-。钠原子和氯原子是怎样变化为Na+和Cl-并进而形成氯化钠的呢?
提示
电子的得失
Cl
7 8 2
+17
Na
2 8 1
+11
Na+
2 8
+11
Na+ Cl-
Cl-
8 8 2
+17
e-
(2)以Fe+CuSO4===Cu+FeSO4为例
装置及操作 现象 解释
①溶液蓝色变浅;
②碳棒表面析出红色物质;
③电流表指针发生偏转
Fe+Cu2+===Fe2++Cu
①Fe Fe2+(绿色);
②Cu2+ Cu(红色);
③有电子转移,形成电流
(3)结论
2Na+Cl2===2NaCl
点燃
0 0 +1 -1
失1e-×2,价升高,被氧化
得1e-×2 ,价降低,被还原
0
0
+2
+2
Fe + CuSO4 FeSO4 + Cu
失2e-×1,价升高,被氧化
得2e-×1 ,价降低,被还原
氧化反应:反应物所含原子或离子失去电子的反应;
还原反应:反应物所含原子或离子得到电子的反应;
氧化还原反应实质:电子转移是氧化还原反应的实质
归纳总结
归纳总结
氧化还原反应的实质与特征
2.氧化还原反应中电子转移的表示方法
(1)双线桥
表示同种元素的原子在反应前后电子转移的情况。
基本步骤:
箭头指向:同一元素
得失电子是守恒的
失去1×2e-
得到1×2e-
标价态→
连双线→
注得失
注意事项:
应用:体现“谁变谁”,用于分析 “剂”
与“产物” 关系及配平。
标“得、失”等
0
0
+2
+2
Fe + CuSO4 FeSO4 + Cu
用双线桥表示下列反应中电子转移的情况:
例1
答案
(2)单线桥
表示反应过程中不同元素(或同种元素)原子间的电子转移的情况。
基本步骤:
只标明电子转移总数, ,不标“得、失”
2e-
标价态→
连单线→
标电子
注意事项:
应用:体现“谁给谁”,便于分析电子转移方向和数目
始于还原剂中价升高的元素,止于氧化剂中价降低的元素
箭头指向价降低的元素
0
0
+2
+2
Fe + CuSO4 FeSO4 + Cu
用单线桥表示下列反应电子转移的情况:
例2
答案
应用体验
1.判断正误
(1)金属单质参与的化学反应,金属单质一定失去电子
(2)在Zn和CuSO4溶液反应时,Zn失电子发生还原反应
(3)氧化还原反应中,有一种元素发生氧化反应必定有另一种元素发生还原反应
(4)只要是氧化还原反应,一定存在电子的转移
(5)氧化还原反应中转移电子总数是得到的电子数和失去的电子数二者的加和
×
×
√
×
√
应用体验
.
2.(1)用双线桥表示下列反应中电子转移的情况。
①Cl2+2NaOH===NaCl+NaClO+H2O
答案
应用体验
.
②SO2+2H2S===3S↓+2H2O
答案
应用体验
.
(2)用单线桥表示下列反应中电子转移的情况。
答案
应用体验
.
②Cl2+2NaOH===NaCl+NaClO+H2O
答案
1.下列关于氧化还原反应的说法正确的是
A.氧化还原反应前后元素化合价有升降
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程一定是氧化反应
D.元素化合价升高的反应是还原反应
√
1
2
3
自我测试
4
2.(2022·河南许昌联考)下列反应不属于基本反应类型,但属于氧化还原反应的是
A.Cu+2AgNO3===Cu(NO3)2+2Ag
B.BaCl2+Na2CO3===BaCO3↓+2NaCl
1
2
3
自我测试
4
√
置换反应
复分解反应
分解反应
3.(2023·北京八中高一检测)下列物质长期露置于空气中会变质,但不涉及氧化还原反应的是
A.Na B.Ca(OH)2 C.Na2O2 D.氯水
√
1
2
3
自我测试
4
Na+O2→Na2O
0
+1
Na2O2+CO2→Na2CO3+O2
-1
0
HClO → HCl+O2
-2
0
+1
-1
4.下列反应中,电子转移的方向和数目是否正确?不正确的说明理由。
(1)
1
2
3
自我测试
4
提示 电子转移的“得失”描述错误,Fe应失去2e-×1,H2SO4中H+应得到e-×2。
(2)
1
2
3
自我测试
4
提示 电子转移的方向错误,应由CO中的C元素指向CuO中的Cu元素。
(3)
提示 电子转移的数目错误,应转移2e-×3,共6e-。
返回
