2.3.2 氧化剂和还原剂 课件(共27张PPT) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3.2 氧化剂和还原剂 课件(共27张PPT) 2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第2课时 氧化剂和还原剂
第2章 第3节
1.能从化学反应中元素化合价的变化认识氧化剂、还原剂、氧化产物、还原产
物等概念,熟知常见的氧化剂和还原剂,理清相关概念间的关系(重点)。
2.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性,建
立判断物质氧化性、还原性强弱的“思维模型”(难点)。
学习目标
新课导入
红酒中添加SO2具有抗氧化的作用
食品包装中的脱氧剂——还原铁粉
氧化剂和还原剂
用“双线桥”表示下列反应中电子转移的情况,并描述物质变化与化合价变化及电子转移的关系。
思考1
+3 +2 0 +4
失去3×2e-
得到2×3e-
化合价升高,失电子,被氧化,发生氧化反应
化合价降低,得电子,被还原,发生还原反应
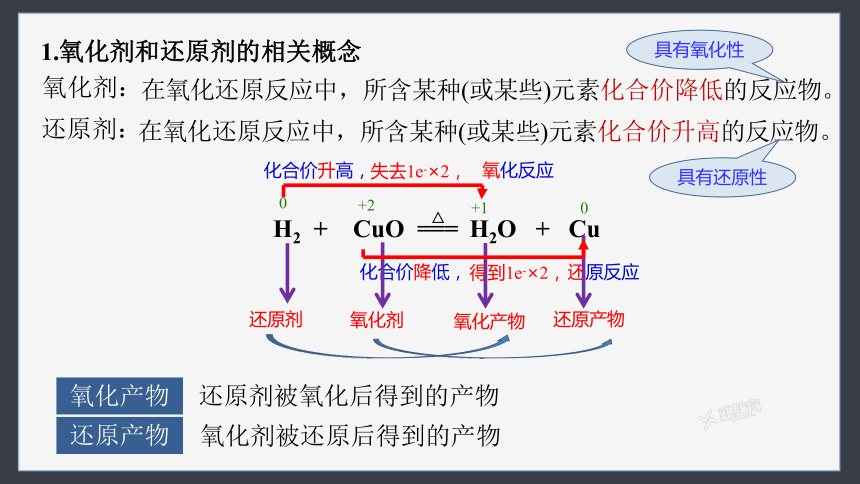
1.氧化剂和还原剂的相关概念
氧化剂:
在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物。
还原剂:
在氧化还原反应中,所含某种(或某些)元素化合价升高的反应物。
H2 + CuO === H2O + Cu
+2
0
0
+1
氧化反应
化合价升高,
还原反应
化合价降低,
失去1e-×2,
得到1e-×2,
还原剂
氧化剂
氧化产物
还原产物
氧化产物
还原剂被氧化后得到的产物
还原产物
氧化剂被还原后得到的产物
△
具有还原性
具有氧化性
已知氧化还原反应:
5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
(1)上述反应中H2O2→O2,氧元素的化合价由____价升高到___价,因而H2O2是_______,O2是________。
(2)上述反应中KMnO4→MnSO4,Mn元素的化合价由____价降低到___价,因而KMnO4 是______,MnSO4是________。
(3)该反应中H2SO4是氧化剂吗?是还原剂吗?分析其原因。
思考2
-1
0
还原剂
氧化产物
+7
+2
氧化剂
还原产物
提示 H2SO4中各元素的化合价在反应前后都不变,因此H2SO4既不是氧化剂也不是还原剂。
+1 -1 +7 -2 +2 0
(4)该反应中,H2O是氧化产物吗?是还原产物吗?分析其原因。
思考2
提示 生成物H2O中的各元素没有价态变化,所以H2O既不是氧化产物也不是还原产物。
归纳总结
理解氧化还原反应的相关概念及相互关系,要抓住两条线:
记忆口诀:升失氧,还原剂;降得还,氧化剂。
氧化剂
氧化
性
得电子
价降低
还原
反应
还原
产物
还原
剂
还原
性
失电子
价升高
氧化
反应
氧化
产物
具有
发生
生成
具有
生成
反应物
性质
本质
特征
同时发生
生成物
发生
2.常见的氧化剂和还原剂
(1)常见的氧化剂
①活泼性较强的非金属单质:如Cl2、O2等。
②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3、KClO3等。
③过氧化物:如Na2O2、H2O2等。
④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
Cl2 浓硝酸 KMnO4(H+) Fe3+ H2O2
漂白粉[Ca(ClO)2]
(2)常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如H2、S、C等。
③含有较低价态元素的氧化物和盐:如CO、SO2、KI、Na2SO3、FeSO4等。
④其他:如浓盐酸、NH3等。
还原铁粉
硫黄
浓盐酸
应用体验
1.判断正误
(1)非金属单质在反应中只能做氧化剂,不能做还原剂
(2)反应中,某元素化合价升高,失去电子,表现出还原性
(3)在反应中,阳离子只能得到电子被还原,阴离子只能失去电子被氧化
(4)氧化剂得到电子被氧化,生成的产物为还原产物
(5)在同一反应中,氧化剂和还原剂不可能是同一种物质
(6)氧化还原反应的生成物一定是一种为氧化产物,另一种为还原产物
×
×
√
×
×
×
应用体验
.
2.分析下列反应,用化学式或元素符号填空。
(1)H2O2+2H++2Fe2+===2Fe3++2H2O
还原剂是 ,还原产物是 。
(2)2H2S+SO2===3S↓+2H2O
还原剂是 ,氧化产物是 ,还原产物是 。
(3)S+2KNO3+3C K2S+N2↑+3CO2↑中还原剂是 ,氧化剂是 ,碳元素被 ,硫元素被 ,氮元素被 ,氧元素既没被氧化也没被还原。
Fe2+
H2O
H2S
S
S
C
S、KNO3
氧化
还原
还原
应用体验
.
3.(2022·广东茂名一中高一期中)氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气,下列说法错误的是
A.氧化产物为N2
B.该反应NH3被还原
C.该反应HCl是还原产物
D.生成1 mol N2有6 mol电子转移
√
0 -3+1 0 +1 -1
氮元素化合价由-3价升高到0价,被氧化
物质的氧化性和还原性
1.氧化性和还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
2.实验探究:元素化合价与物质的氧化性、还原性关系
(1)实验操作及现象
酸性高锰酸钾溶液
碘化钾溶液
溶液由紫色变成棕黄色,有碘单质和Mn2+生成
3.物质的氧化性及还原性与核心元素化合价的关系
只具有还原性
既具有还原性
又具有氧化性
只具有氧化性
最低价
中间价
最高价
从氧化性、还原性的角度认识和研究物质的性质
①Fe2+ ②SO2 ③H+ ④Cl- ⑤Na+⑥Al中,只具有氧化性的是_____(填序号,下同),只具有还原性的是 ,既具有氧化性又具有还原性的是 。
思考
③⑤
④⑥
①②
4.氧化性、还原性强弱的判断方法
(1)根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
(2)根据元素活动性顺序判断,如根据金属活动性顺序表
金属
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
单质的还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
阳离子的氧化性逐渐增强
(3)根据反应的难易(反应条件)程度比较
如:①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4>MnO2。
应用体验
1.判断正误
(1)物质所含元素化合价越高,则该物质氧化性就越强
(2)难失电子的物质,其得电子能力一定越强
(3)1 mol Mg比1 mol Na失电子多,所以还原性:Mg>Na
(4)H2O中H元素为最高价+1价,因此H2O只有氧化性
(5)氧化性和还原性是指物质在反应中得失电子的性质,与得失电子多少无直接关系
×
×
×
√
×
应用体验
.
2.(2022·吉林希望高中高一期末)根据下列反应,判断物质氧化性强弱正确的是
①2H2S+O2===2S↓+2H2O ②4NaI+O2+2H2O===4NaOH+2I2
③Na2S+I2===2NaI+S↓
A.O2>I2>S B.O2>S>I2
C.I2>O2>S D.S>I2>O2
√
氧化剂的氧化性强于氧化产物
1.下列物质属于常见还原剂的是
A.O2 B.KMnO4
C.HNO3 D.活泼金属
√
1
2
3
自我测试
4
2.(2023·江门二中高一检测)下列变化中,需要加入还原剂的是
A.2Cl-→Cl2 B.Fe3+→Fe2+
1
2
3
自我测试
4
√
3.(2023·聊城一中高一检测)某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2 2MgO+C。下列关于该反应的判断正确的是
A.镁元素化合价由0价升高到+2价,所以MgO是还原剂
B.由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C.CO2做氧化剂,表现氧化性,发生氧化反应
D.镁原子失去的电子数目等于氧原子得到的电子数目
√
1
2
3
自我测试
4
0 +4 +2 0
MgO是氧化产物
发生还原反应
碳原子
4.(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是 ,其中氧化性较强的是 。
1
2
3
自我测试
4
Cl2、H+
Cl2
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质:
①Zn+2HCl===ZnCl2+H2↑ ;
酸性、氧化性
②NaOH+HCl===NaCl+H2O ;
酸性
③2HCl H2↑+Cl2↑ ;
氧化性、还原性
④KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O 。
还原性、酸性
第2课时 氧化剂和还原剂
第2章 第3节
1.能从化学反应中元素化合价的变化认识氧化剂、还原剂、氧化产物、还原产
物等概念,熟知常见的氧化剂和还原剂,理清相关概念间的关系(重点)。
2.认识物质的氧化性、还原性,学会分析预测物质具有的氧化性或还原性,建
立判断物质氧化性、还原性强弱的“思维模型”(难点)。
学习目标
新课导入
红酒中添加SO2具有抗氧化的作用
食品包装中的脱氧剂——还原铁粉
氧化剂和还原剂
用“双线桥”表示下列反应中电子转移的情况,并描述物质变化与化合价变化及电子转移的关系。
思考1
+3 +2 0 +4
失去3×2e-
得到2×3e-
化合价升高,失电子,被氧化,发生氧化反应
化合价降低,得电子,被还原,发生还原反应
1.氧化剂和还原剂的相关概念
氧化剂:
在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物。
还原剂:
在氧化还原反应中,所含某种(或某些)元素化合价升高的反应物。
H2 + CuO === H2O + Cu
+2
0
0
+1
氧化反应
化合价升高,
还原反应
化合价降低,
失去1e-×2,
得到1e-×2,
还原剂
氧化剂
氧化产物
还原产物
氧化产物
还原剂被氧化后得到的产物
还原产物
氧化剂被还原后得到的产物
△
具有还原性
具有氧化性
已知氧化还原反应:
5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
(1)上述反应中H2O2→O2,氧元素的化合价由____价升高到___价,因而H2O2是_______,O2是________。
(2)上述反应中KMnO4→MnSO4,Mn元素的化合价由____价降低到___价,因而KMnO4 是______,MnSO4是________。
(3)该反应中H2SO4是氧化剂吗?是还原剂吗?分析其原因。
思考2
-1
0
还原剂
氧化产物
+7
+2
氧化剂
还原产物
提示 H2SO4中各元素的化合价在反应前后都不变,因此H2SO4既不是氧化剂也不是还原剂。
+1 -1 +7 -2 +2 0
(4)该反应中,H2O是氧化产物吗?是还原产物吗?分析其原因。
思考2
提示 生成物H2O中的各元素没有价态变化,所以H2O既不是氧化产物也不是还原产物。
归纳总结
理解氧化还原反应的相关概念及相互关系,要抓住两条线:
记忆口诀:升失氧,还原剂;降得还,氧化剂。
氧化剂
氧化
性
得电子
价降低
还原
反应
还原
产物
还原
剂
还原
性
失电子
价升高
氧化
反应
氧化
产物
具有
发生
生成
具有
生成
反应物
性质
本质
特征
同时发生
生成物
发生
2.常见的氧化剂和还原剂
(1)常见的氧化剂
①活泼性较强的非金属单质:如Cl2、O2等。
②变价元素的高价态化合物:如KMnO4、FeCl3、HNO3、KClO3等。
③过氧化物:如Na2O2、H2O2等。
④其他:如HClO、漂白粉[有效成分为Ca(ClO)2]、MnO2等。
Cl2 浓硝酸 KMnO4(H+) Fe3+ H2O2
漂白粉[Ca(ClO)2]
(2)常见的还原剂
①活泼性较强的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如H2、S、C等。
③含有较低价态元素的氧化物和盐:如CO、SO2、KI、Na2SO3、FeSO4等。
④其他:如浓盐酸、NH3等。
还原铁粉
硫黄
浓盐酸
应用体验
1.判断正误
(1)非金属单质在反应中只能做氧化剂,不能做还原剂
(2)反应中,某元素化合价升高,失去电子,表现出还原性
(3)在反应中,阳离子只能得到电子被还原,阴离子只能失去电子被氧化
(4)氧化剂得到电子被氧化,生成的产物为还原产物
(5)在同一反应中,氧化剂和还原剂不可能是同一种物质
(6)氧化还原反应的生成物一定是一种为氧化产物,另一种为还原产物
×
×
√
×
×
×
应用体验
.
2.分析下列反应,用化学式或元素符号填空。
(1)H2O2+2H++2Fe2+===2Fe3++2H2O
还原剂是 ,还原产物是 。
(2)2H2S+SO2===3S↓+2H2O
还原剂是 ,氧化产物是 ,还原产物是 。
(3)S+2KNO3+3C K2S+N2↑+3CO2↑中还原剂是 ,氧化剂是 ,碳元素被 ,硫元素被 ,氮元素被 ,氧元素既没被氧化也没被还原。
Fe2+
H2O
H2S
S
S
C
S、KNO3
氧化
还原
还原
应用体验
.
3.(2022·广东茂名一中高一期中)氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气,下列说法错误的是
A.氧化产物为N2
B.该反应NH3被还原
C.该反应HCl是还原产物
D.生成1 mol N2有6 mol电子转移
√
0 -3+1 0 +1 -1
氮元素化合价由-3价升高到0价,被氧化
物质的氧化性和还原性
1.氧化性和还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
2.实验探究:元素化合价与物质的氧化性、还原性关系
(1)实验操作及现象
酸性高锰酸钾溶液
碘化钾溶液
溶液由紫色变成棕黄色,有碘单质和Mn2+生成
3.物质的氧化性及还原性与核心元素化合价的关系
只具有还原性
既具有还原性
又具有氧化性
只具有氧化性
最低价
中间价
最高价
从氧化性、还原性的角度认识和研究物质的性质
①Fe2+ ②SO2 ③H+ ④Cl- ⑤Na+⑥Al中,只具有氧化性的是_____(填序号,下同),只具有还原性的是 ,既具有氧化性又具有还原性的是 。
思考
③⑤
④⑥
①②
4.氧化性、还原性强弱的判断方法
(1)根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
(2)根据元素活动性顺序判断,如根据金属活动性顺序表
金属
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
单质的还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
阳离子的氧化性逐渐增强
(3)根据反应的难易(反应条件)程度比较
如:①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4>MnO2。
应用体验
1.判断正误
(1)物质所含元素化合价越高,则该物质氧化性就越强
(2)难失电子的物质,其得电子能力一定越强
(3)1 mol Mg比1 mol Na失电子多,所以还原性:Mg>Na
(4)H2O中H元素为最高价+1价,因此H2O只有氧化性
(5)氧化性和还原性是指物质在反应中得失电子的性质,与得失电子多少无直接关系
×
×
×
√
×
应用体验
.
2.(2022·吉林希望高中高一期末)根据下列反应,判断物质氧化性强弱正确的是
①2H2S+O2===2S↓+2H2O ②4NaI+O2+2H2O===4NaOH+2I2
③Na2S+I2===2NaI+S↓
A.O2>I2>S B.O2>S>I2
C.I2>O2>S D.S>I2>O2
√
氧化剂的氧化性强于氧化产物
1.下列物质属于常见还原剂的是
A.O2 B.KMnO4
C.HNO3 D.活泼金属
√
1
2
3
自我测试
4
2.(2023·江门二中高一检测)下列变化中,需要加入还原剂的是
A.2Cl-→Cl2 B.Fe3+→Fe2+
1
2
3
自我测试
4
√
3.(2023·聊城一中高一检测)某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2 2MgO+C。下列关于该反应的判断正确的是
A.镁元素化合价由0价升高到+2价,所以MgO是还原剂
B.由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C.CO2做氧化剂,表现氧化性,发生氧化反应
D.镁原子失去的电子数目等于氧原子得到的电子数目
√
1
2
3
自我测试
4
0 +4 +2 0
MgO是氧化产物
发生还原反应
碳原子
4.(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是 ,其中氧化性较强的是 。
1
2
3
自我测试
4
Cl2、H+
Cl2
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在四个反应中,分别表现什么性质:
①Zn+2HCl===ZnCl2+H2↑ ;
酸性、氧化性
②NaOH+HCl===NaCl+H2O ;
酸性
③2HCl H2↑+Cl2↑ ;
氧化性、还原性
④KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O 。
还原性、酸性
