2.2.1 电解质的电离 课件 (共24页)2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2.1 电解质的电离 课件 (共24页)2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
第1课时 电解质的电离
第2章 第2节
1.正确理解电解质的概念,了解常见的电解质,能从不同层次认识物质的多样
性(重点)。
2.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离,能用电离方
程式表示某些酸、碱、盐的电离(难点)。
学习目标
电解质的电离
【思考】给电器设备通电时,湿手操作容易发生触电事故。这是
为什么呢?
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),
这样湿手就成了导电体,此时去摸开关是十分危险的。
NaCl固体 溶于水到底发生了什么变化呢?
1.物质的导电性与电离
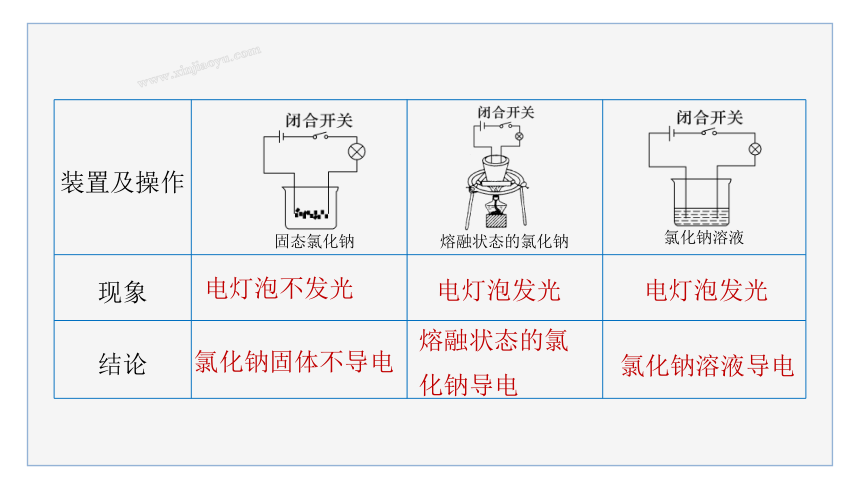
(1)实验探究:NaCl的导电性
装置及操作
现象
结论
电灯泡不发光
电灯泡发光
氯化钠固体不导电
熔融状态的氯化钠导电
固态氯化钠
熔融状态的氯化钠
氯化钠溶液
电灯泡发光
氯化钠溶液导电
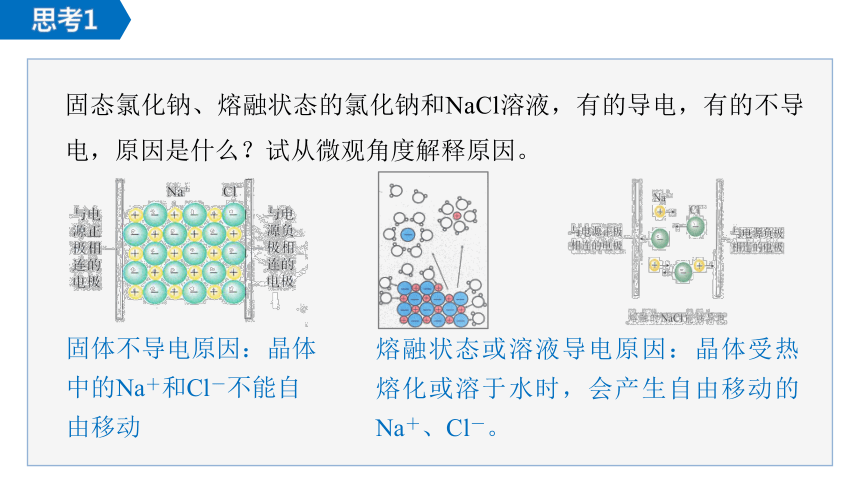
固态氯化钠、熔融状态的氯化钠和NaCl溶液,有的导电,有的不导电,原因是什么?试从微观角度解释原因。
思考1
固体不导电原因:晶体中的Na+和Cl-不能自由移动
熔融状态或溶液导电原因:晶体受热熔化或溶于水时,会产生自由移动的Na+、Cl-。
(2)电离
②表示方法——电离方程式
①概念:像氯化钠这样,溶于水或受热熔化时解离成能够自由移动的离子的过程称为电离。
写出NaCl熔融状态下或在水溶液中的电离方程式。
用化学式和离子符号表示物质电离过程的式子。
熔融状态:NaCl===Na++Cl-
在水溶液中:NaCl===Na++Cl-
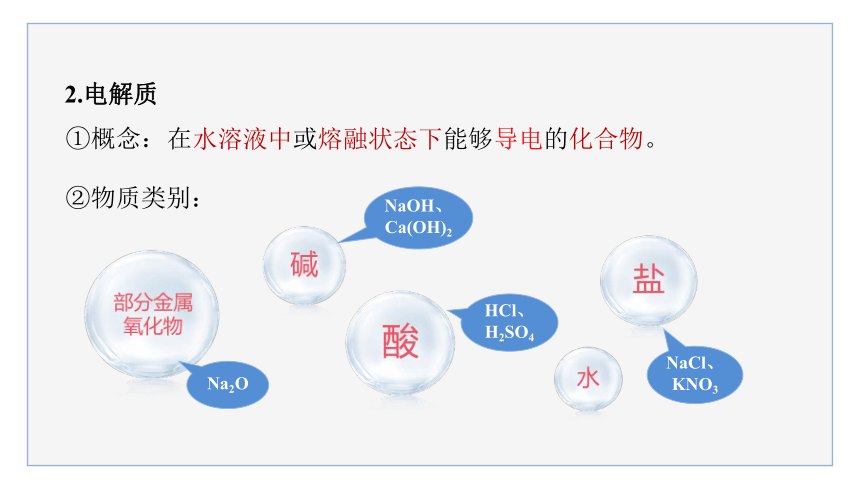
2.电解质
①概念:
在水溶液中或熔融状态下能够导电的化合物。
②物质类别:
Na2O
HCl、H2SO4
NaCl、KNO3
NaOH、 Ca(OH)2
SO2的水溶液导电能说明SO2是电解质吗?为什么?
思考2
提示 不能,因为SO2溶于水生成了H2SO3,H2SO3电离使水溶液导电而非SO2自身电离。
知识拓展
在水溶液中和熔融状态下均以分子形式存在,因而不能导电的化合物
非金属氧化物,如CO2、SO2等
大部分有机物,如蔗糖、酒精等
部分非金属氢化物,如NH3、CH4等
非电解质
概 念
物质类别
3.从电离角度认识酸、碱、盐
KOH===K++OH-
Ca(OH)2===Ca2++2OH-
练习:书写HNO3、H2SO4 、KOH、 Ca(OH)2、 NH4NO3、Al2(SO4)3的电离方程式。
HNO3===H++
H2SO4===2H++
酸
碱
盐
电离时生成的阳离子
全部是H+的化合物
电离时生成的阴离子
全部是OH-的化合物
电离时能生成金属阳离子(或铵离子)和酸根离子的化合物
NH4NO3===+
Al2(SO4)3===2Al3++3
应用体验
1.判断正误
(1)铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质
(2)NH3、CO2的水溶液都能导电,所以NH3、CO2均是电解质
(3)NaCl是电解质,所以NaCl固体可以导电
(4)BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质
(5)HCl溶于水后能导电,但熔融状态下不导电
×
×
√
×
×
应用体验
.
2.(2023·菏泽高一期末)下列物质在水溶液中的电离方程式书写正确的是
(NH4)2SO4 ===()2+
B. K2CO3 === 2K++C4++3O2-
C. H2SO4 === +
D. KAl(SO4)2 === K++Al3++2
√
(NH4)2SO4 === 2+
K2CO3 === 2K++
H2SO4 ===2H++
应用体验
.
3.现有下列物质:
①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩胆矾晶体
请用序号填空:
(1)上述物质在相应状态下可导电的是 。
(2)属于电解质的是 。
(3)属于非电解质的是 。
(4)属于能导电的电解质的是 。
(5)上述状态下的电解质不能导电的是 。
②④⑥⑨
①③⑦⑨⑩
⑤⑧
⑨
①③⑦⑩
归纳总结
理解电解质注意掌握三个关系
(1)电解质与物质类别的关系
酸、碱、盐、水和活泼金属氧化物都是电解质。
(2)电解质与导电性的关系
①能导电的物质不一定是电解质,如金属、石墨、盐酸等;电解质本身也不一定能导电,如NaCl固体、HCl气体等。
②有些电解质溶于水能导电,在熔融状态下不能导电,如HCl、H2SO4等;有些电解质只在熔融状态下能导电,如BaSO4、CaCO3等。
归纳总结
③溶于水能导电的化合物本身不一定是电解质,如SO2、NH3等。
(3)电解质与溶解性的关系
电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
电解质的分类及电离的应用
定义:在水溶液中部分电离的电解质
定义:在水溶液中能完全电离的电解质
强电解质
弱电解质
电解质
1.电解质的分类(从电离程度)
类别:强酸:H2SO4、HNO3、HCl等
强碱:NaOH、KOH、Ba(OH)2等
大部分盐:NaCl、CaCO3等
类别:弱酸:H2CO3、CH3COOH、HClO等
弱碱:NH3·H2O等
水
思考
(1)盐酸与醋酸溶液中存在的微粒有区别吗?
提示 有区别。
盐酸是强酸,属于强电解质,盐酸中HCl以H+、Cl-的形式存在;
醋酸是弱电解质,在溶液中主要以CH3COOH分子存在,少部分电离出H+、CH3COO-。
思考
(2)小明在做“电解质溶液导电性”实验时发现,相同浓度的盐酸和醋酸,盐酸的导电性强,醋酸的导电性弱。他从实验中得出结论“强电解质导电能力强,弱电解质导电能力弱”这个结论对吗?为什么?
提示 不对。因为导电性和离子浓度有关,有些强电解质,如CaCO3,溶解度小,在溶液中虽完全电离,但离子浓度小,导电性弱,而有些弱电解质,如CH3COOH,易溶于水,离子浓度大,导电性也可以很强。
2.电解质溶液中离子浓度测定
(2)可用pH计测定溶液中H+或OH-的浓度。
(1)含有某些离子的电解质溶液会呈现出一定的颜色且溶液的颜色随着所含离子浓度的加大而加深,可以用比色计测定溶液中相关离子浓度。
电解质溶液中存在自由移动的阴、阳离子,因而溶液会表现出一定性质,故可用一些方法测得溶液中某些离子浓度。
应用体验
1.判断正误
(1)依据电解质在水溶液中电离程度不同,电解质可分为强电解质和弱电解质
(2)AgCl在水溶液中几乎不导电,是因为AgCl是弱电解质
(3)强电解质在液态时,有的导电,有的可能不导电
(4)根据溶液的电导率,可以测定溶液中某些离子浓度的大小
×
√
√
√
应用体验
A B C D
KCl 0.64 mol 0.40 mol 0.64 mol 0.64 mol
NH4Cl 0.05 mol 0.05 mol 0.02 mol 0.03 mol
(NH4)2SO4 0.24 mol 0.12 mol 0.24 mol 0.24 mol
√
2.(2022·福建三明高一期末)无土培植中,需配制含0.50 mol·L-1 、0.64 mol·L-1 K+、0.66 mol·L-1 Cl-、0.24 mol·L-1 的营养液。若用KCl、NH4Cl、(NH4)2SO4三种固体配制1 L营养液,需此三种固体的物质的量为
0.24 mol
0.50 mol
0.64 mol K+
0.66 mol Cl-
第1课时 电解质的电离
第2章 第2节
1.正确理解电解质的概念,了解常见的电解质,能从不同层次认识物质的多样
性(重点)。
2.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离,能用电离方
程式表示某些酸、碱、盐的电离(难点)。
学习目标
电解质的电离
【思考】给电器设备通电时,湿手操作容易发生触电事故。这是
为什么呢?
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),
这样湿手就成了导电体,此时去摸开关是十分危险的。
NaCl固体 溶于水到底发生了什么变化呢?
1.物质的导电性与电离
(1)实验探究:NaCl的导电性
装置及操作
现象
结论
电灯泡不发光
电灯泡发光
氯化钠固体不导电
熔融状态的氯化钠导电
固态氯化钠
熔融状态的氯化钠
氯化钠溶液
电灯泡发光
氯化钠溶液导电
固态氯化钠、熔融状态的氯化钠和NaCl溶液,有的导电,有的不导电,原因是什么?试从微观角度解释原因。
思考1
固体不导电原因:晶体中的Na+和Cl-不能自由移动
熔融状态或溶液导电原因:晶体受热熔化或溶于水时,会产生自由移动的Na+、Cl-。
(2)电离
②表示方法——电离方程式
①概念:像氯化钠这样,溶于水或受热熔化时解离成能够自由移动的离子的过程称为电离。
写出NaCl熔融状态下或在水溶液中的电离方程式。
用化学式和离子符号表示物质电离过程的式子。
熔融状态:NaCl===Na++Cl-
在水溶液中:NaCl===Na++Cl-
2.电解质
①概念:
在水溶液中或熔融状态下能够导电的化合物。
②物质类别:
Na2O
HCl、H2SO4
NaCl、KNO3
NaOH、 Ca(OH)2
SO2的水溶液导电能说明SO2是电解质吗?为什么?
思考2
提示 不能,因为SO2溶于水生成了H2SO3,H2SO3电离使水溶液导电而非SO2自身电离。
知识拓展
在水溶液中和熔融状态下均以分子形式存在,因而不能导电的化合物
非金属氧化物,如CO2、SO2等
大部分有机物,如蔗糖、酒精等
部分非金属氢化物,如NH3、CH4等
非电解质
概 念
物质类别
3.从电离角度认识酸、碱、盐
KOH===K++OH-
Ca(OH)2===Ca2++2OH-
练习:书写HNO3、H2SO4 、KOH、 Ca(OH)2、 NH4NO3、Al2(SO4)3的电离方程式。
HNO3===H++
H2SO4===2H++
酸
碱
盐
电离时生成的阳离子
全部是H+的化合物
电离时生成的阴离子
全部是OH-的化合物
电离时能生成金属阳离子(或铵离子)和酸根离子的化合物
NH4NO3===+
Al2(SO4)3===2Al3++3
应用体验
1.判断正误
(1)铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质
(2)NH3、CO2的水溶液都能导电,所以NH3、CO2均是电解质
(3)NaCl是电解质,所以NaCl固体可以导电
(4)BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质
(5)HCl溶于水后能导电,但熔融状态下不导电
×
×
√
×
×
应用体验
.
2.(2023·菏泽高一期末)下列物质在水溶液中的电离方程式书写正确的是
(NH4)2SO4 ===()2+
B. K2CO3 === 2K++C4++3O2-
C. H2SO4 === +
D. KAl(SO4)2 === K++Al3++2
√
(NH4)2SO4 === 2+
K2CO3 === 2K++
H2SO4 ===2H++
应用体验
.
3.现有下列物质:
①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩胆矾晶体
请用序号填空:
(1)上述物质在相应状态下可导电的是 。
(2)属于电解质的是 。
(3)属于非电解质的是 。
(4)属于能导电的电解质的是 。
(5)上述状态下的电解质不能导电的是 。
②④⑥⑨
①③⑦⑨⑩
⑤⑧
⑨
①③⑦⑩
归纳总结
理解电解质注意掌握三个关系
(1)电解质与物质类别的关系
酸、碱、盐、水和活泼金属氧化物都是电解质。
(2)电解质与导电性的关系
①能导电的物质不一定是电解质,如金属、石墨、盐酸等;电解质本身也不一定能导电,如NaCl固体、HCl气体等。
②有些电解质溶于水能导电,在熔融状态下不能导电,如HCl、H2SO4等;有些电解质只在熔融状态下能导电,如BaSO4、CaCO3等。
归纳总结
③溶于水能导电的化合物本身不一定是电解质,如SO2、NH3等。
(3)电解质与溶解性的关系
电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
电解质的分类及电离的应用
定义:在水溶液中部分电离的电解质
定义:在水溶液中能完全电离的电解质
强电解质
弱电解质
电解质
1.电解质的分类(从电离程度)
类别:强酸:H2SO4、HNO3、HCl等
强碱:NaOH、KOH、Ba(OH)2等
大部分盐:NaCl、CaCO3等
类别:弱酸:H2CO3、CH3COOH、HClO等
弱碱:NH3·H2O等
水
思考
(1)盐酸与醋酸溶液中存在的微粒有区别吗?
提示 有区别。
盐酸是强酸,属于强电解质,盐酸中HCl以H+、Cl-的形式存在;
醋酸是弱电解质,在溶液中主要以CH3COOH分子存在,少部分电离出H+、CH3COO-。
思考
(2)小明在做“电解质溶液导电性”实验时发现,相同浓度的盐酸和醋酸,盐酸的导电性强,醋酸的导电性弱。他从实验中得出结论“强电解质导电能力强,弱电解质导电能力弱”这个结论对吗?为什么?
提示 不对。因为导电性和离子浓度有关,有些强电解质,如CaCO3,溶解度小,在溶液中虽完全电离,但离子浓度小,导电性弱,而有些弱电解质,如CH3COOH,易溶于水,离子浓度大,导电性也可以很强。
2.电解质溶液中离子浓度测定
(2)可用pH计测定溶液中H+或OH-的浓度。
(1)含有某些离子的电解质溶液会呈现出一定的颜色且溶液的颜色随着所含离子浓度的加大而加深,可以用比色计测定溶液中相关离子浓度。
电解质溶液中存在自由移动的阴、阳离子,因而溶液会表现出一定性质,故可用一些方法测得溶液中某些离子浓度。
应用体验
1.判断正误
(1)依据电解质在水溶液中电离程度不同,电解质可分为强电解质和弱电解质
(2)AgCl在水溶液中几乎不导电,是因为AgCl是弱电解质
(3)强电解质在液态时,有的导电,有的可能不导电
(4)根据溶液的电导率,可以测定溶液中某些离子浓度的大小
×
√
√
√
应用体验
A B C D
KCl 0.64 mol 0.40 mol 0.64 mol 0.64 mol
NH4Cl 0.05 mol 0.05 mol 0.02 mol 0.03 mol
(NH4)2SO4 0.24 mol 0.12 mol 0.24 mol 0.24 mol
√
2.(2022·福建三明高一期末)无土培植中,需配制含0.50 mol·L-1 、0.64 mol·L-1 K+、0.66 mol·L-1 Cl-、0.24 mol·L-1 的营养液。若用KCl、NH4Cl、(NH4)2SO4三种固体配制1 L营养液,需此三种固体的物质的量为
0.24 mol
0.50 mol
0.64 mol K+
0.66 mol Cl-
